Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 10 de enero de 2018
Aceptado el 17 de mayo de 2018
On-line el 27 de septiembre de 2018
*Este artículo constituye la primera parte de una revisión sobre el tema que se describe. La segunda parte será publicada en el próximo número.
Palabras clave:
Disfunción eréctil
Hiperplasia benigna de próstata
Riesgo cardiometabólico
Disfunción endotelial
*Autor para correspondencia
Correo electrónico:
navidadespiritu@hotmail.com
Keywords:
Erectile dysfunction
Benign prostatic hyperplasia
Cardiometabolic risk
Endothelial dysfunction
José Manuel Sáez Pérez
Centro de Salud Malvarrosa. Valencia.
Resumen
Es evidente que la disfunción eréctil (DE) y los síntomas del tracto urinario inferior secundarios a la hiperplasia benigna de la próstata (HBP) se superponen en muchas ocasiones y a su vez la DE es considerada como un predictor de daño orgánico endovascular. Resultados recientes indican que las citadas patologías pueden tener una causa subyacente común, como es un aporte sanguíneo disminuido en sus tejidos. Esta certeza fisiopatológica puede indicar una arterioesclerosis subclínica y, si vamos más allá, una manera de expresión de lesión de órgano diana.
Todo ello nos lleva a que debemos estudiar estas entidades también desde un punto de vista cardiometabólico, por los mecanismos vasculares que comparten (disfunción endotelial), e indagar más sobre ellas en nuestros pacientes, ya que el pene ha pasado a ser un “barómetro” de la salud endotelial.
© 2018 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Erectile dysfunction, benign prostatic hyperplasia and cardiometabolic risk: a chain of events in primary care (I)
Abstract
It is clear that erectile dysfunction (ED) and lower urinary tract symptoms secondary to benign prostatic hyperplasia (BPH) often overlap and in turn, ED is considered as a predictor of endovascular organic injury. Recent results indicate that the mentioned conditions can have a common underlying cause, as a decreased blood supply in their tissues. This physiopathology determination can indicate a subclinical arteriosclerosis and, if we go beyond this, a way of expressing a target organ injury.
All this leads us to the fact that we should also study these entities from a cardiometabolic point of view, due to the vascular mechanisms they share (endothelial dysfunction) and investigate more abut them in our patients, since the penis has become a “barometer” of endothelial health.
© 2018 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
El acto de concatenar situaciones en medicina debe ir más allá de unir síntomas, síndromes o actitudes terapéuticas, ya que, siendo lo anterior válido, se queda corto, pues el leitmotiv tiene que ir por delante; es decir, debemos adelantarnos a lo que pueda suceder a través de predictores o síntomas de alarma, que nos hagan pensar en el papel que desempeña la prevención de lesiones de órgano diana (LOD) (prevención primaria) en las tres entidades a desarrollar: la disfunción eréctil (DE), la hiperplasia benigna prostática (HBP) y el riesgo cardiovascular (RCV)1,8.
La DE y los síntomas del tracto urinario inferior (STUI) secundarios a una HBP son enfermedades prevalentes y con frecuencia coexistentes en los varones de mediana edad y de edad avanzada (Tabla 1), y disminuyen la calidad de vida de los mismos.
Por otra parte, la DE de causa vascular arterial es la más común en sujetos mayores de 50 años. Tanto la American Heart Association como la International Diabetes Federation ponen de relieve que una proporción elevada (52 %) de pacientes con DE tienen factores de riesgo cardiovascular (FRCV) clásicos, que a su vez y de manera silente conllevan la LOD. Entre las mismas, el grosor de la íntima-media carotidea (GIMC) es un marcador de arteriosclerosis subclínica. Numerosos estudios han demostrado que el GIMC se asocia a los FRCV tradicionales y, de forma independiente, a episodios cardiovasculares y cerebrovasculares, como infarto de miocardio y accidente vascular encefálico isquémico, aun después de ajustar por los FRCV tradicionales2,3.
La DE y la HBP comparten una serie de factores de riesgo que predisponen a padecer estas patologías, como la edad, la aterosclerosis, la isquemia o las neuropatías.
Resultados recientes indican que la DE y los STUI asociados con la HBP pueden tener una causa subyacente común: un aporte sanguíneo reducido, que de entrada está indicando una arterioesclerosis subclínica y a la vez, por sus síntomas predictores, daño orgánico endovascular.
Todo ello, nos debe hacer pensar que los pacientes con DE y STUI por HBP pueden tener mayor RCV, determinado por la presencia de LOD en diferentes órganos o estructuras vasculares (GIMC) (Fig. 1). Por tanto, debemos indagar más sobre este aspecto; cuando este se presente, hay que estudiarlo de una manera más amplia, tanto desde el punto de vista urológico como de RCV global por la concordancia existente entre estas tres entidades.
Dado que la DE es, en general, más precoz que la cardiopatía isquémica, es actualmente considerada un factor de riesgo de futuros episodios cardiovasculares o, como se la ha catalogado, un “centinela” de la enfermedad cardiovascular (ECV), con un valor predictivo similar al de los clásicos factores de riesgo; el pene ha pasado a ser considerado un “barómetro” de la salud endotelial4,10.
Figura 1 – Ecografía Doppler dúplex color de carótida izquierda, donde se aprecia una estenosis de la misma (flecha amarilla), junto con calcificación y aumento del grosor en la íntima media (GIMC).
Disfunción eréctil y enfermedad cardiovascular
La DE se define como la incapacidad consistente (durable, estable) de lograr o mantener una erección peneana suficiente como para permitir una relación sexual satisfactoria5. Actualmente se considera que predominan las causas orgánicas; el principal responsable es la disfunción endotelial (DL).
Tiene una alta prevalencia: se estima que afecta a unos 100 millones de hombres adultos en el mundo y que afectará a 322 millones en el año 2025.
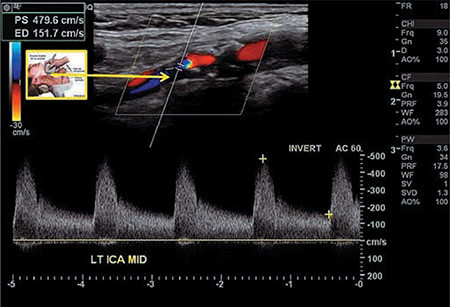
Efectivamente, DE y ECV comparten factores de riesgo y mecanismos de producción. Cada vez es más aceptado que la DE responde en la mayor parte de los casos a DL. Es por todos conocido que esta es una alteración precoz en la enfermedad aterosclerótica6,7, de aquí que el estudio vascular del pene sea una prueba a tener presente (Fig. 2).
La DE suele preceder en su presentación a la ECV clásica. Con un concepto quizá demasiado simplista se ha atribuido esta antelación al menor tamaño de las arterias peneanas (en el orden de los 1-2 mm de diámetro), en comparación con el de las coronarias (3-4 mm), las carótidas (5-7 mm) y las íleo-femorales (6-8 mm). Sea esta hipótesis cierta o no, lo importante es la comprobación de que la DE se manifiesta, en general, unos dos a tres años antes que las manifestaciones de cardiopatía isquémica y, por tanto, su detección puede permitir la adopción de medidas terapéuticas que prevengan las más graves complicaciones CV8. Inversamente, más de las dos terceras partes de los hombres con enfermedad coronaria tienen, cuando se los interroga, antecedentes de DE.
Figura 2 – Ecografía Doppler dúplex color de una paciente con DE, donde se pone de manifiesto una disminución de la velocidad pico sistólica (VPS) en arteria cavernosa derecha, con un valor de 13,4 cm/s, cuando el valor promedio de referencia es de 21 cm/s.
La DE pasa entonces de ser considerada un tema que simplemente afecta a la calidad de vida a ser un “centinela” que alerta de la posibilidad del desarrollo de manifestaciones clínicas de ECV, con lo que se convierte en un asunto de gran interés para los médicos en general y para los cardiólogos en particular8,10.
Mecanismos de la erección peneana
La erección del pene es un fenómeno neurovascular mediado por el óxido nítrico, un potente vasodilatador liberado en los terminales nerviosos y el endotelio de los vasos del pene. Por tanto, para que se produzca la erección se requiere una adecuada función endotelial9,10.
El pene es un órgano hidráulico, constituido por tejido esponjoso que alberga pequeñas cápsulas llamadas cuerpos cavernosos. Cuando la sangre llega hasta ellos se expanden. Histológicamente existen unos sinusoides que son los que al llenarse de sangre venosa procedente de los plexos venosos y merced al tejido trabecular originan los cambios adecuados para que se produzca un aumento de la tumescencia peneana4,6. Dicha tumescencia depende del colapso del plexo venoso de drenaje, ubicado por dentro de una membrana poco extensible, la albugínea. Este colapso se produce cuando los sinusoides de los cuerpos cavernosos (recubiertos por endotelio) se expanden por relajación de las fibras musculares lisas que los rodean y que mantienen, fuera de la erección, una contracción tónica. La relajación de estas fibras musculares lisas es, por tanto, el desencadenante de la erección. La detumescencia se produce por liberación de noradrenalina, que vuelve a disparar la contracción de las células musculares lisas.
Curiosamente, la erección, paradigma de la virilidad es, en esencia, un fenómeno pasivo, consecuencia de la relajación de un músculo liso, y la energía que requiere no depende del miembro viril, sino del corazón. La relajación del músculo liso que promueve estos cambios hidrodinámicos es una respuesta a la liberación del óxido nítrico por parte de las células endoteliales11,12.
El aumento del contenido de óxido nítrico produce disminución de la concentración de calcio en la célula muscular lisa y, por tanto, menor contracción. Una de las vías responsables de este fenómeno es la del guanosin-monofosfato cíclico (cGMP). En su degradación interviene la 5-fosfodiesterasa (PDF5)5. Los inhibidores de la PDF5 (sildenafilo, vardenafilo, tadalafilo y avanafilo) aumentan la disponibilidad de cGMP y son actualmente los fármacos más eficaces para el tratamiento de la DE. Los nitritos aumentan la producción de cGMP, de ahí que su uso simultáneo con los inhibidores de la PDF5 (que producen disminución de la degradación) puede llevar a hipotensiones marcadas e impredecibles y constituye el fundamento de la contraindicación de la asociación.
Todo este proceso depende, para su éxito final, sin olvidar los factores psicológicos, de:
- Un adecuado equilibrio de la actividad del sistema nervioso autónomo (la actividad parasimpática está comprometida en pacientes con diabetes, depresión y enfermedades neurológicas centrales y periféricas; la actividad simpática que impide la relajación del músculo liso está aumentada en el tabaquismo y en los procesos que afectan el tracto urinario, tales como la HBP).
- La integridad de las estructuras anatómicas involucradas y de la presencia de la sintetasa del óxido nítrico neuronal (nNOS) y endotelial (eNOS). Los déficits de la primera suelen ser iatrogénicos, como resultado de cirugía o de irradiación prostática o pélvica; los de la segunda, más frecuentes, constituyen la DL y se asocian a los mismos factores de riesgo que la enfermedad aterosclerótica13-15.
Flujo sanguíneo prostático y del tracto urinario inferior
Existe una compleja red de arterias que suministran sangre oxigenada al tracto urinario inferior (TUI) y a la próstata. El suministro de sangre al área pélvica proviene de la arteria iliaca interna. Dos ramificaciones de ella son las arterias vesicales superior e inferior, que suministran sangre a la vejiga.
La arteria vesical inferior provee de sangre oxigenada a la próstata. La uretra obtiene su suministro de sangre de la arteria pudenda interna y la arteria dorsal del pene. Si el suministro disminuye en estas arterias, puede afectar a la salud de la próstata y del TUI. Además, los vasos sanguíneos tienen una estructura que puede influir en el flujo sanguíneo16. Una disminución de la liberación de óxido nítrico, a través de la zona interna que recubre los vasos sanguíneos, que llega a los órganos del pene, la próstata y la vejiga, origina un aporte insuficiente de sangre a estas áreas con la consiguiente afectación de las mismas por falta de oxígeno vascular17.
Las últimas guías médicas de diferentes especialidades están recomendando que, en la valoración inicial del varón con HBP, se debe preguntar también por la función sexual del paciente y otras comorbilidades de RCV elevado9.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- The Task Force for the management of dyslipidaemias of the European Society of Cardiology; European Atherosclerosis Society. ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J. 2011; 32: 1769-818.
- Polak JF, Pencina MJ. Carotid-Wall Intima-Media Thickness and Cardiovascular Events. N Engl J Med. 2011; 365: 213-21.
- Jacobsen SJ, Jacobson DJ, Girman CJ, Roberts RO, Rhodes T, Guess HA, et al. Natural history of prostatism: risk factors for acute urinary retention. J Urol. 1997; 158: 481.
- Girman CJ, Epstein RS, Jacobsen SJ, Guess HA, Panser LA, Oesterling JE, et al. Natural history of prostatism: impact of urinary symptoms on quality of life in 2115 randomly selected community men. Urology. 1994; 44: 825-31.
- Kohler TS, McVary KT. The relationship between erectile dysfunction and lower urinary tract symptoms and the role of phosphodiesterase type 5 inhibitors. Eur Urol. 2009; 55: 38-48.
- Shiri R, Häkkinen JT, Hakama M, Huhtala H, Auvinen A, Tammela TL, et al. Effect of lower urinary tract symptoms on the incidence of erectile dysfunction. J Urol. 2005; 174: 205-9.
- Rosen RC, Wei JT, Althof SE, Seftel AD, Miner M, Perelman MA, et al. Association of sexual dysfunction with lower urinary tract symptoms of BPH and BPH medical therapies: results from the BPH Registry. Urology. 2009; 73: 562-6.
- Pohjantahti-Maaroos H, Palomaki A, Hartikainen J. Erectile dysfunction, physical activity and metabolic syndrome: differences in markers of atherosclerosis. BMC Cardiovasc Disord. 2011; 11: 36.
- Gorbachinsky I, Akpinar H, Assimos DG. Metabolic syndrome and urologic diseases. Rev Urol. 2010; 12: e157-80.
- McCullough AR. The penis as a barometer of endothelial health. Rev Urol. 2003; 5: S3-S8.
- Aytaç IA, Mckinlay JB, Krane RJ. The likely worldwide increase in erectile dysfunction between 1995 and 2025 and some possible policy consequences. BJU International. 1999; 84: 50-6.
- Montorsi P, Ravagnani PM, Galli S, Rotatori F, Veglia F, Briganti A, et al. Association between erectile dysfunction and coronary artery disease. Role of coronary clinical presentation and extent of coronary vessels involvement: the COBRA trial. Eur Heart J. 2006; 27: 2632-9.
- Blumentals WA, Gomez-Caminero A, Joo S, Vannappagari V. Is erectile dysfunction predictive of peripheral vascular disease? Aging Male. 2013; 6: 217-21.
- Kostis JB, Jackson G, Rosen R, Barrett Connor E, Billups K, Burnett AL, et al. Sexual dysfunction and cardiac risk (the Second Princeton Consensus Conference). Am J Cardiol. 2005; 96: 313-21.
- Billups KL, Bank AJ, Padma-Nathan H, Katz SD, Williams RA. Erectile dysfunction as a harbin ger for increased cardiometabolic risk. Int J Impot Res. 2008; 20: 236-42.
- McVary KT, Rademaker A, Lloyd GL, Gann P. Autonomic nervous system overactivity in men with LUTS secondary to benign prostatic hyperplasia. J Urol. 2005; 174: 1327.
- García Cardoso JV, López Farré A, Vela Navarrete R. Disfunción eréctil: papel del laboratorio en la evaluación diagnóstica y pronóstica. Actas Urol Esp. 2005; 29: 890-8.
- Oelke M, Giuliano F, Mirone V, Xu L, Cox D, Viktrup L. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo-controlled clinical trial. Eur Urol. 2012; 61: 917-25.