Clínica Cotidiana
Información del artículo
Historia del artículo:
Recibido el 10 de abril de 2019
Aceptado el 1 de octubre de 2019
On-line el 26 de diciembre 2019
Palabras clave:
Ictus
Clínica neurológica
Aleteo auricular
Síndrome de Bayés
*Autor para correspondencia
Correo electrónico:
patriciamarias@hotmail.com
(P. Martínez Arias).
Keywords:
Stroke
Neurologic manifestations
Atrial flutter
Bayes syndrome
Patricia Martínez Arias*, Blanca Sanz Pozo, José Antonio López Freire
Centro de Salud Las Américas. Parla (Madrid)
Resumen
Se presenta un caso clínico de un paciente de 61 años de edad, que acude por un cuadro de focalidad neurológica de 2 minutos de duración, autolimitado y sin aparentes secuelas posteriores.
Tras anamnesis y exploración física, se deriva a Urgencias para efectuar pruebas complementarias. Estas muestran una alteración importante.
En este artículo se da especial importancia a la sintomatología referida por el paciente o la familia, y no tanto a la duración aparente de los síntomas. Además se comenta un trastorno del ritmo cardiaco poco conocido, con importantes implicaciones cardiológicas y neurológicas, que puede ser relevante de cara a su reconocimiento en atención primaria.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Two minutes are sufficient
Abstract
We report a case of a 61-year-old patient who attend with a neurological focal case lasting 2 minutes, self-limiting and with no apparent subsequent sequelae.
After anamnesis and physical examination, he attend to the emergency department for complementary tests that show an important alteration.
This article gives special importance to the symptomatology referred by the patient or the family, and not only to the apparent duration of the symptoms. In addition, we comment an under-recognized cardiac rhythm disorder with significant cardiologic and neurologic implications that may be relevant for its recognition in Primary Care.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Varón de 61 años de edad, con antecedentes de hipertensión arterial y flutter auricular paroxístico diagnosticado hace 3 años, por el que realizó tratamiento con rivaroxabán, posteriormente sustituido por ácido acetilsalicílico en la revisión en cardiología. Toma candesartán/hidroclorotiazida y bisoprolol. Ha sido fumador hasta hace dos años, con un índice paquete/año de 5. Sin otros antecedentes de interés.
Acude a consulta porque hace media hora ha presentado parestesias tipo calambre descendente en el miembro superior izquierdo, asociado a sensación de paresia en la comisura bucal, con babeo y dificultad para articulación del lenguaje, que define como “habla pastosa”. El episodio ha desaparecido en apenas 2 minutos; después ha quedado asintomático, si bien la familia refiere que lo nota “más lento” de lo habitual.
Durante el suceso, el paciente ha estado consciente, sin sensación de embotamiento ni pérdida visual aparente. No ha presentado cefalea, ni palpitaciones, ni dolor torácico, ni disnea. No tiene episodios previos de desconexión del medio o clínica comicial.
Durante la exploración física permanece consciente y orientado, bien hidratado, nutrido y perfundido, con una tensión arterial de 170/93 mmHg, frecuencia cardiaca de 60 latidos por minuto y saturación de oxígeno de 100 %. No se auscultan soplos carotídeos, la auscultación cardiaca es rítmica y sin soplos; la pulmonar sin ruidos sobreañadidos. No presenta edemas ni signos de trombosis venosa profunda, pulsos pedios presentes.
Durante la exploración neurológica se aprecia un lenguaje fluido y bien articulado, de contenido coherente aunque algo bradilálico. Comprende y obedece órdenes. Pupilas isocóricas y normorreactivas. Presenta cuadrantanopsia homónima inferior izquierda, discreta en la campimetría por confrontación. Resto de pares craneales normales, sin asimetrías faciales. No presenta dismetrías ni disdiadococinesia. Fuerza y sensibilidad conservadas. Reflejos osteotendinosos normales. Romberg negativo. No presenta claudicación de la marcha.
Ante dichos hallazgos, se le remite a Urgencias, donde se solicitan pruebas complementarias.
La bioquímica, el hemograma y las pruebas de coagulación no muestran datos de interés.
En el electrocardiograma el paciente mantiene un ritmo sinusal a 65 latidos por minuto, onda P ensanchada y mellada, eje normal, PR normal y QRS estrecho, sin alteraciones de la repolarización.
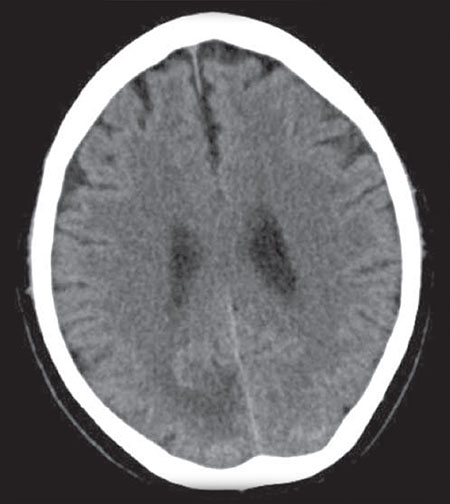
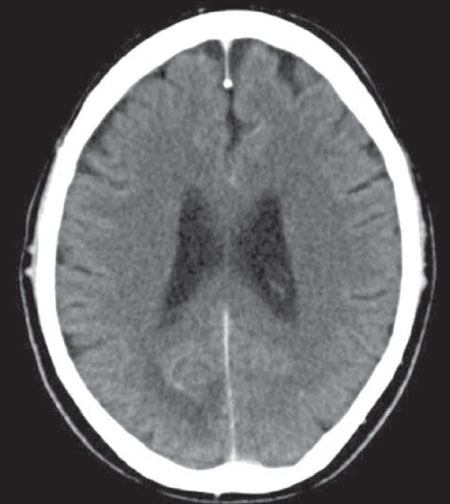
En la TC de cráneo se identifican hallazgos compatibles con lesión ocupante de espacio (LOE) como primera posibilidad diagnóstica, sin poder descartar infarto occipital en estadio subagudo (Figs. 1 y 2).
El paciente ingresa en Neurología con sospecha de episodio paroxístico comicial.
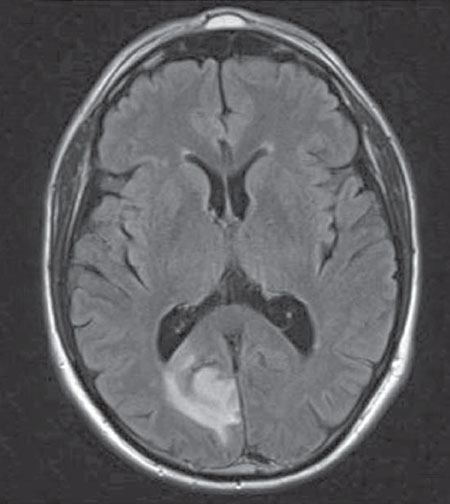
La RMN muestra una imagen sugestiva de infarto subagudo occipital derecho, así como otras lesiones sugestivas de microinfartos periféricos en el territorio de la arteria cerebral media derecha (Fig. 3).
Ante estos hallazgos y los antecedentes de flutter en un paciente no anticoagulado, se plantea la posibilidad de una etiología cardioembólica.
Durante el ingreso se mantiene monitorización cardiaca, que evidencia en dos ocasiones flutter con frecuencia controlada. Merece la pena comentar el hallazgo durante ritmo sinusal de una onda P ensanchada y mellada, que en cardiología se conoce como signo de Bayés.
El ecocardiograma muestra ligera hipertrofia concéntrica del ventrículo izquierdo, con función sistólica normal.
El estudio doppler de troncos supraaórticos también es normal.
El electroencefalograma no muestra alteraciones.
Tras calcular las escalas de pronóstico (CHADS-VASC de 3 puntos y HAS BLED de 1 punto), se toma la decisión de anticoagular de nuevo con rivaroxabán y suspender el ácido acetilsalicílico.
El paciente permanece con una mínima hemianopsia izquierda, por lo que sigue realizando controles en Neurología y Cardiología.
Pese a la escasa duración de los síntomas que relata el paciente, se ha demostrado mediante pruebas de imagen la importante repercusión que ha tenido el proceso y el riesgo de recurrencia asociado a su patología cardiaca. Con ello queremos destacar la importancia de descartar lesión, incluso a pesar de parecer un proceso autolimitado en el tiempo y de escasa duración.
Figura 1 – TC craneal sin contraste: hipodensidad en la sustancia blanca occipital derecha, compatible con edema; hallazgo compatible con LOE intraaxial occipital derecha, sin poder descartar infarto occipital subagudo.
Figura 2 – TC craneal con contraste: captación heterogénea en la región occipital derecha; hallazgo compatible con LOE intraaxial occipital derecha, sin poder descartar infarto occipital subagudo; sistema ventricular centrado de tamaño y morfología normal, sin evidencia de herniaciones intracraneales.
Figura 3 – RMN craneal (T2 FLAIR): imagen corticosubcortical occipital derecha, con zona de necrosis laminar cortical y captación giral periférica, sugestiva de infarto subagudo occipital derecho.
Comentario
Los síntomas de la isquemia cerebral pueden ser transitorios: durar desde segundos a algunos minutos o persistir por periodos de tiempo más prolongados. Permanecerán indefinidamente si el cerebro sufre un daño irreversible y se produce un infarto. Desafortunadamente, los síntomas neurológicos no reflejan con precisión la presencia o ausencia de infarto, y tampoco indican la causa de la isquemia1. Este es un problema importante porque el tratamiento depende de la identificación de la causa.
En estos casos es fundamental comprobar el estado hemodinámico del paciente así como saber establecer si se trata de un código ictus que requiera terapia de reperfusión urgente.
Una vez establecida la prioridad, hay que formar una hipótesis acerca de la etiología basada en la historia, el examen físico y el estudio inicial de pruebas de imagen, para luego confirmar el diagnóstico con pruebas adicionales dirigidas al proceso de sospecha. La enfermedad cerebrovascular puede estar causada por varios procesos fisiopatológicos que afectan a los vasos sanguíneos del cerebro. El proceso puede ser intrínseco al vaso, originarse a distancia, o ser consecuencia de un flujo sanguíneo cerebral inadecuado.
Aproximadamente el 80 % de los accidentes cerebrovasculares se deben a un infarto cerebral isquémico y el 20 % a una hemorragia cerebral.
La isquemia cerebral transitoria se define como un episodio transitorio de disfunción neurológica. Sin embargo, esta definición requiere la ausencia de lesión cerebral evaluada mediante imágenes u otras técnicas.
Se reconocen tres subtipos de isquemia:
- La de causa trombótica, producida por un proceso que da lugar a la formación de trombos en una arteria cerebral.
- La de causa embólica, producida por partículas que se originan a distancia y que bloquean el acceso arterial a una región cerebral. Como el proceso no es local (a diferencia de la trombosis), la terapia local solo resuelve temporalmente el problema y el proceso se puede repetir si la fuente de la embolia no se identifica y no se trata.
- La debida a hipoperfusión sistémica, secundaria a una parada cardiaca, a una arritmia o a un gasto cardíaco reducido.
La hemorragia cerebral puede ser intraparenquimatosa y formar un hematoma localizado que se puede propagar, lo que aumenta los síntomas gradualmente; o bien ser subaracnoidea, en la que la sangre se propaga rápidamente y los síntomas comienzan abruptamente, el principal de ellos el dolor de cabeza repentino e intenso, clásicamente descrito como el “peor dolor de cabeza de mi vida”2.
Una vez enfocado el cuadro y establecida la sospecha de ictus isquémico, es fundamental la monitorización cardiaca durante al menos 24 horas para detectar arritmias; en pacientes sin datos de fibrilación auricular en dichas 24 horas, se sugiere monitorizar de forma ambulatoria durante varias semanas3-9.
Todos los pacientes con sospecha de accidente cerebrovascular embólico deben ser explorados mediante ecocardiograma10-11.
En caso de identificarse un origen cardiogénico, el tratamiento irá orientado a modificar la causa o prevenir la recurrencia con distintas estrategias:
- Los pacientes que presentan un episodio inicial de flutter deben tratarse de manera similar a los que presentan su primer episodio de fibrilación auricular (FA) y ser anticoagulados a largo plazo.
- No solo el aleteo auricular conlleva riesgo de embolización sistémica, sino que también suelen tener episodios de FA asociados. La demostración de trombos auriculares ha sido documentada en una serie de pacientes con flutter auricular que no reciben anticoagulación crónica12-14.
De los nuevos anticoagulantes probados para la prevención del ictus en la FA, solo el apixabán incluyó pacientes con aleteo auricular15. Sin embargo, es probable que exista una eficacia similar con el resto.
El uso de la terapia anticoagulante también se asocia a un mayor riesgo de hemorragia. Si bien el beneficio supera el riesgo en la mayoría de los pacientes, es necesario considerar cuidadosamente la relación beneficio-riesgo en los que tienen una puntuación baja (CHA2DS2-VASc de 0 o 1)16,17. En pacientes con una puntuación CHA2DS2-VASc de al menos 2 se recomienda la anticoagulación crónica.
El síndrome de Bayés es un proceso subclínico poco reconocido, caracterizado por un bloqueo interauricular avanzado, que se manifiesta como una prolongación de la duración de la onda P por encima de los 120 ms, acompañada de morfología bifásica en las derivaciones de la cara inferior. La importancia de esta condición es que se ha visto que tiene una fuerte asociación con arritmias supraventriculares, particularmente el flutter auricular atípico y la FA. Del mismo modo, ha sido identificado recientemente como un nuevo factor de riesgo para la isquemia cardioembólica. Esto es debido a que el bloqueo interauricular avanzado lleva a desarrollar dilatación de la aurícula izquierda, disfunción electromecánica o taquiarritmia auricular, condiciones que predisponen a su vez al tromboembolismo. El síndrome de Bayés puede ser responsable, por tanto, de algunos de los accidentes isquémicos criptogenéticos y debería ser tenido en cuenta por su importante implicación, tanto cardiológica como neurológica18,19. Por ello consideramos relevante también su conocimiento e identificación en atención primaria, puesto que una identificación precoz puede poner de manifiesto una condición desconocida y las consecuentes actuaciones de tipo preventivo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Caplan LR. Terms describing brain ischemia by tempo are no longer useful: a polemic (with apologies to Shakespeare). Surg Neurol. 1993; 40: 91-5.
- Gorelick PB, Hier DB, Caplan LR, Langenberg P. Headache in acute cerebrovascular disease. Neurology. 1986; 36: 1445-50.
- Wilterdink JL, Furie KL, Easton JD. Cardiac evaluation of stroke patients. Neurology. 1998; 51: S23-6.
- Kishore A, Vail A, Majid A, Dawson J, Lees KR, Tyrrell PJ, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and meta-analysis. Stroke. 2014; 45: 520-6.
- Dussault C, Toeg H, Nathan M, Wang ZJ, Roux JF, Secemsky E. Electrocardiographic monitoring for detecting atrial fibrillation after ischemic stroke or transient ischemic attack: systematic review and meta-analysis. Circ Arrhythm Electrophysiol. 2015; 8: 263-9.
- Afzal MR, Gunda S, Waheed S, Sehaar N, Maybrook RJ, Dwan B, et al. Role of outpatient cardiac rhythm monitoring in cryptogenic stroke: A systematic review and meta-analysis. Pacing Clin Electrophysiol. 2015; 38: 1236-45.
- Albers GW, Bernstein RA, Brachmann J, Camm J, Easton JD, Fromm P, et al. Heart rhythm monitoring strategies for cryptogenic stroke: 2015 Diagnostics and Monitoring Stroke Focus Group Report. J Am Heart Assoc. 2016; 5: e002944.
- Wachter R, Gröschel K, Gelbrich G, Hamann GF, Kermer P, Liman J, et al. Holter-electrocardiogram-monitoring in patients with acute ischaemic stroke (Find-AFRANDOMISED): an open-label randomised controlled trial. Lancet Neurol. 2017; 16: 282-90.
- Israel C, Kitsiou A, Kalyani M, Deelawar S, Ejanque LE, Rogalewski A, et al. Detection of atrial fibrillation in patients with embolic stroke of undetermined source by prolonged monitoring with implantable loop recorders. Thromb Haemost. 2017; 117: 1962-9.
- Horowitz DR, Tuhrim S, Weinberger JM, Budd J, Alweiss GS, Goldman ME. Transesophageal echocardiography: diagnostic and clinical applications in the evaluation of the stroke patient. J Stroke Cerebrovasc Dis. 1997; 6: 332-6.
- Harloff A, Handke M, Reinhard M, Geiberl A, Hetzel A. Therapeutic strategies after examination by transesophageal echocardiography in 503 patients with ischemic stroke. Stroke. 2006; 37: 859-64.
- Corrado G, Sgalambro A, Mantero A, Gentile F, Gasparini M, Bufalino R, et al. Thromboembolic risk in atrial flutter. The FLASIEC (FLutter Atriale Società Italiana di Ecografia Cardiovascolare) multicentre study. Eur Heart J. 2001; 22: 1042-51.
- Bikkina M, Alpert MA, Mulekar M, Shakoor A, Massey CV, Covin FA. Prevalence of intraatrial thrombus in patients with atrial flutter. Am J Cardiol. 1995; 76: 186-9.
- Garson A Jr, Bink-Boelkens M, Hesslein PS, Hordof AJ, Keane JF, Neches WH, et al. Atrial flutter in the young: a collaborative study of 380 cases. J Am Coll Cardiol. 1985; 6: 871-8.
- Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011; 365: 981-92.
- Friberg L, Skeppholm M, Terént A. Benefit of anticoagulation unlikely in patients with atrial fibrillation and a CHA2DS2-VASc score of 1. J Am Coll Cardiol. 2015; 65: 225-32.
- Lip GY, Skjøth F, Rasmussen LH, Larsen TB. Oral anticoagulation, aspirin, or no therapy in patients with nonvalvular AF with 0 or 1 stroke risk factor based on the CHA2DS2-VASc score. J Am Coll Cardiol. 2015; 65: 1385-94.
- Arboix A, Martí L, Dorison S, Sánchez MJ. Bayés syndrome and acute cardioembolic ischemic stroke. World J Clin Cases. 2017; 5: 93-101.
- Baranchuk A, Bayes-Genis A. Síndrome de Bayés. Rev Esp Cardiol. 2016; 69: 439.