Clínica Cotidiana
Información del artículo
Historia del artículo:
Recibido el 3 de mayo de 2018
Aceptado el 27 de julio de 2018
On-line el 21 de diciembre de 2018
Palabras clave:
Tumor quístico hepático
Diagnóstico diferencial
Tratamiento quirúrgico
*Autor para correspondencia
Correo electrónico:
vovejerohcas@msn.com
(V.J. Ovejero Gómez).
Keywords:
Hepatic cystic tumour
Differential diagnosis
Surgical treatment
Víctor Jacinto Ovejero Gómez*, Luiza Cotruta, María Victoria Bermúdez García, Jesús Bueno López, Álvaro Pérez Martín, Amado Gutiérrez Ruiz
Hospital Sierrallana. Torrelavega (Cantabria).
Resumen
La mayoría de las tumoraciones quísticas del hígado son quistes simples que no precisan tratamiento quirúrgico. Sin embargo, algunas formaciones quísticas precisan una mejor caracterización mediante estudios analíticos y de imagen con el fin de descartar lesiones con potencial maligno.
En los pacientes con indicación quirúrgica resulta de gran importancia la biopsia intraoperatoria de la cápsula para determinar una adecuada estrategia terapéutica, que puede obligar a una resección hepática.
Se realiza una aproximación al diagnóstico diferencial y abordaje de las formaciones quísticas no hereditarias del hígado a partir del caso de una paciente que presentó una tumoración expansiva por hemorragia intraquística.
© 2018 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Surgical principles for hepatic cystic tumour
Abstract
Most cystic tumours of the liver are simple cysts and do not require surgical treatment. Nonetheless, a better characterization of some cystic features is needed to complete with analytical and imaging studies in order to rule out both premalignant and malignant lesions.
In case of surgical treatment, intraoperative capsular biopsy is essential to determine a therapeutic strategy that maybe force a liver resection.
An approach to differential diagnosis and management of non-hereditary cystic liver features is made from the case of a patient who presented an expansive tumor due to intracystic hemorrhage.
© 2018 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
Mujer de 84 años de edad, con alergia a betalactámicos y antecedentes de hipertensión arterial, hipercolesterolemia, cardiopatía isquémica y osteoporosis, en tratamiento crónico con ácido acetilsalicílico (100 mg), diltiazem (120 mg) y fluvastatina (80 mg). Consulta ambulatoriamente por molestias en el hipocondrio derecho, de dos años de evolución, con acentuación en el último mes en forma de dolor, especialmente de carácter postprandial, e incremento del perímetro abdominal.
El examen físico revela una asimetría del hemiabdomen derecho por una tumoración que alcanza la pelvis mayor y sobrepasa la línea media umbilical (Fig. 1). La palpación resulta molesta y la percusión mate, con ausencia de peristalsis en los cuadrantes afectados.
El estudio analítico general y de función hepática resulta normal. El análisis de marcadores tumorales (CEA, Ca19.9, Ca125 y alfafetoproteína) no revela alteración en ninguno de los parámetros.
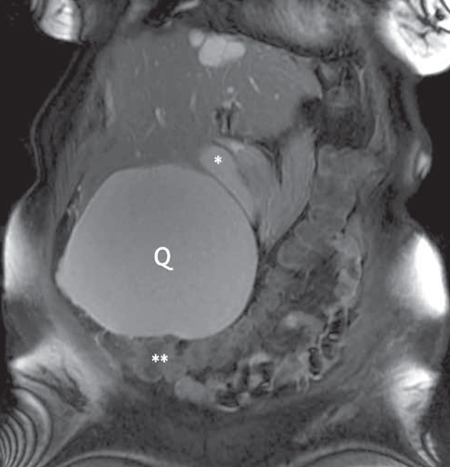
En la ecografía abdominal se visualiza una lesión quística de gran tamaño dependiente de la cara visceral del lóbulo hepático derecho, con aparente material sólido en su interior. El diagnóstico se completa con una serología para hidatidosis, que resulta negativa, y una resonancia magnética hepática que objetiva la tumoración quística de 18 x 15 cm, con un contenido proteináceo o hemorrágico que depende del segmento V hepático y ocasiona desplazamiento de la vesícula biliar y del colon (Figs. 2 y 3).
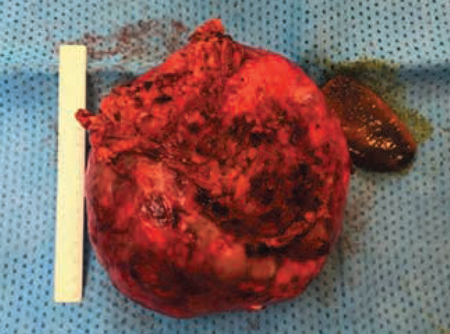
Se indica una intervención quirúrgica programada para fenestración hepática y colecistectomía laparoscópicas. Precisa una adhesiolisis periquística con respecto al colon, marco duodenal y antro gástrico. El análisis intraoperatorio de la cápsula quística no demuestra malignidad (Fig. 4). No se producen complicaciones postoperatorias.
La paciente se ha mantenido asintomática. El primer control tomográfico anual no revela recurrencia quística.
Figura 1 – Inspección quirúrgica de la pared abdominal: asimetría derecha secundaria a la tumoración quística hepática observada desde el plano anterior (A) y craneal (B) de la paciente.
Figura 2 – Visión axial de la resonancia magnética hepática: señal hiperintensa en la secuencia T2 sin realce después de la administración de contraste (A), que caracteriza a la lesión quística, y una secuenciación hiperintensa en T1 con saturación grasa (B), que sugiere complicación intraquística de tipo hemorrágico.
Figura 3 – Imagen coronal de la resonancia magnética en secuencia T2 con saturación grasa: se aprecia el desplazamiento medial de la vesícula biliar (*) y caudal del colon trasverso (**) por el efecto expansivo del quiste hepático (Q) en su crecimiento.
Figura 4 – TAC tóraco-abdominal: tumoración de 45 mm de diámetro en el hilio pulmonar izquierdo, que engloba el bronquio principal y el bronquio del segmento 6, y estenosa el bronquio del lóbulo inferior; destrucción de la articulación costovertebral izquierda, que en la vértebra T9 produce efecto de masa en las partes blandas y protruye sobre el parénquima pulmonar.
Comentario
Las tumoraciones quísticas del hígado pueden tener un origen congénito o adquirido. Las primeras suelen deberse a un desarrollo embriológico anómalo de los conductos biliares, que no comunican con el árbol biliar pero presentan un aumento de tamaño secundario a una hiperplasia inflamatoria; las adquiridas pueden tener una naturaleza traumática, infecciosa o neoplásica1. La afectación poliquística suele asociarse a la presencia de quistes en otros órganos.
El quiste simple es la lesión hepática más frecuente. Presenta predilección femenina, pero su incidencia exacta resulta difícil de determinar al manifestarse mayoritariamente de forma asintomática, aunque un mayor uso de técnicas de imagen ha propiciado un aumento de su prevalencia con la edad.
Su contenido muestra una composición electrolítica similar a la del plasma, con concentraciones muy bajas de glucosa2. Resulta infrecuente su degeneración maligna y su manifestación como metástasis quística se observa en un 4 % de los tumores malignos.
La sintomatología más frecuente de un tumor quístico hepático es el dolor provocado por la distensión de la cápsula de Glisson, asociado a síntomas sobre órganos vecinos derivados de su crecimiento. Resulta conveniente una adecuada anamnesis y exploración física que descarte otros procesos o alguna de sus complicaciones. La infección, habitualmente monomicrobiana por Escherichia coli, y la hemorragia son las más frecuentes.
Sus efectos expansivos intraparenquimatosos pueden traducirse en ictericia por compresión biliar, una obstrucción compresiva del flujo venoso hepático que favorece la formación de trombos o una hipertensión sinusoidal con presencia de ascitis3. La presencia de complicaciones locales por fistulización biliar o hemorragia intraquística seguida de sobreinfección puede precipitar un abdomen agudo con o sin ruptura asociada4. Los fenómenos hemorrágicos son propios de quistes de gran tamaño en el anciano y pueden generar una necrosis capsular por incremento de la presión intraquística.
La ecografía abdominal con orientación hepática ofrece una primera aproximación diagnóstica hacia la definición de sus características morfológicas, tamaño, localización y complicaciones, debido a su alta disponibilidad y eficiencia en manos experimentadas. No obstante, resulta de gran utilidad el diagnóstico complementario con otros estudios de imagen en busca de información más dirigida a detalles concretos de su filiación y relaciones de vecindad.
Una gran parte de los hallazgos serán compatibles con el quiste hepático simple por su elevada frecuencia. En este sentido, resulta trascendental la ausencia de tabiques en su interior como rasgo diferencial. Se localizan fundamentalmente en el lóbulo hepático derecho5, pero puede resultar difícil de diferenciar de otras formas quísticas a pesar de una semiología e imagen compatibles. Un contenido intraquístico hemático puede simular un cistoadenoma.
A este respecto, el estudio sonográfico de un quiste simple demostrará una imagen anecoica, unilocular, sin tabiques en su interior y con sombra acústica posterior. Aunque su especificidad supera el 90 %, algunos casos dudosos pueden beneficiarse de una resonancia magnética al presentar una mayor especificidad y utilidad en la detección de complicaciones intraquísticas6. En caso de falta de disponibilidad, puede ser sustituida por una tomografía computarizada, considerando que su información no mejorará a las anteriores.
A pesar de la elevada precisión diagnóstica de los estudios de imagen, algunas formas quísticas con potencial maligno pueden quedar infradiagnosticadas, por lo que se recomienda un seguimiento clínico de los quistes mayores de 4 cm. La indicación quirúrgica se asienta en presencia de síntomas o un crecimiento rápido para descartar la presencia de un cistoadenoma o un cistoadenocarcinoma encubiertos7.
En los dos casos existen proyecciones papilares que se comportan como tabiques; aunque el primero resulta más silente. El cistoadenocarcinoma suele presentar una mayor velocidad de crecimiento en presencia de síntomas asociados a un síndrome general. Es frecuente que dicha tumoración quística pueda presentar áreas sólidas visibles o calcificaciones.
Los estudios de imagen deben complementarse con una serología específica para hidatidosis, por cuanto que algunas formas de enfermedad hidatídica, especialmente en sus etapas iniciales, pueden ser mal interpretadas en la imagen8; y una batería de marcadores tumorales que ayuden al diagnóstico de malignidad, tanto para tumores quísticos primarios como secundarios, atendiendo a su relación con un origen ovárico, cólico o neuroendocrino9,10. En la figura 5 se muestra un algoritmo de actuación con criterios sencillos de derivación al especialista.
Figura 5 – Algoritmo orientativo del diagnóstico diferencial en tumores quísticos hepáticos y criterios de derivación al especialista.
La falta de consenso unánime sobre el tratamiento más adecuado para las tumoraciones quísticas benignas explica que existan diferentes actitudes terapéuticas. El tamaño por sí mismo no representa una indicación quirúrgica, aunque se relaciona con una mayor presencia de sintomatología y complicaciones11,12. El aspirado percutáneo del quiste para estudio citológico y determinación de marcadores tumorales constituye un sencillo acercamiento en caso de dudas sobre su filiación benigna, aunque deberá asociarse la inyección intraluminal de sustancias esclerosantes para evitar recidivas. Este procedimiento será descartado en caso de complicaciones intraquísticas o sospecha de malignidad y queda prácticamente reservado para casos sintomáticos con contraindicación quirúrgica13,14.
La fenestración quirúrgica suele plantearse en formas simples sintomáticas de gran tamaño pero resulta obligado el estudio intraoperatorio de la cápsula para descartar un cistoadenoma, lesión premaligna que obliga a una exéresis completa de la lesión en el mismo acto quirúrgico. Se ha propuesto el capitonaje y el uso de epiploplastias para reducir la recidiva, a pesar de lo cual puede alcanzar máximos del 14 %. Este hecho ha justificado la práctica de otras técnicas como la enucleación quística, aunque precisa el aval de estudios más amplios. La indicación de resección hepática se contempla en el caso de quistes benignos que afectan a todo un lóbulo, lesiones premalignas y las malignas susceptibles de tratamiento7.
En los últimos años está prosperando la vía de abordaje laparoscópico, con resultados comparables a la vía abierta y las ventajas propias de una técnica mínimamente invasiva. Su principal indicación se encuentra en quistes dependientes de los segmentos anteriores del hígado y resulta imprescindible una alta experiencia en cirugía hepática laparoscópica15. Los segmentos centrales y posteriores derechos, así como una escasa resección de la cápsula, suelen asociarse a recidiva.
En resumen, la mayoría de las tumoraciones quísticas del hígado son asintomáticas y no requieren tratamiento. Es preciso un diagnóstico correcto y contextualizado, sin olvidar la posibilidad de una malignidad encubierta, antes de ofrecer ningún tratamiento selectivo, muchas veces condicionado por las características anatómicas y clínicas del paciente o los propios recursos sanitarios disponibles.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- . Jones WL, Mountain JC, Warren KW. Symptomatic non-parasitic cysts of the liver. Br J Surg. 1974; 61: 118-23.
- Díez J, Decoud J, Gutiérrez L, Suhl A, Merello J. Laparoscopic treatment of symptomatic cysts of the liver. Br J Surg. 1998; 85: 25-7.
- Uddin W, Ramage JK, Portmann B, Wilson P, Benjamin I, Tan KC, et al. Hepatic venous outflow obstruction in patients with polycystic liver disease: pathogenesis and treatment. Gut. 1995; 36: 142-5.
- Vannucchi A, Masi A, Vestrini G, Tonelli F. Extraperitoneal hemorrhagic rupture of a simple hepatic cyst. A case report and literature review. Ann Ital Chir. 2016; 30: 87.
- Garcea G, Pattenden CJ, Stephenson J, Dennison AR, Berry DP. Nine-year single-center experience with nonparastic liver cyst: diagnosis and management. Dig Dis Sci. 2007; 52: 185-91.
- Stambuk J, Aretxabala X, Lavin M, Zamarin J. Fenestración laparoscópica de quistes hepáticos sintomáticos. Rev Chil Cir. 2008; 60: 548-51.
- Banerjee A, Shah SR, Singh A, Joshi A, Desai D. Rare biliary cystic tumors: a case series of biliary cystadenomas and cystadenocarcinoma. Ann Hepatol. 2016; 15: 448-52.
- Ahmad Z, Uddin N, Memon W, Abdul-Ghafar J, Ahmed A. Intrahepatic biliary cystadenoma mimicking hydatid cyst of liver: a clinicopathologic study of six cases. J Med Case Rep. 2017; 11: 317.
- Chen YW, Li CH, Liu Z, Dong JH, Zhang WZ, Jiang K. Surgical management of biliary cystadenoma and cystadenocarcinoma of the liver. Genet Mol Res. 2014; 13: 6383-90.
- Fiori S, Del Globbo A, Gaudioso G, Caccamo L, Massironi S, Cavalcoli F, et al. Hepatic pseudocystic metastasis of well-differentiated ileal neuroendocrine tumor: a case report with review of the literature. Diagn Pathol. 2013; 8: 148.
- Ruiz-Tovar J, López-Buenadicha A, Moreno-Caparros A, Vázquez-Garza JN. Manejo quirúrgico de los quistes hepáticos simples. Cir Cir. 2012; 80: 52-5.
- Ramia JM, De La Plaza R, Figueras J, García-Parreño J. Tumores hepáticos quísticos benignos no parasitarios. Cir Esp. 2011; 89: 565-73.
- Davies CW, Mcintyre AS. Treatment of a symptomatic hepatic cyst by tetracycline hydroclohride instilation sclerosis. Europ J Gastroenterol Hepatol. 1996; 8: 173-175.
- Wijnands TF, Görtjes AP, Gerves TJ, Jenniskens SF, Kool LJ, Potthoff A, et al. Efficacy and safety of aspiration sclerotherapy of simple hepatic cysts: a systematic review. AJR Am J Roentgenol. 2017; 208: 201-7.
- Vardakostas D, Damaskos C, Garmpis N, Antoniou EA, Kontzoglou K, Kouraklis G, et al. Minimally invasive management of hepatic cysts: indications and complications. Eur Rev Med Pharmacol Sci. 2018; 22: 1387-96.