Clínica Cotidiana
Información del artículo
Historia del artículo:
Recibido el 3 de mayo de 2018
Aceptado el 27 de septiembre de 2018
On-line el 29 de enero de 2019
Palabras clave:
Miastenia gravis
Timoma
Miopatía
*Autor para correspondencia
Correo electrónico:
javibusta25@gmail.com
(J. Bustamante Odriozola).
Keywords:
Myasthenia gravis
Thymomas
Myopathy
Javier Bustamante Odriozolaa,*, Pilar Bosque Varelab, Sandra Tello Menac, Pedro José Pascual Blascod
aCentro de Salud Isabel II-Centro. bServicio de Neurología. Hospital Universitario Marqués de Valdecilla.
cServicio de Neumología. Hospital Universitario Marqués de Valdecilla. dCentro de Salud Dávila. Santander (Cantabria).
Resumen
Los timomas representan aproximadamente el 20 % por ciento de las neoplasias mediastínicas. La mayoría de los pacientes con timoma tienen entre 40 y 60 años de edad y existe una incidencia similar en hombres y mujeres. No se conocen factores de riesgo, aunque existe una fuerte asociación con la miastenia gravis y otros síndromes paraneoplásicos, entre ellos la miositis autoinmune o la encefalitis.
La miastenia gravis es el trastorno más común asociado al timoma. La característica distintiva del trastorno es un grado fluctuante y una combinación variable de debilidad en los músculos oculares, bulbares, de las extremidades y respiratorios.
La debilidad es el resultado de un ataque inmunológico dependiente de células T mediado por anticuerpos dirigido a las proteínas en la membrana postsináptica de la unión neuromuscular (receptores de acetilcolina o proteínas asociadas al receptor).
El diagnóstico de miastenia gravis se puede establecer mediante pruebas clínicas y serológicas.
El tratamiento es la instauración de piridostigmina o neostigmina, corticoides, plasmaféresis y timectomía, según la gravedad de la enfermedad, mientras que el tratamiento del timoma dependerá del estadio del mismo; se emplea la cirugía, la quimioterapia o la radioterapia.
© 2018 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Inflammatory myopathy with thymoma associated myasthenia gravis
Abstract
Thymomas account for approximately 20 percent of mediastinal neoplasms. Most patients with thymoma are between 40 and 60 years of age, and there is a similar incidence in men and women. There are no known risk factors, although there is a strong association with myasthenia gravis and other paraneoplastic syndromes, including autoimmune myositis or encephalitis.
Myasthenia gravis is the most common disorder associated with thymoma. The distinguishing feature of the disorder is a fluctuating degree and a variable combination of weakness in the ocular, bulbar, limb and respiratory muscles.
Weakness is the result of an immune-mediated attack by T cells mediated by antibodies directed to the proteins in the postsynaptic membrane of the neuromuscular junction (acetylcholine receptors and/or receptor-associated proteins).
The diagnosis of myasthenia gravis can be established by clinical and serological tests.
The treatment of myasthenia will be the establishment of pyridostigmine or neostigmine, corticoids, plasmapheresis, depending on the severity of the disease, while the treatment of thymoma will depend on the stage of the same considering surgery, chemotherapy and/or radiotherapy.
© 2018 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Mujer de 62 años de edad, sin antecedentes de interés, salvo ser exfumadora, con un índice acumulado de consumo de tabaco de 20 paquetes/año. Acude a Urgencias por un cuadro de un mes de evolución de astenia y mialgias generalizadas, disfagia para sólidos y edemas en los miembros superiores.
Durante la exploración física se objetiva una debilidad muscular de los miembros superiores junto con edemas; no se objetiva ningún otro dato relevante. La auscultación cardiopulmonar es normal.
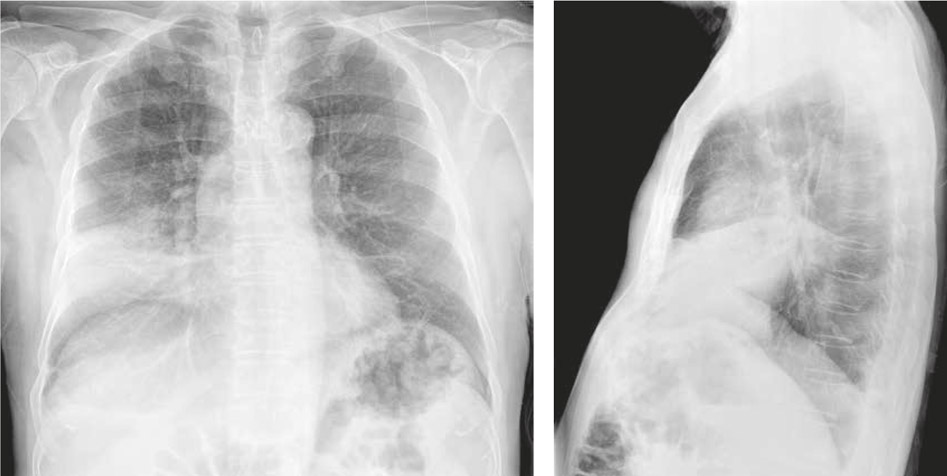
En la radiografía de tórax se observa una masa en el mediastino anterior, cuya presencia se confirma con TAC torácica (Fig. 1).
En la analítica se objetiva elevación de enzimas musculares.
Se plantea el diagnóstico diferencial entre timoma y linfoma. Ante la sospecha de miopatía inflamatoria o miastenia gravis, se decide el ingreso en Neurología.
Se realiza un electromiograma (EMG), que muestra hallazgos compatibles con miopatía inflamatoria y también afectación post-sináptica.
Figura 1 – Radiografía PA y lateral de tórax: aumento de densidad en el LM.
En la tomografía por emisión de positrones, realizada para estudio de la masa mediastínica, se objetiva captación muscular difusa.
En días posteriores aparece empeoramiento de la clínica: disfagia para líquidos, voz gangosa, debilidad de las extremidades y ortopnea, por lo que se inicia tratamiento con inmunoglobulinas endovenosas ante la sospecha de crisis miasténica. Se produce mejoría inicial (menos de la disfagia y la debilidad).
Confirmada la positividad de anticuerpos anti-receptores de acetilcolina, se inicia tratamiento con piridostigmina y prednisona. A pesar de ello, se produce un nuevo empeoramiento con desaturación, por lo que ingresa en cuidados Intensivos y se inicia ventilación mecánica no invasiva. Recibe bolos de corticoides y nueva tanda de inmunoglobulinas.
Finalmente, se realiza biopsia de la masa mediastínica. Se complica con neumotórax derecho y atelectasia del pulmón izquierdo, lo que hace precisa la intubación previa a sedoanalgesia y fibrobroncoscopia de limpieza.
En la anatomía patológica de la masa se confirma el timoma.
Se comenta el caso con Cirugía Torácica, que lleva a cabo una timectomía. Pero se produce un nuevo neumotórax, que precisa tubo de drenaje y nueva fibrobroncoscopia de limpieza.
A la vista de la evolución tórpida por nuevo cuadro de crisis miasténica, se retira la piridostigmina y se administra bolo de ciclofosfamida.
En los días posteriores se produce mejoría clínica. La evolución del cuadro neurológico es buena, aunque se mantiene leve debilidad orbicular. El pulmón se reexpande, pero persisten fugas de aire a través del drenaje.
Disminuyen los niveles de enzimas musculares de forma progresiva y se produce mejoría de las mialgias.
Durante el ingreso desarrolla otras complicaciones: sepsis de origen respiratorio secundario a Serratia marcescens, insuficiencia respiratoria aguda mixta y encefalopatía hipercápnica que se resuelve.
El diagnóstico definitivo es timoma asociado a miastenia gravis y miopatía inflamatoria como síndromes paraneoplásicos.
Se decide el alta y se mantiene el drenaje. Se pauta tratamiento con enalapril, paracetamol, tramadol, dexketoprofeno, piridostigmina, calcio, colecalciferol y tratamiento con radioterapia para el timoma.
En posteriores revisiones de Neurología y de Cirugía Torácica se objetiva mejoría de la clínica. Se inicia pauta descendente del corticoide y se mantiene la radioterapia.
Comentario
El timoma es una neoplasia epitelial de bajo grado que se origina en el timo. Se localiza comúnmente en el mediastino ántero-superior1.
Su diagnóstico se realiza mediante el uso de RMN o TAC y se confirma tras la biopsia.
Su hallazgo puede ser casual o presentarse con síntomas torácicos secundarios a la expansividad del tumor o bien secundarios a un síndrome paraneoplásico.
Entre los síndromes paraneoplásicos posibles se encuentran la miastenia gravis, el síndrome de Eaton-Lambert, la neuromiotonía adquirida (síndrome de Isaac), la encefalitis, el síndrome de Morvan y la miositis autoinmune, entre otros.
Miastenia gravis
Es con mucho el síndrome paraneoplásico más común, ya que 15-20 % de estos pacientes tienen un timoma, mientras que 24,5-40 % de los pacientes con timoma desarrollan miastenia gravis2,3. Su característica principal es la debilidad muscular fatigable.
Debe sospecharse en pacientes que presentan ptosis y diplopía asimétricas del párpado, a menudo asociadas a disartria, disfagia («síntomas bulbares») y debilidad facial y del cuello. La afectación de las extremidades suele ser frecuente en los músculos proximales; la respiratoria puede provocar crisis o la muerte.
El diagnóstico se confirma mediante anticuerpos y EMG, que muestra un defecto postsináptico que incluye una disminución significativa del potencial de acción muscular compuesto en estimulación nerviosa repetitiva de baja frecuencia o aumento de la inestabilidad en EMG de fibra única4. Una respuesta clínica clara a los inhibidores de la colinesterasa respalda aún más el diagnóstico.
El tratamiento se adapta en función de la gravedad de la enfermedad. La medicación sintomática (piridostigmina) puede ser suficiente para pacientes levemente afectados, mientras que quienes tienen síntomas incapacitantes requieren corticoides (prednisona o prednisolona) a menudo asociados con inmunosupresores, como azatioprina, ciclosporina o micofenolato mofetil. Las inmunoglobulinas intravenosas y de intercambio plasmático son muy efectivas en el tratamiento de las exacerbaciones de la enfermedad5.
Ocurre principalmente en sujetos de 40-60 años, sin preferencia de sexo. La mayoría de los pacientes muestran debilidad generalizada, a menudo con un curso rápidamente progresivo y crisis respiratorias tempranas.
En pacientes con timoma, la aparición o el deterioro de la miastenia gravis puede ser el preludio de una recidiva tumoral6.
Miositis autoinmune
Se manifiesta con dolor y debilidad muscular. El diagnóstico puede ser asistido por estudios de electrodiagnóstico, medición de enzimas musculares e imágenes musculares, pero el definitivo se realiza con biopsia muscular.
Ciertos tipos de miositis autoinmunes, en especial los casos de dermatomiositis, están asociados con cánceres, incluidos los tumores tímicos7. Por otro lado, también existen informes de otros casos de miositis sin patología clara de dermatomiositis con tumores tímicos, incluidos algunos casos con miastenia gravis comórbida8.
Puede afectar al músculo, lo que da lugar a insuficiencia cardiaca y arritmias, ya sea exclusivamente o junto con el músculo esquelético9.
Tratamiento de los timomas
La cirugía es el tratamiento inicial para pacientes en quienes se considera factible una resección R0 (resección completa del tumor cuyos márgenes al ser examinados al microscopio no presenten células tumorales); es decir, quienes tienen tumores completamente encapsulados o tumores que invaden estructuras fácilmente resecables, como la pleura mediastínica, el pericardio o el pulmón adyacente.
Dado que la timectomía puede precipitar insuficiencia respiratoria en pacientes graves, es fundamental un tratamiento rápido y eficaz para lograr un control estable de los síntomas antes de la cirugía.
La radioterapia postoperatoria debe ser considerada en pacientes con invasión macroscópica de órganos vecinos (pericardio, pulmón o grandes vasos) y diseminación pleural o pericárdica. Se debe valorar en pacientes con invasión de la grasa mediastínica o la pleura si hay presentes factores de riesgo (tamaño tumoral, afectación de márgenes quirúrgicos), ya que se ha demostrado que reduce el riesgo de recidiva hasta el que tienen los pacientes con resecciones de márgenes libres y factores de bajo riesgo10-12.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Travis WD, Brambilla E, Muller-Hermelink HK, Harris CC. Pathology & genetics: Tumours of the lung, pleura, thymus and heart. En: World Health Organization Classification of tumours. Lyon: IARC Press; 2004.
- Marx A, Pfister F, Schalke B, Saruhan-Direskeneli G, Melms A, Strobel P. The different roles of the thymus in the pathogenesis of the various myasthenia gravis subtypes. Autoimmun Rev. 2013; 12: 875-84.
- Gadalla SM, Rajan A, Pfeiffer R, Kristinsson SY, Björkholm M, Landgren O, et al. A population-based assessment of mortality and morbidity patterns among patients with thymoma. Int J Cancer. 2011; 128: 2688-94.
- Howard JF Jr. Electrodiagnosis of disorders of neuromuscular transmission. Phys Med Rehabil Clin N Am. 2013; 24: 169-92.
- Skeie GO, Apostolski S, Evoli A, Gilhus NE, Illa I, Harms L, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol. 2010; 17: 893-902.
- Evoli A, Minisci C, Di Schino C, Marsili F, Punzi C, Batocchi AP, et al. Thymoma in patients with MG: characteristics and long-term outcome. Neurology. 2002; 59: 1844-50.
- Dell’Amore A, Asadi N, Caroli G, Dolci G, Bini A, Stella F. Paraneoplastic dermatomyositis as presentation of thymic carcinoma. Gen Thorac Cardiovasc Surg. 2013; 61: 422-5.
- Suzuki S, Utsugisawa K, Yoshikawa H, Motomura M, Matsubara S, Yokoyama K, et al. Autoimmune targets of heart and skeletal muscles in myasthenia gravis. Arch Neurol. 2009; 66: 1334-8.
- Kon T, Mori F, Tanji K, Miki Y, Kimura T, Wakabayashi K. Giant cell polymyositis and myocarditis associated with myasthenia gravis and thymoma. Neuropathology. 2013; 33: 281-7.
- Falkson CB, Bezjak A, Darling G, Gregg R, Malthaner R, Maziak DE, et al. The management of thymoma: a systematic review and practice guideline. J Thorac Oncol. 2009; 4: 911.
- Jackson MW, Palma DA, Camidge DR, Jones BL, Robin TP, Sher DJ, et al. The Impact of Postoperative Radiotherapy for Thymoma and Thymic Carcinoma. J Thorac Oncol. 2017; 12: 734.
- Forquer JA, Rong N, Fakiris AJ, Loehrer PJ Sr, Johnstone PA. Postoperative radiotherapy after surgical resection of thymoma: differing roles in localized and regional disease. Int J Radiat Oncol Biol Phys. 2010; 76: 440.