Arículo Original
Información del artículo
Historia del artículo:
Recibido el 20 de diciembre de 2016
Aceptado el 17 de julio de 2017
On-line el 7 de septiembre de 2017
Palabras clave:
Estatinas
Diabetogenicidad
Prediabetes
*Autor para correspondencia
Correo electrónico:
pascual_vic@gva.es
(V. Pascual Fuster).
Vicente Pascuala, *, Adalberto Serranob, Juan Pedro-Botetc, Vivencio Barriosd, Xavier Pintóe, Aleix Casesf, Jesús Milláng, Juan F. Ascasoh
aCentro de Salud Palleter. Castellón de la Plana. bCentro de Salud Repélega. Portugalete. Vizcaya. cUnidad de Lípidos y Riesgo Vascular. Servicio de Endocrinología y Nutrición. Hospital del Mar. Barcelona. dServicio de Cardiología. Hospital Universitario Ramón y Cajal. Madrid. eUnidad de Lípidos y Riesgo Vascular. Servicio de Medicina Interna. Hospital Universitario de Bellvitge. Hospitalet de Llobregat. Barcelona. fServicio de Nefrología. Hospital Clínic. Barcelona. gServicio de Medicina Interna. Hospital Universitario Gregorio Marañón. Madrid. hServicio de Endocrinología y Nutrición. Hospital Clínico Universitario. Valencia.
Resumen
Objetivos. Los efectos secundarios de las estatinas, como la diabetogenicidad, pueden disminuir la eficacia clínica de las mismas. El objetivo del Estudio DIANA fue conocer la opinión de los médicos sobre los factores que influyen en la elección de la estatina y la percepción del efecto diabetógeno de las mismas.
Material y métodos. El cuestionario, mediante el método Delphi modificado, incluyó cuatro bloques alrededor del paciente dislipémico con alteración del metabolismo de la glucosa.
Resultados. De los 497 médicos participantes, 58 % eran médicos de atención primaria. Se consensuó que los dos aspectos que tienen en cuenta al elegir una estatina son la capacidad para descender el cLDL y la posibilidad de interacciones farmacológicas. Aunque hubo consenso en que no todas las estatinas tienen el mismo efecto diabetógeno, no fue posible alcanzarlo en otros aspectos relacionados con la diabetogenicidad de las mismas; tampoco se obtuvo acuerdo sobre el posible efecto diabetógeno de pitavastatina ni de ezetimiba.
Conclusiones. La elección de la estatina viene determinada por su eficacia en la reducción de cLDL y la posibilidad de interacciones medicamentosas. Parece existir una infravaloración del efecto diabetógeno de las mismas.
© 2017 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Opinion on the use of statins and their diabetogenic effect: coincidences and differences among the primary care physicians and other specialities (DIANA Study)
Keywords:
Statins
Diabetogenicity
Prediabetes
Abstract
Objectives. The adverse effects of statins, such as their diabetogenicity, can decrease their clinical efficacy. The aim of the DIANA study was to determine the doctors´ opinion on factors that influence the choice of a statin and the perception about their diabetogenic effect.
Materials and methods. The questionnaire, using the modified Delphi method, included four blocks around the dyslipidemic patients with impaired glucose metabolism.
Results. Of the 497 participating physicians, 58% were primary care physicians. There was agreement that the two aspects which are taken into account when choosing a statin are the ability to lower LDL cholesterol and the likelihood of drug interactions. Although there was consensus that not all statins had the same diabetogenic effect, it was not possible to reach an agreement on other aspects related to their diabetogenicity; no consensus was reached on the possible diabetogenic effect of pitavastatin or ezetimibe.
Conclusions. In clinical practice the choice of a statin is determined by its effectiveness in lowering LDL cholesterol levels and the possibility of drug interactions. There seems to be an underestimation of the diabetogenic effect of statins.
© 2017 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
La enfermedad cardiovascular, como primera causa de muerte, tiene un origen multifactorial; la hipercolesterolemia es un factor esencial en su génesis.
El abordaje de la dislipemia se ha convertido en la piedra angular del control del riesgo cardiovascular. Las guías europeas sobre el abordaje de la dislipemia1 marcan objetivos estrictos en el control del colesterol de las lipoproteínas de baja densidad (cLDL) en función del riesgo cardiovascular del paciente y llegan a postular concentraciones por debajo de 70 mg/dl en personas de muy alto riesgo cardiovascular.
Las estatinas han marcado un punto de inflexión en la prevención cardiovascular. Hay datos de su efecto en diferentes escenarios clínicos; el beneficio es mayor cuanto antes iniciemos el tratamiento y más eficaz sea la reducción de cLDL2,3. Podemos conseguir mayores reducciones de cLDL y un beneficio añadido en sujetos de muy alto riesgo con el empleo de combinaciones: estatina más ezetimiba4. Este beneficio es extensible a sujetos diabéticos, lo que se ha comprobado en numerosos estudios clínicos4-6.
Sin embargo, no todas las estatinas presentan un beneficio similar, ni en el descenso del cLDL, ni en la reducción del riesgo cardiovascular, pues presentan características diferenciales en el perfil de seguridad, tanto por el riesgo de interacciones frente a fármacos u otras sustancias7 como por sus efectos adversos.
Uno de ellos es el efecto diabetógeno de las estatinas8-10. Este efecto disglicémico se ha observado, preferentemente, con las estatinas de mayor eficacia y de mayor carácter lipofílico11,12, especialmente al emplearse en pacientes con componentes del síndrome metabólico13 o en mujeres posmenopáusicas14.
Aunque el beneficio aportado por las estatinas supera el efecto deletéreo de su posible diabetogenicidad15, surge cierta incertidumbre por la limitada duración de los ensayos clínicos16, puesto que el efecto diabetógeno de las estatinas es progresivo en el tiempo, al menos durante los primeros 20 años de su uso17. Por todo ello, la indicación de una estatina viene precedida por la valoración del paciente y las características de las diferentes estatinas.
En este sentido, el objetivo del Estudio DIANA, entre otros, fue conocer la opinión de los médicos sobre los parámetros que fundamentan la elección de la estatina y el conocimiento que tienen sobre su efecto diabetógeno.
Materiales y métodos
Diseño del estudio
Se utilizó el método Delphi modificado18 para conseguir el mayor consenso de un amplio panel de médicos expertos en el tratamiento de la dislipemia, centrado en el paciente con alteración del metabolismo de la glucosa. Se trata de una técnica estructurada de consenso profesional a distancia, variante del procedimiento desarrollado por Dalkey y cols.19,20, que mantiene sus ventajas (interacción controlada entre los miembros del panel, oportunidad de reflexionar y reconsiderar la opinión propia y validación estadística del consenso logrado) y resuelve algunos de sus inconvenientes (sesgos de opinión)21.
Requirió dos rondas sucesivas de una encuesta estructurada cumplimentada a través de una plataforma online. Los médicos pudieron contrastar confidencialmente sus opiniones con la del panel en la segunda ronda y reconsiderar, si lo estimaban pertinente, sus criterios iniciales en las cuestiones no consensuadas.
El estudio se efectuó en cuatro fases: a) constitución de un comité científico; b) constitución de un panel de profesionales de cinco especialidades médicas (cardiología, endocrinología, medicina interna, nefrología y medicina familiar y comunitaria); c) encuesta online en dos rondas; y d) recopilación, análisis de resultados y comentario de las conclusiones en sesión presencial del comité científico.
Elaboración de cuestionario
Los firmantes del presente estudio constituyeron el comité científico del proyecto. Junto a un asesor metodológico externo, elaboraron los contenidos del cuestionario Delphi. Para ello se llevó a cabo una búsqueda bibliográfica a través de la consulta de bases bibliográficas habituales22 (MEDLINE, EMBASE y el Índice Médico Español), así como una revisión manual de referencias bibliográficas que pudieran ser de interés a partir de palabras clave como dislipemia, diabetogenicidad o alteración del metabolismo de la glucosa.
Cada ítem de la encuesta se redactó como aseveración, afirmativa o negativa, que respondiera a aspectos de interés o controversia en el abordaje clínico de pacientes con dislipemia y alteración del metabolismo de la glucosa. La versión final del cuestionario incluyó cuatro bloques de preguntas:
- Algoritmo de abordaje actual de la dislipemia, en particular en pacientes con alteración del metabolismo de la glucosa: detección, abordaje terapéutico, control y seguimiento (58 ítems).
- Opinión sobre la importancia relativa de los factores considerados en la prescripción y el seguimiento del tratamiento con estatinas (39 ítems).
- Opinión sobre el perfil de las estatinas en el paciente con alteración del metabolismo de la glucosa (16 ítems).
- Recomendaciones para la selección del tratamiento hipolipemiante en el paciente con alteración del metabolismo de la glucosa (24 ítems).
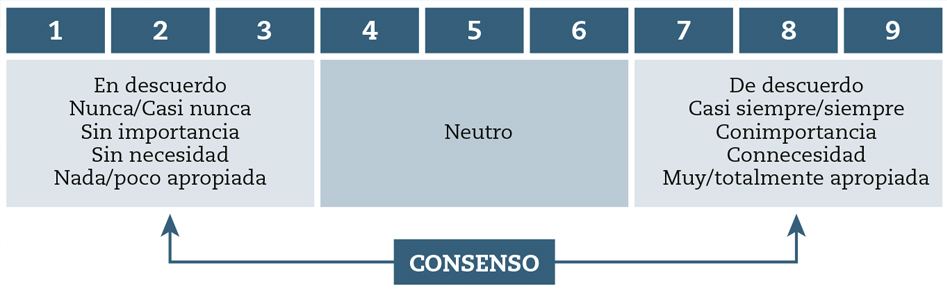
Se propuso un tipo de escala valorativa para todas las cuestiones, ordinal de tipo Likert, de nueve puntos (1: nada de acuerdo/nunca/nada importante/nada necesario/nada apropiada; 9: totalmente de acuerdo/siempre/muy importante/totalmente necesario/totalmente apropiada), según el formato desarrollado en UCLA-Rand Corporation para evaluar el uso apropiado de tecnología sanitaria23.
Las categorías de respuesta se describieron mediante cualificadores en tres regiones (1-3: en desacuerdo, nunca/casi nunca, sin importancia, sin necesidad, nada/poco apropiada; 4-6: neutro; 7-9: de acuerdo, casi siempre/siempre, con importancia, con necesidad, muy/totalmente apropiada).
Todas las preguntas debieron ser respondidas. No obstante, en la segunda ronda, solo se consultaron los ítems no consensuados en la ronda precedente, es decir, las preguntas que no obtuvieron al menos un 80% de respuestas agrupadas en las puntuaciones 1-3 (consenso en el desacuerdo) o en las puntuaciones 7-9 (consenso en el acuerdo).
Selección del panel experto
Los expertos del panel fueron propuestos por el comité científico con el criterio de ser representantes de su especialidad médica con toma de decisiones habituales sobre la situación clínica del estudio, reconocimiento profesional por su experiencia, criterio científico y especial interés en el ámbito de la dislipemia. Se empleó una estrategia en bola de nieve24.
Fueron invitados 506 profesionales de todas las comunidades autónomas, de los que 497 aceptaron participar. El estudio se desarrolló entre febrero y junio de 2015. Previamente, los expertos tuvieron que responder a cuestiones sobre la especialidad médica, años de ejercicio profesional, número y características de los pacientes con dislipemia atendidos de media cada mes, factores relacionados con la diabetogenicidad de las estatinas y porcentaje de pacientes susceptibles de sufrir un efecto diabetogénico.
Análisis e interpretación de resultados
Se sistematizó la presentación de las respuestas agrupando el rango de los valores entre 1 y 9, en tres niveles como muestra la figura 1. Se definió como consenso, en el desacuerdo o en el acuerdo, cuando al menos 80 % de los panelistas había otorgado puntuaciones de 1 a 3 (consenso en el desacuerdo) o de 7 a 9 (consenso en el acuerdo).
Se analizaron los datos de manera global y según la especialidad de los médicos participantes. El análisis comparativo por especialidad se realizó mediante los test de Chi-cuadrado o Fisher. El análisis comparativo entre ambas rondas utilizó el test de Bowker, adaptación del test de McNemar para comparar variables de más de dos categorías. El nivel de significación estadística establecido fue de 0,05 bilateral.
Resultados
De los 497 médicos que participaron en el estudio, 58 % eran médicos de atención primaria (AP) y 42 % pertenecían a otras especialidades (14 % endocrinólogos, 14 % internistas, 7 % cardiólogos y 7 % nefrólogos). El 62 % de los médicos tenía más de 20 años de experiencia clínica y el 80 % atendía a más de 50 pacientes dislipémicos cada mes. Más de 60 % de los participantes refería que más de 50 % de los pacientes eran mayores de 65 años, estaban polimedicados o tenían hipertensión arterial.
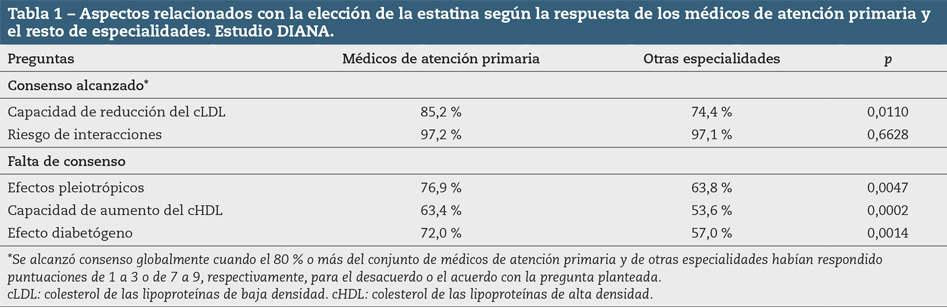
Según los expertos, los aspectos más relevantes en la elección de la estatina, cuando se decide su indicación, son la capacidad de reducción del cLDL y el riesgo de interacciones. Se alcanzó un consenso entre los participantes tanto en la capacidad de reducción del cLDL, como ante el riesgo de interacciones; existió diferencia estadísticamente significativa en los médicos de AP frente al resto de especialistas en la primera de ellas (85,2 % frente a 74,4 %, p = 0,0110), pero no en la segunda opción (97,2 % frente a 97,1 %, p = 0,6628).
No se llegó a un acuerdo, o no se consideraban suficientemente importantes, otros aspectos como los efectos pleiotrópicos (76,9 % frente a 63,8 %, p = 0,0047), la capacidad de aumento del colesterol de las lipoproteínas de alta densidad (cHDL) (63,4 % frente a 53,6 %, p = 0,0002) o el efecto diabetógeno de las mismas (72,0% frente a 57,0 %, p = 0,0014), aunque en estas tres últimas cuestiones se produjeron diferencias estadísticamente significativas entre las respuestas dadas por los médicos de AP y los del resto de especialidades (Tabla 1).
Sí existió acuerdo, sin diferencias estadísticamente significativas entre grupos, en el diferente perfil diabetógeno de las estatinas (82,1 % frente a 85 %, p = 0,0603), sin alcanzar un acuerdo en la existencia de estatinas que no empeoren el metabolismo de la glucosa (77,2 % frente a 80,7 %, p = 0,3668), que esté demostrado el efecto diabetógeno de las estatinas (52,1 % frente a 57,5 %, p = 0,1831) o que las estatinas más potentes alteren el metabolismo de la glucosa (44,8 % frente a 63,3 %, p < 0,0001); en esta última, las diferencia fueron estadísticamente significativas.
Tampoco hubo consenso en que las estatinas más potentes puedan empeorar el control glucémico en los pacientes con diabetes mellitus (39,7 % frente a 48,3 %, p < 0,0001), aunque la diferencia fue estadísticamente significativa cuando comparábamos las respuestas de los médicos de AP y las de otros especialistas. No se observó diferencia estadísticamente significativa en otras cuestiones, como que todas las estatinas a dosis altas puedan alterar el metabolismo de la glucosa en sujetos con prediabetes (21 % frente a 20,3 %, p = 0,9369), que puedan empeorar el control glucémico en los pacientes diabéticos (21,4 % frente a 19,3 %, p = 0,6215), o que todas las estatinas alteran el metabolismo de la glucosa (12,4 % frente a 8,2 %, p = 0,2468) (Tabla 2).
No se alcanzó un acuerdo sobre la existencia de experiencia científica del efecto diabetógeno de los fármacos hipocolesterolemiantes, estatinas y ezetimiba. En el caso de la pitavastatina y la ezetimiba predominaba el desacuerdo sobre el efecto diabetógeno de las mismas: representó el 78,9 % (75,9 % frente a 83,1 %, p = 0,1485) en el caso de la pitavastatina y el 65,2 % (55,5 % frente a 78,7 %, p < 0,0001) para la ezetimiba; la diferencia fue estadísticamente significativa en este último.
Todo ello pudo motivar que 92,2 % de los médicos encuestados afirmaran que la pitavastatina es la mejor elección en el paciente con diabetes (93,1 % frente a 90,8 %, p = 0,1309) y que el 91,1 % (90,7 % frente a 91,8 %, p = 0,0098) lo afirmaran para el paciente prediabético.
Comentario
La decisión de emplear estatinas, especialmente en el paciente de alto o muy alto riesgo cardiovascular, no suele implicar dificultades por la evidencia existente de su beneficio cardiovascular. Para alcanzar el objetivo de cLDL se recomienda el empleo de estatinas de alta eficacia a dosis altas o el empleo de combinaciones farmacológicas. En el Estudio DIANA los médicos encuestados estuvieron alineados con estas directrices al alcanzar un consenso global sobre la capacidad reductora del cLDL como la principal característica en la elección de la estatina; los médicos de AP apoyaron mayoritariamente esta idea.
También existió un acuerdo global sobre considerar la posible aparición de interacciones con otros fármacos en la elección de la estatina, apoyado mayoritariamente tanto por los médicos de AP como por los otros especialistas, sin existir diferencias estadísticamente significativas entre ellos.
Sin embargo, no se alcanzó un consenso, ni de acuerdo ni de desacuerdo, en referencia a los posibles efectos pleiotrópicos, la capacidad de aumento del cHDL o el efecto diabetógeno de las mismas.
En definitiva, el conjunto de los médicos encuestados está en sintonía con los aspectos generalmente aprobados en la elección del tratamiento hipolipemiante, como son el descenso del cLDL y la necesidad de evitar posibles interacciones.
No considerar el efecto diabetógeno en la elección de la estatina coincide con la creencia de que el beneficio de las estatinas supera los posibles inconvenientes sobre el control de la glucemia25. El Estudio DIANA parece mostrar que los médicos, tanto de AP como de otras especialidades, no consideran la posibilidad del efecto diabetógeno de las estatinas, a pesar de la creciente experiencia que así lo demuestra. Un estudio retrospectivo de 6,5 años de seguimiento, que englobó a 25.970 pacientes, de los cuales 3.982 estaban en tratamiento con estatinas, mostró que el empleo de estatinas incrementaba los nuevos casos de diabetes (odds ratio [OR] 1,87; IC 95 %: 1,67-2,01), las complicaciones de la diabetes (OR 2,50; IC 95 %: 1,88-3,32) y el sobrepeso/obesidad (OR 1,14; IC 95 %: 1,04-1,25)26. En el Estudio DIANA, de manera global, los médicos indicaron que no todas las estatinas tienen el mismo efecto diabetógeno, pero no existió consenso en otros parámetros que afianzan el conocimiento sobre este efecto, como son la importancia de la potencia y la dosis de la estatina empleada y su relación con la gravedad del efecto diabetógeno, así como su influencia en el metabolismo glucémico en los sujetos diabéticos y en los prediabéticos.
Dado que el tratamiento con estatinas ha de ser, en general, de por vida, será preciso monitorizar el posible deterioro del metabolismo de la glucemia en estos pacientes, especialmente en sujetos diabéticos y prediabéticos. Esto se justifica en la preocupación creciente surgida sobre la importancia que este efecto diabetógeno pudiera acarrear a lo largo del tiempo, tanto por el aumento de nuevos casos de diabetes mellitus, como por el peor control glucémico a lo largo del tiempo.
Este efecto diabetógeno depende tanto de las características de la estatina (lipofilia, potencia y dosis empleada), como de las del paciente, por lo que han surgido iniciativas para mejorar la elección de la estatina más idónea. Así, han recomendado calcular el riesgo de desarrollar diabetes en pacientes no diabéticos, mediante una herramienta como el FINRISK o alguna otra herramienta local validada27 (Fig. 2).
Los médicos encuestados no consensuaron el efecto diabetógeno en el caso de pitavastatina, ni de ezetimiba, aunque consensuaron que pitavastatina es la estatina idónea en sujetos prediabéticos o diabéticos. Esto está en consonancia con un reciente metanálisis, que incluyó 15 estudios con 1.600 personas año, y que concluyó que el empleo de pitavastatina, comparada con placebo u otras estatinas, no empeora el metabolismo de la glucemia en pacientes no diabéticos28; con resultados del estudio LIVES29, en el que se observó que en el empleo de pitavastatina descendía la hemoglobina glucosilada (HBA1c) en sujetos diabéticos; o con el estudio J-PREDICT30, que mostró la disminución de un 18 % en los nuevos diagnósticos de diabetes cuando la pitavastatina se empleó en sujetos “prediabéticos” (glucemia basal entre 100 y 125 mg/dl o/y HbA1c de al menos 6 % y menor de 6,5 %) frente a placebo.
Figura 1 – Presentación de las respuestas.
Comentario
La decisión de emplear estatinas, especialmente en el paciente de alto o muy alto riesgo cardiovascular, no suele implicar dificultades por la evidencia existente de su beneficio cardiovascular. Para alcanzar el objetivo de cLDL se recomienda el empleo de estatinas de alta eficacia a dosis altas o el empleo de combinaciones farmacológicas. En el Estudio DIANA los médicos encuestados estuvieron alineados con estas directrices al alcanzar un consenso global sobre la capacidad reductora del cLDL como la principal característica en la elección de la estatina; los médicos de AP apoyaron mayoritariamente esta idea.
También existió un acuerdo global sobre considerar la posible aparición de interacciones con otros fármacos en la elección de la estatina, apoyado mayoritariamente tanto por los médicos de AP como por los otros especialistas, sin existir diferencias estadísticamente significativas entre ellos.
Sin embargo, no se alcanzó un consenso, ni de acuerdo ni de desacuerdo, en referencia a los posibles efectos pleiotrópicos, la capacidad de aumento del cHDL o el efecto diabetógeno de las mismas.
En definitiva, el conjunto de los médicos encuestados está en sintonía con los aspectos generalmente aprobados en la elección del tratamiento hipolipemiante, como son el descenso del cLDL y la necesidad de evitar posibles interacciones.
No considerar el efecto diabetógeno en la elección de la estatina coincide con la creencia de que el beneficio de las estatinas supera los posibles inconvenientes sobre el control de la glucemia25. El Estudio DIANA parece mostrar que los médicos, tanto de AP como de otras especialidades, no consideran la posibilidad del efecto diabetógeno de las estatinas, a pesar de la creciente experiencia que así lo demuestra. Un estudio retrospectivo de 6,5 años de seguimiento, que englobó a 25.970 pacientes, de los cuales 3.982 estaban en tratamiento con estatinas, mostró que el empleo de estatinas incrementaba los nuevos casos de diabetes (odds ratio [OR] 1,87; IC 95 %: 1,67-2,01), las complicaciones de la diabetes (OR 2,50; IC 95 %: 1,88-3,32) y el sobrepeso/obesidad (OR 1,14; IC 95 %: 1,04-1,25)26. En el Estudio DIANA, de manera global, los médicos indicaron que no todas las estatinas tienen el mismo efecto diabetógeno, pero no existió consenso en otros parámetros que afianzan el conocimiento sobre este efecto, como son la importancia de la potencia y la dosis de la estatina empleada y su relación con la gravedad del efecto diabetógeno, así como su influencia en el metabolismo glucémico en los sujetos diabéticos y en los prediabéticos.
Dado que el tratamiento con estatinas ha de ser, en general, de por vida, será preciso monitorizar el posible deterioro del metabolismo de la glucemia en estos pacientes, especialmente en sujetos diabéticos y prediabéticos. Esto se justifica en la preocupación creciente surgida sobre la importancia que este efecto diabetógeno pudiera acarrear a lo largo del tiempo, tanto por el aumento de nuevos casos de diabetes mellitus, como por el peor control glucémico a lo largo del tiempo.
Este efecto diabetógeno depende tanto de las características de la estatina (lipofilia, potencia y dosis empleada), como de las del paciente, por lo que han surgido iniciativas para mejorar la elección de la estatina más idónea. Así, han recomendado calcular el riesgo de desarrollar diabetes en pacientes no diabéticos, mediante una herramienta como el FINRISK o alguna otra herramienta local validada27 (Fig. 2).
Los médicos encuestados no consensuaron el efecto diabetógeno en el caso de pitavastatina, ni de ezetimiba, aunque consensuaron que pitavastatina es la estatina idónea en sujetos prediabéticos o diabéticos. Esto está en consonancia con un reciente metanálisis, que incluyó 15 estudios con 1.600 personas año, y que concluyó que el empleo de pitavastatina, comparada con placebo u otras estatinas, no empeora el metabolismo de la glucemia en pacientes no diabéticos28; con resultados del estudio LIVES29, en el que se observó que en el empleo de pitavastatina descendía la hemoglobina glucosilada (HBA1c) en sujetos diabéticos; o con el estudio J-PREDICT30, que mostró la disminución de un 18 % en los nuevos diagnósticos de diabetes cuando la pitavastatina se empleó en sujetos “prediabéticos” (glucemia basal entre 100 y 125 mg/dl o/y HbA1c de al menos 6 % y menor de 6,5 %) frente a placebo.
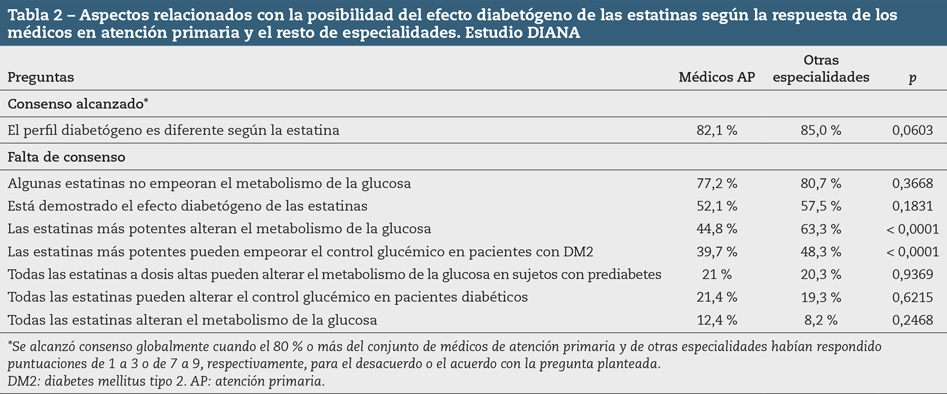
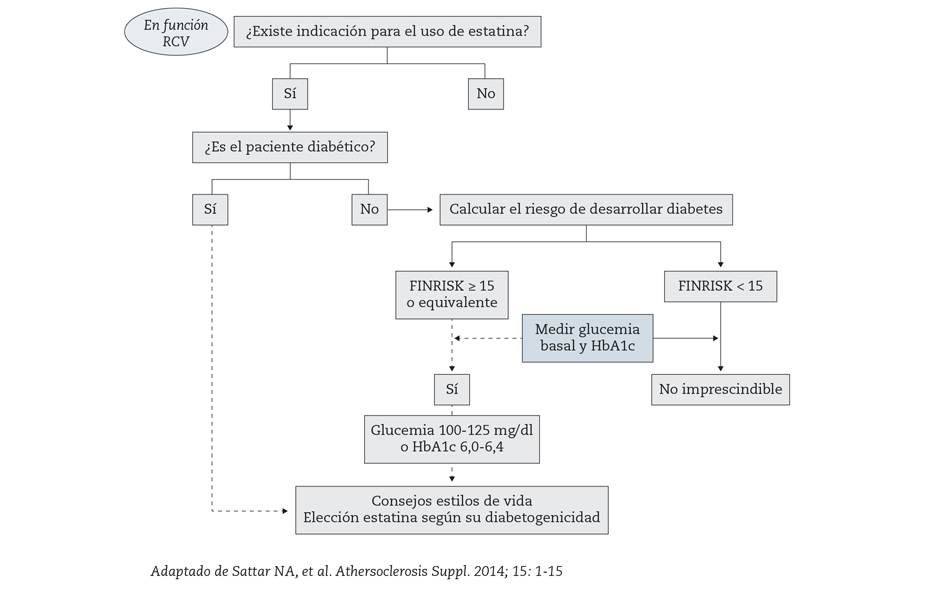
Figura 2 – Algoritmo de elección de hipolipemiante.
Conclusiones
Según los datos del Estudio DIANA existen entre los médicos discrepancias en el empleo de las estatinas. Aunque hay consenso entre los médicos, tanto de AP como de otras especialidades, en valorar la eficacia en el descenso de cLDL y la posibilidad de interacciones como factores relevantes en la elección de la estatina, el impacto es menor y existe falta de consenso en referencia al efecto diabetógeno de las mismas.
De manera global, los médicos indicaron que no todas las estatinas tienen el mismo efecto diabetógeno, pero no existió consenso en la importancia de la potencia y la dosis de la estatina empleada y su relación con la gravedad del efecto diabetógeno, así como tampoco en su influencia en el metabolismo glucémico en los sujetos diabéticos y en los prediabéticos.
Tampoco se obtuvo un consenso sobre el posible efecto diabetógeno de pitavastatina ni de ezetimiba, aunque sí consensuaron que la pitavastatina es la estatina idónea en sujetos prediabéticos o diabéticos; esta última respuesta puede estar sesgada por el contexto del estudio.
Las diferencias de apreciación entre los médicos de AP y los de otras especialidades pueden surgir por la visión más holística que el médico de AP tiene del paciente, la mayor frecuencia y el mayor tiempo de seguimiento que el médico de AP tiene respecto a los médicos de otras especialidades.
En vista de los resultados obtenidos en el Estudio DIANA y el conocimiento científico en la materia, resulta conveniente implementar, entre los médicos de AP y los del resto de especialidades, acciones que actualicen el conocimiento sobre el empleo de estatinas; se deben recordar que identificar los pacientes diabéticos, con síndrome metabólico o con mayor riesgo de desarrollar diabetes, permitirá utilizar la opción hipolipemiante más idónea durante largos periodos de tiempo.
Agradecimientos
A los panelistas encuestados. A Adelphi Spain (Barcelona), encargada de implementar el proyecto, asistir al comité científico en el diseño, análisis estadístico y obtención de resultados finales del proyecto.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que en esta investigación no se han llevado a cabo experimentos con humanos ni animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Beca o soporte financiero
Laboratorios Esteve ha dado apoyo al comité científico para desarrollar las tareas de campo de la encuesta Delphi de este estudio, sin participar en el diseño, análisis de datos, ni en la redacción del presente artículo.
Conflicto de intereses
Los autores declaran que, pese al soporte recibido por Laboratorios Esteve (apoyo al comité científico para desarrollar las tareas de campo de la encuesta Delphi de este estudio, sin participar en el diseño, análisis de datos, ni en la redacción del presente artículo), no ha habido ningún conflicto de interés que haya podido influir en la recogida y análisis de datos y en la presentación de los resultados.
Bibliografía
- Catapano AL, Graham I, De Backer G, Wiklund O, Chapman MJ, Drexel H, et al. 2016 ESC/EAS guidelines for the management of dyslipidaemias: the task force for the management of dyslipidaemias of the European society of cardiology (ESC) and European Atherosclerosis society (EAS) developed with the special contribution of the Europea. Atherosclerosis. 2016; 253: 281-344.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010; 376: 1670-81.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Fulcher J, O’Connell R, Voysey M, Emberson J, Blackwell L, Mihaylova B, et al. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015; 385: 1397-405.
- Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015; 372: 2387-97.
- Colhoun HM, Betteridge DJ, Durrington PN, Hitman GA, Neil HWA, Livingstone SJ, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicenter randomized placebo-controlled trial. Lancet. 2004; 364: 685-96.
- Cholesterol Treatment Trialists´(CTT) Collaborators. Efficacy of colesterol-lowering therapy in 18686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008; 371: 117-25.
- Golomb BA, Evans MA. Statin adverse effects: a review of the literature and evidence for a mitochondrial mechanism. Am J Cardiovasc Drugs 2008; 8: 373-418.
- Sabatine MS, Cannon CP. High-dose atorvastatin associated with worse glycemic control: A PROVE-IT TIMI 22 substudy [abstract]. Circulation. 2004; 100(Suppl.III): 834.
- Ridker PM, Pradhan A, Mac Fadyen JG, Libby P, Glynn RJ. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. Lancet. 2012; 380: 566-71.
- Sattar N, Preiss D, Murray HM, Welsh P, Buckley BM, de Craen AJM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomized statin trials. Lancet. 2010; 375: 735-42.
- Rius-Tarruella J, Millán Nuñez-Cortés J, Pedro-Botet J, Pintó X. La diabetogenicidad de las estatinas: ¿son todas iguales? Estado de la cuestión. Clin Invest Arterioscl. 2015; 27: 148-58.
- Preiss D, Rao S, Seshasai SRK, Welsh P, Murphy SA, Ho JE, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA. 2011; 305: 2556-64.
- Cederberg H, Stancáková A, Yaluri N, Modi S, Kuusisto J, Laakso M. Increased risk of diabetes with statin treatment is associated with impaired insulin sensitivity and insulin secretion: a 6-year follow-up study of the METSIM cohort. Diabetologia. 2015; 58: 1109-17.
- Culver AL, Ockene IS, Balasubramanian R, Olendzki BC, Sepavich DM, Wadawski-Wende J, et al. Statin use and risk of diabetes mellitus in postmenopausal Women´s Health Initiative. Arch Intern Med. 2012; 172: 144-52.
- Waters DD, Ho JE, Boekholdt SM, DeMicco DA, Kastelein JJP, Messig M, et al. Cardiovascular event reduction versus new-onset diabetes during atorvastatin therapy: effect of baseline risk factors for diabetes. J Am Coll Cardiol. 2013; 61: 148-52.
- DuBroff RJ. The statin diabetes conundrum: short-term gain, long-term risk or inconvenient truth? Evid Based Med. 2015; 20: 121-3.
- Macedo AF, Douglas I, Smeeth L, Forbes H, Ebrahim S. Statins and the risk of type 2 diabetes mellitus: cohort study using de UK clinical practice pesearch datalink. BMC Cardiovas Disord. 2014; 14: 85.
- Dalkey NC. The Delphi method: an experimental study of group opinion. Santa Monica: Rand Corporation; 1969.
- Dalkey NC, Brown B, Cochran S. The Delphi method, III: use of self ratings to improve group estimates. Santa Monica: Rand Corporation; 1969.
- Fick DM, Cooper JW, Wade WE, Waller JL, Maclean JR, Beers MH. Updating the Beers criteria for potentially inappropriate medication use in older adults. Results of a US consensus panel of experts. Arch Intern Med. 2003; 163: 2716-24.
- Peiró S, Portella E. El grupo nominal en el entorno sanitario. Quaderns de Salut Publica i Administració de Serveis de Salut 1. València: Escola Valenciana d’Estudis per a la Salut; 2003.
- Royle P, Waugh N. Literature searching for clinical and cost-effectiveness studies used in health technology assessment reports carried out for the National Institute for Clinical Excellence appraisal system. Health Technol Assess. 2003; 7: 1-51.
- Fitch K, Bernstein SJ, Aguilar MD, Burnand B, LaCalle JR, Lazaro P, et al. The RAND/UCLA Appropriateness Method User’s Manual. 2001. Disponible en: http://www.rand.org/pubs/monograph_reports/MR1269.html [consultado 27 setiembre 2015].
- Goodman LA. Snowball sampling. Ann Math Stat. 1961; 32: 148-70.
- Swerdlow DI, Sattar N. A dysglycaemic effect of statins in diabetes: relevance to clinical practice? Diabetologia. 2014; 57: 2433-5.
- Mansi I, Frei CR, Wang C, Mortensen EM. Statins and new-onset diabetes mellitus and diabetic complications: a retrospective cohort study of US healthy adults. J Gen Intern Med. 2015; 30: 1599-610.
- Sattar NA, Ginsberg H, Ray K, Chapman MJ, Arca M, Averna M, et al. The use of statins in people at risk of developing diabetes mellitus: Evidence and guidance for clinical practice. Atheroscler Suppl. 2014; 15: 1-15.
- Vallejo-Vaz AJ, Kondapally Seshasai SR, Kurogi K, Michishita I, Nozue T, Sugiyama S, et al. Effect of pitavastatin on glucose, HbA1c and incident diabetes: A meta-analysis of randomized controlled clinical trials in individuals without diabetes. Atherosclerosis. 2015; 241: 409-18.
- Yokote K, Shimano H, Urashima M, Teramoto T. Efficacy and safety of pitavastatin in Japanese patients with hypercholesterolemia: LIVES study and subanalysis. Expert Rev Cardiovasc Ther. 2011; 9: 555-62.
- Odawara M, Yamazaki T, Kishimoto J, Ito C, Noda M, Terauchi Y, et al. Effect of pitavastatin on the incidence of diabetes in japanese individuals with impaired glucose tolerance. Abstract presented: 49th Annual Meeting of the European Association for the Study of Diabetes (EASD). 23-27 Sept. 2013; Barcelona, España. Disponible en: http://www.easd2013.com.


