Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 24 de febrero de 2020
Aceptado el 13 de enero de 2021
On-line el 16 de septiembre de 2021
Palabras clave:
Agonistas selectivos b-3-adrenérgicos
Vejiga hiperactiva
Vibegrón
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero).
Keywords:
Selective b-3-adrenergic agonists
Overactive bladder
Vibegron
Antonio Alcántara Montero*, Mario Tovar Matsuki Martín de Prado
Centro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres, Cáceres.
Resumen
Objetivo. Describir el perfil farmacológico y resumir el desarrollo clínico de vibegrón, nuevo agonista de los receptores β-3-adrenérgicos, recientemente aprobado en Japón para el tratamiento de la vejiga hiperactiva (VH).
Métodos. Búsqueda bibliográfica utilizando las bases de datos Medline/PubMed, Google Scholar, PsycInfo y ClinicalTrials.gov, así como Congresos Internacionales de Urología sobre vibegrón en el tratamiento de la VH.
Resultados. Basado en los resultados de los ensayos japoneses de fase III y el ensayo global de fase IIb, vibegrón 50 mg/día mejoró la calidad de vida y los síntomas de urgencia, frecuencia urinaria, nocturia, incontinencia de urgencia e incontinencia urinaria en pacientes con VH. Presenta un buen perfil de seguridad tanto en monoterapia como administrado de forma concomitante con tolterodina de liberación prolongada. Un aumento de la dosis a 100 mg/día mejoró los síntomas de la VH sin aumentar apenas los efectos adversos en los pacientes que no respondieron a vibegrón 50 mg/día. Los ensayos de fase III EMPOWUR (NCT03492281; EudraCT2017-003293-14) y su extensión (NCT03583372; EudraCT2017-003294-33) están en curso.
Conclusiones. Aunque actualmente sólo está aprobado en Japón, vibegrón 50 y 100 mg/día presenta un buen perfil de eficacia y seguridad para el tratamiento de la VH.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Vibegron, new selective agonist of the beta-3-adrenergic receptors in the treatment of hyperactive bladder
Abstract
Objective. Describe the pharmacological profile and summarize the clinical development of vibegrón, new selective β3 adrenergic receptor agonist, which has recently been approved in Japan for the treatment of overactive bladder (OAB).
Methods. Bibliographic search using Medline/PubMed, Google Scholar, PsycInfo and ClinicalTrials.gov databases, as well as International Congresses of Urology on vibegron for the treatment of OAB.
Results. Based on the results of the phase III Japanese trials and the phase IIb global trial, vibegron 50 mg/day improved quality of life and symptoms of urgency, urinary frequency, nocturia, urge incontinence and urinary incontinence in patients with OAB; presenting a good safety profile both in monotherapy and concomitantly administered with tolterodine extended release. An increase of the dose to 100 mg/day improved the symptoms of the OAB without hardly increasing the adverse effects in those patients who did not respond to vibegron 50 mg/day. The phase III EMPOWUR (NCT03492281; EudraCT2017-003293-14) and the extension to EMPOWUR (NCT03583372; EudraCT2017-003294-33) are ongoing.
Conclusions. Although currently only approved in Japan, vibegron 50 y 100 mg/day has a good efficacy and safety profile for the treatment of OAB.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
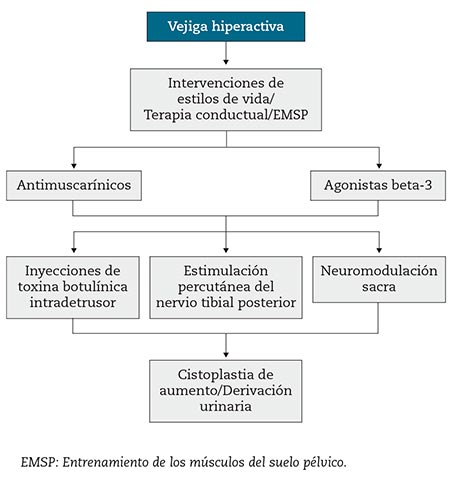
Los agonistas de los receptores β-3-adrenérgicos (β3AR) se han posicionado actualmente como tratamiento de primera línea, junto con los antimuscarínicos, en el abordaje farmacológico de la vejiga hiperactiva (VH) (Fig. 1)1,2. Estos fármacos relajan el músculo detrusor de la vejiga y mejoran la capacidad de almacenamiento en la fase de llenado, sin afectar a la presión de vaciado, por lo que reducen la frecuencia miccional y el número de episodios de incontinencia y de urgencia en los pacientes con VH. Actualmente, dentro de este grupo terapéutico, solo disponemos de mirabegrón, comercializado en España desde abril de 20143.
Vibegrón, nuevo agonista de los β3AR, fue aprobado en Japón el 21 de septiembre de 2018 para el tratamiento de la urgencia, frecuencia urinaria, incontinencia de urgencia e incontinencia urinaria en pacientes con VH. La dosis recomendada es de 50 mg por vía oral una vez al día después de los alimentos4,5. Se encuentra en desarrollo clínico para el tratamiento de la VH en muchos otros países del mundo (incluso en varones con hiperplasia benigna de próstata y en el tratamiento del dolor asociado a síndrome del intestino irritable en Estados Unidos)6.
El objetivo de esta revisión es describir el perfil farmacológico y resumir el desarrollo clínico de vibegrón (Fig. 2) que dio lugar a esta primera aprobación en Japón para el tratamiento de la VH. Para ello se llevó a cabo una búsqueda bibliográfica utilizando las bases de datos Medline/PubMed, Google Scholar, PsycInfo y ClinicalTrials.gov de artículos sobre vibegrón (perfil farmacológico, eficacia y seguridad) en el tratamiento de la VH. La búsqueda de evidencia reciente se extendió a Congresos Internacionales de Urología (American Urology Association y European Association of Urology).
Figura 1 – Algoritmo actual de tratamiento de la vejiga hiperactiva (adaptada cita 2).
Figura 2 – Momentos clave en el desarrollo de vibegrón en vejiga hiperactiva.
Perfil farmacológico de vibegrón
En los estudios japoneses se ha demostrado una farmacocinética de vibegrón proporcional a la dosis (de hasta 300 mg) cuando se administraba por vía oral en ayunas a voluntarios sanos masculinos. Después de la administración una vez al día de 50, 100 o 200 mg durante 14 días, el pico de concentración plasmática máxima (Cmax) se logró en 1-3 horas (tmax) después de la administración. El área bajo la curva de concentración plasmática de 0 a 24 h (AUC 24) en el día 14 fue 1,84-2,29 veces más alta que la observada en el día 1. El tiempo para alcanzar el estado de equilibrio fue de 7 días. La Cmax y el AUC fueron 1,73 y 1,4 veces más altos, respectivamente, en ayuno que con alimentos; los alimentos no tuvieron efecto en el tmax o en la semivida de eliminación (t 1/2). Vibegrón se une en un 49,6-51,3 % a proteínas plasmáticas e, in vitro, la relación sangre-plasma fue de 0,8-1,04,5.
Vibegrón se metaboliza a través de glucuronidación y oxidación; se han identificado tres metabolitos glucurónidos y dos metabolitos oxidativos, aunque el fármaco inalterado es el componente principal que se observa en el plasma después de la administración oral. La t 1/2 es de 60-70 horas; la excreción se realiza a través de las heces (59,2 %) y la orina (20,3 %), predominantemente (91,0 y 92,7 %, respectivamente) como fármaco inalterado4,5. No induce ni inhibe las enzimas del citocromo P450 (CYP)7,8, pero se cree que es un sustrato para CYP3A4 y glicoproteína P (gp-P). Sus concentraciones plasmáticas pueden incrementarse cuando se administra conjuntamente con fármacos que inhiben el CYP3A4 y la gp-P (incluidos ritonavir y antimicóticos azólicos, como itraconazol y ketoconazol), y se reducen cuando se administran conjuntamente con fármacos que inducen el CYP3A4 y la gp-P (incluidos rifampicina, fenitoína y carbamazepina)4,5. No inhibe el CYP2D6 in vitro7,8, y en un estudio clínico de interacción farmacológica en voluntarios sanos, las exposiciones (Cmax, AUC 24) de tolterodina (un sustrato sensible del CYP2D6) no aumentaron cuando vibegrón y tolterodina fueron administrados juntos9. La exposición a vibegrón aumenta en ancianos (edad ≥ 65 años) y en pacientes con insuficiencia renal leve, moderada o grave o disfunción hepática moderada; mientras que no se requieren ajustes de dosis en estos grupos de pacientes, es necesaria precaución cuando se administra a ancianos o personas con disfunción hepática grave4,5.
Datos de eficacia de vibegrón en vejiga hiperactiva
Ensayos japoneses de fase III
El tratamiento con vibegrón mejoró significativamente los síntomas de VH (frecuencia miccional, número de episodios de urgencia, incontinencia de urgencia, incontinencia y nocturia) e incrementó de volumen de vaciado/micción en dos ensayos multicéntricos, de fase III en pacientes japoneses con VH10,11.
En la semana 12 de un ensayo aleatorizado, doble ciego, controlado con placebo, los pacientes tratados con vibegrón 50 mg (n= 370) o 100 mg (n= 368) una vez al día experimentaron una reducción significativamente mayor (p< 0,001) en las micciones/día que los del grupo placebo (n= 369) [cambio en media de mínimos cuadrados desde la situación basal a la semana 12: -2,08 y -2,03 frente a -1,21]; la media de las micciones/día al inicio del estudio fueron 11,13, 11,08 y 11,20, respectivamente11. En comparación con el grupo placebo, los pacientes que recibieron vibegrón 50 y 100 mg/día también experimentaron reducciones significativamente mayores desde el inicio en el número de episodios de urgencia/día (p< 0,001), episodios de incontinencia de urgencia/día (p≤ 0,001), episodios de incontinencia/día (p≤ 0,001) y episodios de nocturia/día (p≤ 0,016) y un incremento significativamente mayor del volumen de vaciado/micción (p< 0,001). La mejora en los síntomas de VH en los pacientes que recibieron vibegrón 50 mg y 100 mg/día fue evidente desde la semana 4 en adelante (los cambios en los síntomas de VH no se evaluaron antes de las 4 semanas)11.
Por otro lado, se observaron mejoras desde el inicio del tratamiento en la mayoría de los dominios de calidad de vida relacionada con la salud (HR-QOL, de las siglas en inglés health-related quality of life) con cualquiera de las dosis de vibegrón de forma significativa (p< 0,05) frente a placebo; además, los pacientes que recibieron vibegrón 50 o 100 mg/día estaban significativamente más satisfechos que los del grupo placebo con el tratamiento recibido (p< 0,001). Este estudio también incluyó una rama de control activo (imidafenacina 0,1 mg dos veces al día; n= 117), en el que no se observaron diferencias estadísticamente significativas en términos de eficacia frente a los pacientes que recibieron vibegrón 50 o 100 mg/día. En este ensayo aproximadamente el 90 % de los pacientes en cada rama de tratamiento eran mujeres y tres cuartas partes presentaban una VH húmeda (o VH con incontinencia urinaria de urgencia) (77-80 %); la edad media de los pacientes fue de 58 años; la duración media de los síntomas de VH fue de 61 meses y la mayoría (81-83 %) de los pacientes no habían recibido tratamiento para la VH en el año anterior11.
Entre los pacientes japoneses con VH incluidos en este ensayo de fase III se realizó un análisis post hoc para estudiar la eficacia de vibegrón en nocturia. Se incluyeron 669 pacientes con nocturia (≥ 1 vaciado nocturno). En la semana 12 la frecuencia de micción nocturna se redujo desde el inicio en 0,74 y 0,78, respectivamente, para los grupos de vibegrón 50 y 100 mg; las reducciones fueron significativas en comparación con el grupo placebo (p< 0,05 y p< 0,001, respectivamente). El volumen medio de los vaciados nocturnos y el volumen de la primera evacuación nocturna fueron significativamente mayores en los grupos de vibegrón que en el grupo de placebo. Los grupos de vibegrón mostraron correlaciones significativas de horas de sueño ininterrumpido con los cambios en la frecuencia de evacuación nocturna y en el volumen de la primera evacuación nocturna. El tratamiento con vibegrón, sin ningún tratamiento antimuscarínico previo, con ≥ 12 vaciados por día y horas de sueño ininterrumpido < 180 min, contribuyó significativamente a una reducción en la frecuencia del vaciamiento nocturno. Por tanto, concluyen los autores, vibegrón puede ser una opción terapéutica útil para mejorar la nocturia en pacientes con VH12.
Por otra parte, se observaron mejoras significativas (p< 0,001) desde el inicio en los síntomas de VH (micciones medias/día, episodios de urgencia/día, episodios de incontinencia de urgencia/día, episodios de incontinencia/día y episodios de nocturia/día) en un ensayo de seguridad, abierto, no controlado, de 52 semanas, en el que los pacientes (n= 169) fueron tratados con vibegrón una vez al día. Las mejoras en los síntomas se observaron a partir de la semana 4 de tratamiento (p< 0,05 frente al valor basal) y se mantuvieron hasta el final del estudio10. Inicialmente, todos los pacientes recibieron 50 mg de vibegrón una vez al día, que podían aumentarse a 100 mg una vez al día después de la semana 8 si la eficacia era insuficiente. En el conjunto de análisis completo, 115 pacientes permanecieron con la dosis de 50 mg/día durante todo el estudio, y 51 pacientes recibieron la dosis aumentada después de la semana 8. En este ensayo la duración media de los síntomas de VH en situación basal fue de 70 meses; el 88 % de los pacientes eran mujeres; la edad media fue de 61 años; 68 % de los pacientes tenían VH húmeda y 65 % no habían recibido tratamiento para la VH en el año anterior10.
Ensayo global de fase IIb
Vibegrón mejoró significativamente la frecuencia miccional, la incontinencia de urgencia y los episodios de incontinencia y urgencia, así como medidas de HR-QOL en pacientes con VH en un ensayo grande (n= 1.395), global, aleatorizado, doble ciego, de 12 semanas, controlado con comparador activo y placebo13, y en su estudio de extensión de 1 año14. En la semana 8 se evidenciaron reducciones significativas con respecto a la situación basal en las micciones diarias medias por mínimos cuadrados en los grupos de vibegrón 50 y 100 mg y en los que recibieron tolterodina de liberación prolongada (LP) 4 mg (cambio desde el inicio y frente a placebo: -0,64, p= 0,007; -0,91, p< 0,001; y -0,54, p= 0,026, respectivamente).
Asimismo, los episodios promedios diarios de incontinencia urinaria de urgencia y de urgencia fueron significativamente reducidos desde el inicio en los tres grupos de tratamientos y frente a placebo (todos p< 0,05). Clínicamente y estadísticamente hubo mejoras significativas en la media del número de micciones diarias (-0,53 y -0,52) y episodios de urgencia (-0,61 y -0,72) en el grupo de vibegrón 50 y 100 mg con respecto a placebo de la semana 2 en adelante. Mejoras significativas desde la situación basal en cuatro dominios de HR-QOL (King’s Health Questionnaire: impacto de la incontinencia, limitación de las actividades cotidianas, limitaciones físicas y relaciones personales) también fueron evidentes en la semana 8 en la primera parte del ensayo (p <0,05; análisis exploratorio)13. Por otro lado, se observaron beneficios significativos en otros dos dominios (limitaciones sociales y emociones) en la segunda parte del ensayo. Se mantuvieron igualmente mejoras en los síntomas de VH con vibegrón 50 y 100 mg una vez al día en esta segunda parte del ensayo13; y durante las 52 semanas del estudio de extensión14.
En la parte 1 del ensayo los pacientes (n= 987) fueron aleatorizados a una de las siete ramas de tratamiento de 8 semanas: vibegrón 3, 15, 50 o 100 mg una vez al día; tolterodina LP 4 mg/día; vibegrón 50 mg una vez al día + tolterodina LP 4 mg/día durante 4 semanas, luego vibegrón 50 mg una vez al día durante las 4 semanas restantes; o placebo. En la parte 2 los pacientes (n= 408) fueron aleatorizados para recibir 4 semanas de tratamiento con vibegrón 100 mg una vez al día, tolterodina LP 4 mg/día, vibegrón 100 mg una vez al día + tolterodina LP 4 mg/día o placebo13. Quienes completaron las partes 1 y 2 fueron elegibles para el estudio de extensión de seguridad, ciego, en el que los pacientes fueron aleatorizados a vibegrón 50 o 100 mg una vez al día, tolterodina LP 4 mg/día o vibegrón 100 mg una vez al día + tolterodina LP 4 mg/día14. La mayoría de los pacientes fueron mujeres (90 %) y presentaban VH húmeda (81 %); la edad media fue de 59 años13.
Datos de seguridad de vibegrón en vejiga hiperactiva
Proporciones similares de pacientes en las ramas de vibegrón 50 o 100 mg/día y placebo presentaron efectos adversos emergentes del tratamiento (TEAE, de las siglas en inglés treatment emergent adverse events) (28,1 %, 30,4 % y 27,4 %) o TEAE relacionados con los fármacos (7,6 %, 5,4 % y 5,1 %) en el ensayo japonés de fase III controlado con placebo11. La tasa TEAE y TEAE relacionados con los fármacos fueron mayores en el grupo de imidafenacina (33,3 % y 10,3 %, respectivamente). Los TEAE más comunes relacionados con vibegrón 50 o 100 mg, imidafenacina o placebo (> 1 % de los pacientes en cualquier grupo de tratamiento) fueron estreñimiento (1,6 %, 0,3 %, 0,9 % y 0,8 %, respectivamente), boca seca (1,4 %, 0,3 %, 4,3 % y 0,5 %) y aumento de los niveles de fosfatasa alcalina (0 %, 0,3 %, 1,7 % y 0,3 %). No se informó de TEAE graves relacionados con los fármacos y unos pocos pacientes (0,8 %, 0,5 %, 0,9 % y 0,3 %, en los respectivos grupos) suspendieron el tratamiento debido a los TEAE relacionados con los fármacos11.
En el análisis conjunto de seguridad del ensayo pequeño japonés (n= 167), de 52 semanas, no controlado, abierto, se informó de TEAE en 55,1 % y de TEAE relacionados con los fármacos en 16,2 % de los pacientes10. Los TEAE relacionados con los fármacos más comunes en pacientes que permanecieron con vibegrón 50 mg una vez al día durante todo el periodo (n= 116) fueron aumento del volumen residual de orina (4,3 %), sequedad de boca (2,6 %), cistitis (2,6 %) y estreñimiento (1,7 %); en los pacientes que recibieron la dosis aumentada (100 mg una vez al día) durante las semanas 9 a 52 (n= 51) fueron sequedad de boca (3,9 %) y estreñimiento (3,9 %). Cabe señalar que el 20,5 % de los pacientes en este ensayo recibieron tratamiento concomitante con antimuscarínicos (por ejemplo, solifenacina, fesoterodina, imidafenacina y propiverina). La mayoría de los TEAE fueron de intensidad leve o moderada; los TEAE graves (todos los cuales también se consideraron efectos adversos graves) solo fueron recogidos en el grupo de vibegrón 50 mg una vez al día, e incluyeron un paciente con angina de pecho, una angina de Prinzmetal, una caída (que causó la muerte) y un infarto cerebral (solo este último TEAE fue considerado relacionado con el fármaco). No hubo muertes relacionadas con los fármacos durante el ensayo; seis pacientes abandonaron el tratamiento debido a los TEAE (un paciente debido a la angina de pecho, la angina de Prinzmetal, la caída y el infarto cerebral; dos pacientes debido al aumento del volumen de orina residual, ambos estaban recibiendo antimuscarínicos de forma concomitante)10.
En el ensayo global de fase IIb los TEAE relacionados con los fármacos más frecuentes reportados en todos los grupos de tratamiento (n= 1.393) (>1 % de los pacientes en cualquier grupo de tratamiento) fueron sequedad de boca (4,7 %), estreñimiento (2,2 %), cefalea (1,8 %) y fatiga (1,1 %)13. La sequedad de boca fue significativamente más frecuente (p< 0,05) en el grupo de tolterodina LP (8,6 %) y en el grupo de vibegrón 50 o 100 mg más tolterodina LP (8,2 % y 11,8 %, respectivamente) que en los grupos de vibegrón 50 o 100 mg/día en monoterapia (4,7 % y 1,5 %) o en el grupo placebo (2,9 %)13.
Resultados preliminares del estudio EMPOWUR
EMPOWUR fue un ensayo clínico fase III internacional, aleatorizado, doble ciego, controlado con placebo y con comparador activo que, evaluó la seguridad y la eficacia de vibegrón en hombres y mujeres con síntomas de VH, incluyendo frecuencia miccional, urgencia e incontinencia urinaria. Un total de 1.518 pacientes fueron aleatorizados al azar en 215 centros durante de 12 semanas, con un periodo de seguimiento de seguridad de cuatro semanas, en uno de los tres grupos de tratamiento: vibegrón 75 mg administrado por vía oral una vez al día; placebo administrado por vía oral una vez al día; o tolterodina LP 4 mg administrada por vía oral una vez al día. Además, 507 pacientes que completaron el ensayo EMPOWUR fueron incluidos en un estudio de extensión doble ciego de 40 semanas para evaluar la seguridad del tratamiento a largo plazo.
Los objetivos primarios de este estudio fueron: cambio desde el inicio (o situación basal) en el número promedio de micciones durante 24 horas en todos los pacientes; y cambio desde el inicio en el número promedio de episodios de incontinencia urinaria de urgencia en 24 horas en pacientes que tenían uno o más episodios de incontinencia urinaria de urgencia por día antes del tratamiento. Los objetivos secundarios incluyeron cambios en la frecuencia de episodios de urgencia y episodios de incontinencia urinaria, y puntuaciones de calidad de vida autoinformadas por los pacientes15,16.
En el análisis de eficacia primaria, vibegrón una vez al día cumplió los criterios de valoración primarios en la semana 12 y obtuvo una significación estadística sobre el placebo tanto en la reducción de los episodios diarios de incontinencia urinaria de urgencia (p< 0,0001) como en la reducción de las micciones diarias (p< 0,001); en el caso de tolterodina LP no se alcanzaron diferencias estadísticamente significativas frente a placebo para dichos criterios de valoración primarios (p< 0,0123 y p< 0,0988, respectivamente). La diferencia de vibegrón con el placebo fue estadísticamente significativa desde la semana 2, que fue el primer punto de tiempo medido, tanto para los episodios de incontinencia urinaria de urgencia como para las micciones (p< 0,0001 y p< 0,001, respectivamente), y se mantuvo una eficacia estadísticamente significativa en todos los puntos de medida (semanas 2, 4, 8 y 12) para ambos objetivos. Además, en todos estos espacios de tiempo vibegrón logró una eficacia numéricamente mejor que tolterodina LP. Por otro lado, también se alcanzaron los criterios de valoración secundarios previamente especificados, incluyendo una reducción estadísticamente significativa en los episodios de urgencia diaria en comparación con el placebo (p= 0,002)15,16.
Vibegrón fue bien tolerado y los episodios adversos más comunes informados en relación con placebo (> 2 % en el grupo de vibegrón y mayor que en el grupo placebo) fueron cefalea (4,0 % frente a 2,4 %), nasofaringitis (2,8 % frente a 1,7 %), diarrea (2,2 % frente a 1,1 %) y náuseas (2,2 % frente a 1,1 %). La frecuencia de episodios adversos graves fue similar entre los grupos de tratamiento (1,1 % en placebo, 1,5 % en vibegrón y 2,3 % en tolterodina). La incidencia de hipertensión en el grupo de vibegrón fue igual a la del grupo placebo (1,7 % en vibegrón, 1,7 % en placebo y 2,6 % en tolterodina)15,16.
De acuerdo con estos resultados, Urovant Sciences, compañía farmacéutica responsable del desarrollo clínico de vibegrón en el mundo (a excepción de Japón y otros países asiáticos), presentó una Solicitud de Nuevo Medicamento (NDA, por sus siglas en inglés New Drug Application) a la Food and Drug Administration de Estados Unidos a principios de 2020.
Conclusiones
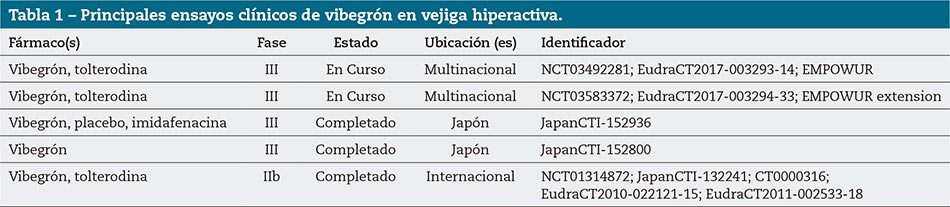
En los resultados de los ensayos japoneses de fase III y el ensayo global de fase IIb, vibegrón 50 mg/día mejoró la calidad de vida y los síntomas de urgencia, frecuencia urinaria, nocturia, incontinencia de urgencia e incontinencia urinaria en pacientes con VH; presentó un buen perfil de seguridad tanto en monoterapia como administrado de forma concomitante con tolterodina de LP. Un aumento de la dosis a 100 mg/día mejoró los síntomas de la VH sin aumentar apenas los efectos adversos en pacientes que no respondieron a vibegrón 50 mg/día. Los ensayos fase III EMPOWUR (NCT03492281; EudraCT2017-003293-14) y su extensión (NCT03583372; EudraCT2017-003294-33) están en curso (Tabla 1). Por tanto, vibegrón puede ser un tratamiento prometedor para la VH en monoterapia con la dosis habitual de 50 mg/día, con posibilidad de un aumento de la dosis a 100 mg/día si la eficacia fuera insuficiente.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Burkhard FC, Bosch JLHR, Cruz F, Lemack GE, Nambiar AK, Thiruchelvam N, et al. EAU Guidelines on Urinary incontinence. European Association of Urology. 2019 [consultado 8 octubre 2019]. Disponible en: http://uroweb.org/guideline/urinary-incontinence/
- Alcántara Montero A. Propuesta de algoritmo de tratamiento para pacientes con síndrome de vejiga hiperactiva resistente a fármacos. Actas Urol Esp. 2017; 41: 657-8.
- Alcántara Montero A. Novedades en el tratamiento médico de la vejiga hiperactiva. Semergen. 2016; 42: 557-65.
- Kyorin Pharmaceutical. Beova Tablets 50 mg: Japanese prescribing information. 2018 [consultado 8 octubre 2019]. Disponible en: http://www.pmda.go.jp/english/index.html
- Keam SJ. Vibegron: First Global Approval. Drugs. 2018; 78: 1835-9.
- Urovant Sciences. Pipeline. 2018 [consultado 8 octubre 2019]. Disponible en: https://urovant.com/pipeline/
- Edmondson SD, Zhu C, Kar NF, Di Salvo J, Nagabukuro H, Sacre-Salem B, et al. Discovery of vibegron: A potent and selective β3 adrenergic receptor agonist for the treatment of overactive bladder. J Med Chem. 2016; 59: 609-23.
- Di Salvo J, Nagabukuro H, Wickham LA, Abbadie C, DeMartino JA, Fitzmaurice A, et al. Pharmacological characterization of a novel beta 3 adrenergic agonist, vibegron: evaluation of antimuscarinic receptor selectivity for combination therapy for overactive bladder. J Pharmacol Exp Ther. 2017; 360: 346-55.
- Rutman MP, King JR, Bennett N, Ankrom W, Kenilworth, NJ, Mudd PN. PD14-01: Once-dayly vibegron, a novel oral β3 agonist does not inhibit CYP2D6, a common pathway for drug metabolism in patients on OAB medications. 2019 [consultado 8 octubre 2019]. Disponible en: https://www.auajournals.org/doi/abs/10.1097/01.JU.0000555478.73162.19.
- Yoshida M, Kakizaki H, Takahashi S, Nagai S, Kurose T. Long-term safety and efficacy of the novel β3 -adrenoreceptor agonist vibegron in Japanese patients with overactive bladder: A phase III prospective study. Int J Urol. 2018; 25: 668-75.
- Yoshida M, Takeda M, Gotoh M, Nagai S, Kurose T. Vibegron, a novel potent and selective β3-adrenoreceptor agonist, for the treatment of patients with overactive bladder: a randomized, double-blind, placebo-controlled phase 3 study. Eur Urol. 2018; 73: 783-90.
- Yoshida M, Takeda M, Gotoh M, Yokoyama O, Kakizaki H, Takahashi S, et al. Efficacy of novel β3 -adrenoreceptor agonist vibegron on nocturia in patients with overactive bladder: A post-hoc analysis of a randomized, double-blind, placebo-controlled phase 3 study. Int J Urol. 2019; 26: 369-75.
- Mitcheson HD, Samanta S, Muldowney K, Pinto CA, de A Rocha B, Green S, et al. Vibegron (RVT-901/MK-4618/KRP-114V) administered once daily as monotherapy or concomitantly with tolterodine in patients with an overactive bladder: A multicenter, phase IIb, randomized, double-blind, controlled trial. Eur Urol. 2019; 75: 274-82.
- Dmochowski R, Mitcheson D, Frenkl T, Bennett N, Mudd PN. Durable efficacy and safety of long-term once-daily vibegron, a novel oral β-3 adrenergic receptor agonist: a 52-week phase 2 study in patients with overactive bladder syndrome [abstract no. PD50-03]. J Urol. 2018;199(suppl 4):e970-1.
- Staskin D, Frankel J, Varano S, Zhou J, Jankowich R, Mudd PN. LBA-02: International Phase 3, double-blind, placebo- and active (tolterodine)-controlled study to evaluate the safety and efficacy of vibegron in patients with symptoms of overactive bladder: EMPOWUR. 2019 [consultado 8 octubre 2019]. Disponible en: https://www.auajournals.org/doi/abs/10.1097/01.JU.0000557494.33637.8c
- Urovant Sciences. EMPOWUR Phase 3 Results. 2019 [consultado 8 octubre 2019]. Disponible en: http://ir.urovant.com/static-files/0f872652-7e32-4474-a97d-5be48a7dc6d0.