Suplemento
Información del artículo
*Autor para correspondencia
Correo electrónico:
afernandezprol@semg.es
(A. Fernandez-Pro Ledesma)..
Dr. Francisco José Brenes Bermúdez
Especialista en Medicina Familiar y Comunitaria. CAP Llefià. Badalona.
Miembro del Grupo de trabajo de Urología (Nefrología y Vías Urinarias) de Sociedad Española de Médicos de Atención Primaria (SEMERGEN).
Dr. Francisco Brotons Muntó
Especialista en Medicina Familiar y Comunitaria.
Jefe de Zona Básica del C.S. Trinitat, Valencia. Miembro del Grupo de Nefrourología de semFYC.
Dr. José Manuel Cozar Olmo
Jefe de Servicio de Urología.
Hospital Universitario Virgen de las Nieves. Granada. Director Patronato Rector de la FIU (AEU).
Dr. Antonio Fernández-Pro Ledesma
Médico General y de Familia. Centro de Salud Menasalbas. Toledo.
Presidente de la Sociedad Española de Médicos Generales y de Familia (SEMG).
Dr. Juan Antonio Martín Jiménez
Médico General y de Familia.
Centro de Salud de Buenavista. Toledo. Sociedad Española de Médicos Generales y de Familia (SEMG).
Dra. Mª Lourdes Martínez-Berganza Asensio
Especialista en Medicina Familiar y Comunitaria. Centro de Salud Mar Báltico. Madrid.
Coordinadora del Grupo de Trabajo de Urología (Nefrología y Vías Urinarias) de Sociedad Española de Médicos de Atención Primaria (SEMERGEN).
Dr. Bernardino Miñana López
Especialista en Urología.
Codirector del Departamento de Urología. Clínica Universidad de Navarra. Madrid/Pamplona.
Dr. José María Molero García
Especialista en Medicina Familiar y Comunitaria. Centro de Salud San Andrés. Madrid.
Coordinador del Grupo de Nefrourología de semFYC. Consejo Asesor de semFYC.
Diagnóstico de la hiperplasia benigna de próstata
1. Introducción
El objetivo principal de este documento de consenso es el abordaje diagnóstico y terapéutico de los varones de 50 o más años de edad, afectados por hiperplasia benigna de próstata (HBP).
Se tendrá en consideración durante su evaluación el diagnóstico diferencial con otras patologías que clínicamente puedan manifestarse con sintomatología en algunos aspectos similares; como la vejiga hiperactiva (VH), que debe ser diagnosticada y tratada conforme a las recomendaciones, documentos y guías que existan sobre este síndrome.
La hiperplasia benigna de próstata (HBP) es una patología con una elevada prevalencia(1,2), que afecta sobre todo a varones mayores de 50 años de edad, y genera alteraciones en su calidad de vida(3). La edad es un factor importante en la aparición y desarrollo de la HBP. Por ello, y debido al envejecimiento progresivo de la población, se espera que su prevalencia sea creciente(1,3).
Estrictamente el término HBP es un concepto histopatológico, ya que describe el crecimiento de la próstata(2). Sin embargo, se considera que el HBP es un síndrome clínico que se caracteriza por un crecimiento benigno de la próstata, que genera una obstrucción a la salida de la orina, y que se manifiesta clínicamente con una serie de síntomas que conocemos como síntomas del tracto urinario inferior (STUI)(3).
Los STUI son el equivalente de las siglas en inglés LUTS (Lower Urinary Tract Symptoms), que Abrams(4) propuso para describir y clasificar distintos síntomas del tracto urinario que presentaba el varón y que podían ser producidos por distintas causas.
En una gran proporción de varones, el crecimiento de la glándula prostática contribuye a la aparición de los STUI, aunque estos no siempre se producen por HBP(5,6).
Diversos estudios han puesto en duda la relación causal entre la próstata y la patogénesis de todos los STUI(5,6). Los STUI no siempre están relacionados con el crecimiento de la próstata; la disfunción de la vejiga también puede causar STUI(6).
La inflamación de la próstata en algunas circunstancias puede desempeñar un papel en la patogénesis y progresión de la HBP; incluso muchas afecciones no urológicas también facilitan la presencia de determinados síntomas urinarios, especialmente con la aparición de nocturia(6). Los STUI se relacionan con el síndrome metabólico(6). Se ha observado que los hombres con STUI de moderados a graves pueden presentar un mayor riesgo de eventos cardiacos(6).
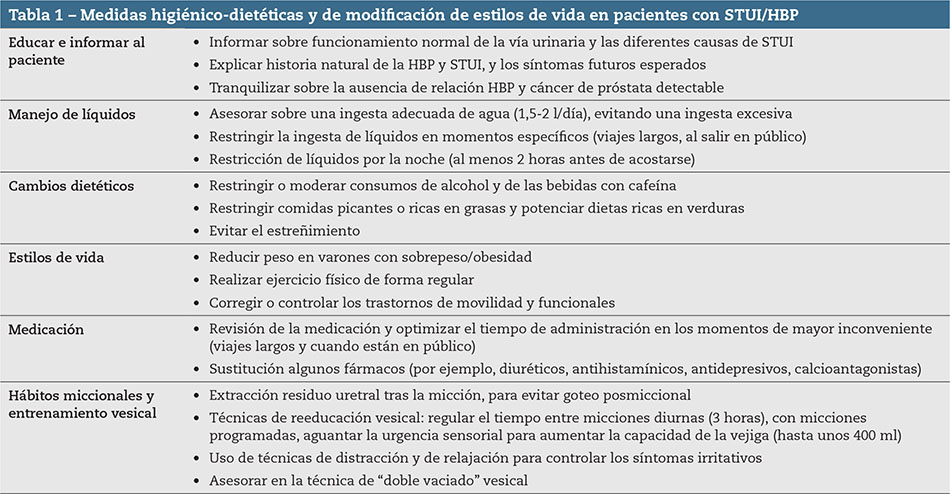
La causa de los STUI como vemos es multifactorial; pueden ser la manifestación clínica de diversas patologías, como son: vejiga hiperactiva (VH), poliuria nocturna, patología infecciosa e inflamatoria, hipoactividad del detrusor, patología urológica, cancerígena, neurológica, metabólica, fármacos, etc.(6); como se puede observar en la Tabla 1, por lo que el término prostatismo no debería en ningún caso utilizarse para describir los STUI en el varón(4).
Así pues, los STUI al igual que la HBP están fuertemente asociados con el envejecimiento(1), por lo que es muy probable que los costes asociados y la carga asistencial aumenten con los cambios demográficos futuros(6).
Los STUI no son exclusivos del varón. Los resultados de diversos estudios epidemiológicos muestran que la presencia de los STUI no se diferencia por sexo o raza y se manifiestan con parecida frecuencia en la mujer(7,8).
Ante la variabilidad de los STUI, la International Continence Society (ICS), en su documento de consenso sobre terminología de los STUI los clasifica en tres grupos, como se puede observar en la Tabla 2(7):
- Síntomas de llenado.
- Síntomas de vaciado.
- Síntomas posmiccionales.
EPILUTS, una gran encuesta realizada a 30.000 hombres y mujeres en Estados Unidos, Reino Unido y Suecia, reveló una enorme superposición entre los diferentes tipos de síntomas mencionados(8). En el varón el crecimiento prostático benigno es la causa principal de los STUI(6,8).
Distinguir y clasificar correctamente los síntomas de vaciado vesical, almacenamiento vesical y síntomas posmiccionales, permitirá que los médicos decidan sobre cuál debe ser el enfoque más adecuado para el tratamiento de los STUI masculino(9,10).
La mayoría de los hombres de edad avanzada tienen al menos un STUI(6,8,10). Sin embargo, los síntomas suelen ser leves o poco molestos(6). En algunos individuos, los STUI persisten y progresan durante largos periodos de tiempo.
Se ha observado que la nocturia es el STUI más frecuente por el que los pacientes suelen acudir de forma voluntaria a la consulta médica(11). En un estudio epidemiológico, el estudio D-Impact, realizado en España, Italia y Francia, se detectó que la prevalencia global de la HBP para aquellos pacientes que consultaban voluntariamente por STUI fue del 66%. No se observaron diferencias estadísticamente significativas entre los diferentes países (Francia, 65%; Italia, 63,9%; y España, 69,1%) (11). Cuando se les preguntaba directamente a los pacientes, la nocturia estaba presente en el 71% y el flujo débil en el 62%(11).
Los STUI más molestos (los de llenado) pueden aparecer hasta en un 30% de los hombres mayores de 65 años. Es el grupo de edad que potencialmente requiere más tratamiento(12).
Hay diversas hipótesis que explican la aparición de los STUI de llenado en la HBP.
Parece ser que la hipertrofia de la pared vesical secundaria al sobreesfuerzo derivado de la obstrucción lleva asociada una denervación progresiva y una inestabilidad del músculo detrusor de la vejiga(5). Se producen una serie de cambios a nivel de la sensibilidad de los receptores tanto muscarinicos como en los alfa-vesicales(10,13).
Otros lo achacan a cambios generados por el envejecimiento y consideran que son cambios inherentes fundamentalmente a la edad, por lo que se puede deducir que los síntomas de llenado no aparecen por el efecto obstructivo prostático per se, sino que aparecen por el efecto irritativo que ejerce la HBP sobre el trígono y la base de la vejiga(10,13).
La aparición de los STUI de vaciado y posmiccionales, se explican por el efecto obstructivo que ejerce el aumento del tamaño prostático y el aumento del tono de la musculatura lisa sobre el tracto de salida(10,13).
La HBP suele manifestarse con sintomatología mixta. La presencia de un solo tipo de síntomas nos hará dudar de que estos se deban a HBP(3,13,14). De hecho, los STUI masculinos con síntomas predominantes de llenado vesical y la VH masculina podría representar un mismo problema(6,12).
En la práctica clínica, en los pacientes diagnosticados de HBP adquiere especial relevancia conocer la influencia de los síntomas miccionales sobre su calidad de vida e identificar la repercusión que sobre estos pueda tener la presencia de otros parámetros, como las comorbilidades, la polimedicación, etc.(13).
2. Diagnóstico de la HBP
Para conocer la relación de los STUI con la HBP es necesario evaluarlos cuidadosamente, para obtener la mayor rentabilidad posible de cada una de las pruebas que podemos utilizar en su diagnóstico(1-3,6,12-14).
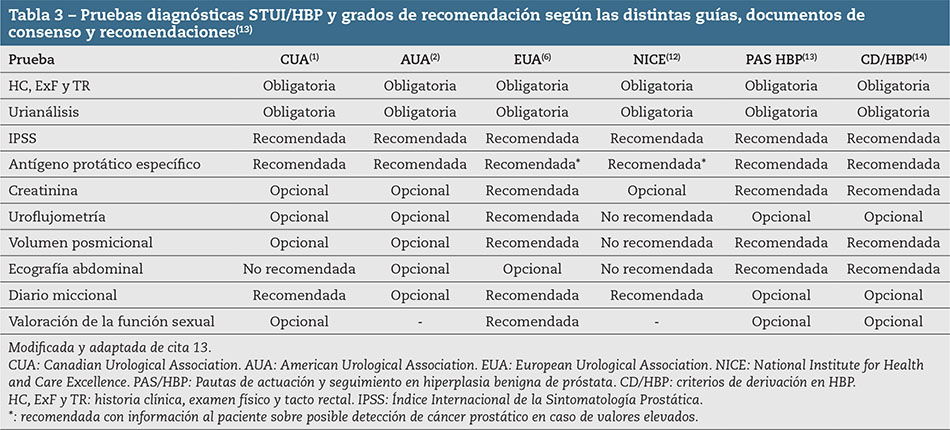
Todas las guías de buena práctica clínica en HBP (13) coinciden en reconocer las siguientes pruebas como obligatorias:
- Anamnesis detallada.
- Examen físico completo, sobre todo abdomino-genital, que incluya la realización del tacto rectal (TR).
- Análisis de orina.
Difieren en la realización de otras exploraciones, porque sus recomendaciones no están dirigidas a Atención Primaria (AP), como se observa en la Tabla 3(13).
En AP el resto de pruebas diagnósticas se pueden clasificar en función de la prioridad en su realización en diferentes categorías (Tabla 4)(13,14):
- Recomendadas: cuando su uso se generaliza a todos los pacientes con STUI al existir suficiente evidencia del beneficio de su empleo.
- Opcionales: su elección dependerá de los resultados obtenidos en las pruebas iniciales recomendadas y del profesional que la solicita.
- No recomendadas: no existe suficiente evidencia de beneficio con su uso rutinario. Se utilizará únicamente en circunstancias especiales o en ensayos clínicos.
En el estudio diagnóstico de la HBP, no se recomiendan pruebas como eco transrectal, cistoscopia, citología, urodinámica, urografía, TC, RMN, etc., al ser todas ellas pruebas útiles en el diagnóstico de patologías generalmente distintas a la HBP(1,3,6,12-14).
Desde la AP se puede diagnosticar la HBP no complicada sin necesidad de utilizar inicialmente en su diagnóstico pruebas de imagen o funcionales(11,13,14). Utilizando las pruebas obligatorias y recomendadas, se obtiene un valor predictivo positivo cercano al 80%(11).
La utilización de las pruebas opcionales dependerá de la accesibilidad a estas y de los resultados que se obtengan en las pruebas obligatorias y recomendadas(13,14).
2.1. Pruebas diagnósticas obligatorias y recomendadas en pacientes con STUI/HBP
2.1.a Anamnesis general y de los STUI (Nivel de evidencia: muy bajo; Grado de recomendación: fuerte a favor)(6)
La historia clínica tiene una gran importancia en la evaluación de la HBP(13,14), puesto que nos permite descartar otras posibles causas de STUI.
En la historia clínica se debe recoger el motivo de la consulta, antecedentes patológicos médicos y quirúrgicos, así como la evolución de la enfermedad actual. Se debe investigar sobre la toma de fármacos que pueden favorecer la presencia de STUI como diuréticos, antimuscarínicos (AM), calcioantagonistas, ansiolíticos, simpaticomiméticos, antihistamínicos, antidepresivos, sedantes/benzodiacepinas u opiáceos(1,6,13,14).
Se debe evaluar la presencia de enfermedades sistémicas que producen síntomas urinarios como la diabetes mellitus (poliuria), insuficiencia cardiaca (nocturia) o la presencia de enfermedades neurológicas que aumentan la sospecha de la presencia de una vejiga neurógena (enfermedad de Parkinson, esclerosis múltiple, accidente cerebrovascular, lesiones medulares, patología de discos intervertebrales lumbosacros) o de una poliuria nocturna(6,13).
Además, es preciso valorar hábitos higiénicos-dietéticos o estilos de vida que pueden favorecer la presencia de STUI (consumo excesivo de líquidos, de cafeína, alcohol o tabaco). Por la frecuente asociación con otros trastornos urológicos, en la valoración inicial de todo paciente con STUI se debe preguntar sobre la presencia de disfunciones sexuales, como la disfunción eréctil (DE) y otras alteraciones de la esfera sexual(1,6,13,14). Asímismo, se debe descartar la presencia de alteraciones de la función vesical (hiperactividad vesical, incontinencia de orina)(13,14).
Se preguntará sobre antecedentes de infecciones de transmisión sexual (ITS)(13,14).
Tras la anamnesis, se remitirá a la consulta especializada en urología a aquellos pacientes que presenten algunas características que requieran ampliar el estudio diagnóstico (Tabla 5)(13,14).
2.1.b Evaluación de la intensidad y afectación de calidad de vida de los STUI (Nivel de evidencia: bajo; Grado de recomendación: fuerte a favor)(6)
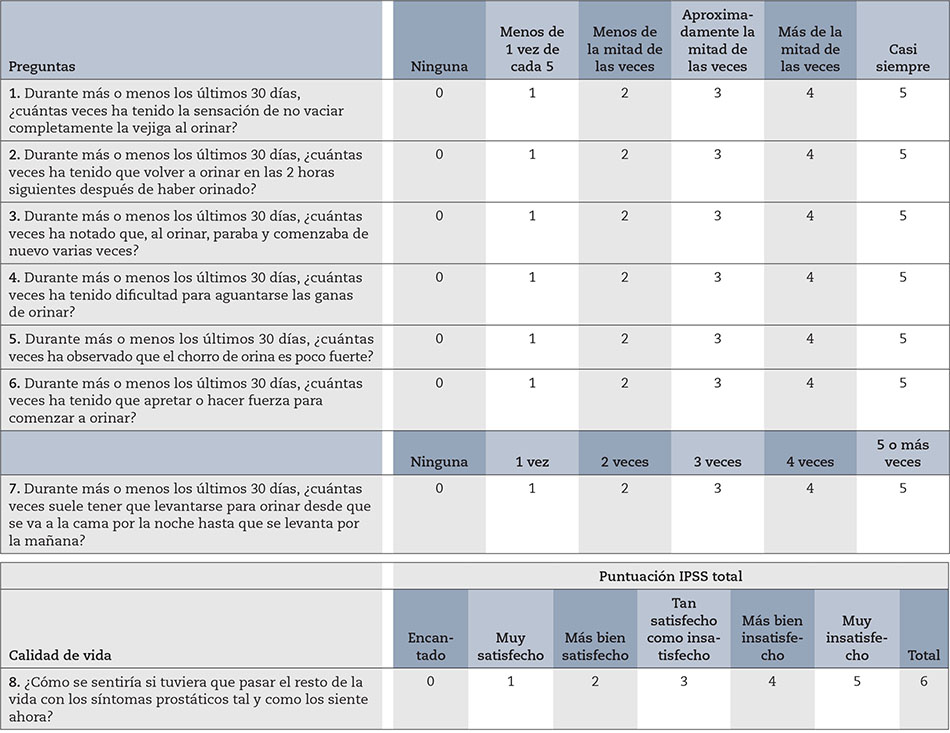
Para la valoración de la intensidad de los STUI, se recomienda la utilización del Cuestionario IPSS (International Prostate Symptoms Score)(6,15,16) (Fig. 1).
Se trata de un cuestionario universalmente utilizado, desarrollado, aprobado y validado en Estados Unidos en el año 1992. Inicialmente se le denominó The American Urological Association Sympton Index(15). Está validado y traducido al castellano(16).
El cuestionario debe ser cumplimentado por el paciente. No es un test diagnóstico de HBP, pero tiene una gran importancia en la valoración diagnóstica inicial, en el tratamiento y en el seguimiento de los pacientes con STUI/HBP.
Los objetivos del IPSS son:
- Cuantificar y objetivar los síntomas subjetivos del paciente.
- Puntuar la afectación en la calidad de vida.
- Monitorizar la progresión de la enfermedad.
- Valorar la respuesta al tratamiento.
El IPSS consta de 7 preguntas con 5 opciones de respuesta, que valoran los diferentes tipos de STUI: de llenado (preguntas 2, 4, 7) de vaciado (preguntas 3, 5, 6) y posmiccionales (pregunta 1): además se adiciona una pregunta 8 sobre la calidad de vida relacionada con los STUI.
Con base en las respuestas, la intensidad de los síntomas se clasifican en:
- Leves: 0-7 puntos.
- Moderados: 8-19 puntos.
- Graves: 20-35 puntos.
Los hombres con síntomas de moderados a graves IPSS > 8 presentan un riesgo tres veces mayor de retención aguda de orina (RAO)(17).
La progresión clínica de la HBP suele asociarse con un empeoramiento de los síntomas (aumento ≥ 4 puntos en el IPSS)(9,13,17).
En los varones en los que el IPSS nos muestre síntomas predominantes de llenado, podría estar indicada la utilización de cuestionarios más específicos orientados para la detección de la VH. En AP pueden ser adecuados cuestionarios de cribado validados al castellano, como el OAB-8 y el OAB-3(18).
2.1.c Exploración física general y abdómino-pélvico-genital, con tacto rectal (TR) (Nivel de evidencia: bajo, muy bajo; Grado de recomendación: fuerte a favor)(6)
La exploración del paciente con STUI debe ser lo más completa posible, especialmente enfocada a identificar signos de patología nefrourológica. Por ello, además de una exploración general, se debe explorar toda el área abdomino-pélvico-genital para descartar: patología renal o ureteral, presencia de globo vesical o masas pélvicas, patologías testiculares o del epidídimo (epididimitis, hidrocele, varicocele y masas induradas), valoración del meato uretral para descubrir posibles obstrucciones al flujo (estenosis, hipospadias) o la presencia de supuraciones del glande, fimosis y la presencia de cáncer de pene(3,6,13,14) (Nivel de evidencia: muy bajo; Grado de recomendación: fuerte).
En la valoración inicial de todos los varones con STUI debe realizarse un TR (Nivel de evidencia: bajo; Grado de recomendación: fuerte)(6). Mediante el TR se valorará la mucosa rectal (masas rectales o anales, fisuras, hemorroides), el tono del esfínter anal, la sensibilidad a la palpación de la próstata (dolorosa en prostatitis y no dolorosa en la HBP), tamaño (agrandado en HBP), la consistencia (pétrea en el carcinoma, blanda en la HBP), los límites (irregular en carcinoma, bien delimitada en HBP) y la movilidad (móvil en HBP, adherida en carcinoma)(19). Cualquier hallazgo sospechoso en la exploración del TR debe remitirse a urología para descartar la presencia de un cáncer de próstata(3,13,14).
Al realizar el tacto y en varones con sospecha de neuropatía/vejiga neurógena, podemos comprobar la integridad neurológica de la metámera S2-4, mediante la valoración del reflejo bulbo-cavernoso (al pellizcar el glande, se contrae el esfínter anal). Este reflejo estará alterado en pacientes con neuropatía sobre todo diabética, que puede generar atonía vesical(13,14).
La próstata normal tiene un tamaño de unos 15-20 cc. Paulatinamente con la edad, y a partir de los 30 años, se presenta un crecimiento histológico progresivo(13,14). Existe relación entre el tamaño de la próstata > 40 cc y la aparición de un aumento del riesgo de complicaciones como RAO y necesidad de tratamiento quirúrgico(6,17).
El TR sobrestima el volumen en las próstatas pequeñas y subestima el volumen en próstatas grandes. Aunque sí que tiene capacidad para discriminar entre próstatas < o > de 50 cc(6,13,14).
2.1.d Urinoanálisis (tira reactiva o sedimento) (Nivel de evidencia: bajo; Grado de recomendación: fuerte a favor)(6)
El objetivo del examen de orina en pacientes con STUI es la realización del diagnóstico diferencial con otras patologías del tracto urinario y para descartar complicaciones(1-3,12-14). Es útil para detectar la presencia de nitritos, glucosuria, leucocituria, hematuria y proteinuria(3,6,12-14). Se realiza mediante una tira reactiva de orina. Es una prueba sencilla, muy sensible, pero poco específica (frecuentes falsos positivos). La presencia de hematuria debe confirmarse mediante sistemático de orina, sedimento y anormales(13,14).
En un paciente con HBP la hematuria suele ser consecuencia de la congestión glandular o de la presencia de otras patologías asociadas, como enfermedad neoplásica o litiasis(1,2,6,13,14). Por este motivo, la presencia de hematuria será indicación de solicitar otras pruebas, sobre todo para descartar un carcinoma vesical(1,6).
La leucocituria puede ser indicativa de infección, por lo que se deberá realizar un urocultivo. Si resultara negativo, solicitaremos una citología de orina para descartar tuberculosis genitourinaria(3,13,14).
2.1.e Función renal (Nivel de evidencia: bajo; Grado de recomendación: fuerte a favor)(6)
La función renal puede estar alterada en el 11% de los pacientes con HBP(6,13). Menos del 1% de los varones con STUI cuyo origen no es neurológico presentan insuficiencia renal (IR)(17). Su presencia obliga a estudios de imagen de IR por HBP (creatinina > 1,5 mg/dl). Es una de las causas de indicación de derivación a urología y tratamiento quirúrgico(13,14).
En los hombres con STUI de predominio de vaciado, la presencia asociada de diabetes mellitus o hipertensión fueron las causas más probables de la elevación de creatinina. Los pacientes con IR tienen un mayor riesgo de desarrollar complicaciones posoperatorias(6).
No existe un consenso generalizado sobre la necesidad de determinar la función renal en los pacientes con STUI(1-3,6,12-14), considerándose en alguna de las recomendaciones como una prueba opcional(1,2,12).
Este comité científico aconseja en los pacientes con STUI el estudio de la función renal mediante la determinación de la creatinina sérica, si se sospecha un proceso obstructivo que genere IR, con base en la anamnesis y el examen físico, ante la presencia de hidronefrosis y ante la posibilidad de un tratamiento quirúrgico(6,13,14). En la actualidad se consideran más indicativos de fallo renal los valores de filtrado glomerular(6,12-14).
2.1.f Antígeno prostático específico (PSA) (Nivel de evidencia: alto; Grado de recomendación: fuerte a favor)(6)
La determinación de PSA en los varones con STUI tiene gran utilidad en la toma de decisiones diagnósticas y terapéuticas. Debe realizarse en la valoración inicial de todos los varones con STUI, pues es un marcador de riesgo de progresión y de complicaciones por la HBP(14). Valores de PSA > 1,4 ng/ml triplican el riesgo de RAO(20). Además, durante el diagnóstico y seguimiento se podría determinar en aquellos varones en los que pueda variar su evolución con el posible diagnóstico de un cáncer de próstata(1,6,12). El paciente debe ser informado de la solicitud de esta prueba.
El PSA es un marcador específico de tejido prostático, no de cáncer. Tiene una baja especificidad, ya que se encuentra elevado en pacientes que presentan otras patologías prostáticas(13), como la HBP y la prostatitis y puede ser normal en pacientes con carcinoma prostático. Existe relación significativa entre el PSA y el volumen prostático(6), remarcando la importancia de este parámetro como eficaz marcador de crecimiento prostático(1,6). El PSA sérico es un predictor más fuerte del crecimiento de la próstata que el volumen de la próstata(6). El valor predictivo positivo (PPV) del PSA para la detección de HBP obstructiva es del 68%(6).
Como umbrales de valores de PSA para detectar volúmenes prostáticos superiores a 30 cc en relación con la edad se proponen estos valores(6,21):
- PSA ≥1,4 ng/ml en hombres con edades comprendidas entre los 50-59 años.
- PSA ≥1,5 ng/ml en hombres con edades comprendidas entre los 60-69 años.
- PSA ≥1,7 ng/ml en hombres con edades de 70 o más años.
Como umbrales de valores de PSA para detectar volúmenes prostáticos superiores a 40 cc en relación con la edad se proponen estos valores (6,21):
- PSA > 1,6 ng/ml, en hombres con edades comprendidas entre los 50-59 años.
- PSA > 2,0 ng/ml, en varones con edades comprendidas entre los 60-69 años.
- PSA > 2,3 ng/ml, para hombres con edades de 70 o más años.
No existe un umbral de PSA que descarte con seguridad la presencia de un cáncer de próstata. Las cifras de PSA consideradas de normalidad, según consenso, varían con la edad. A partir de los 60 años de edad se consideran valores de normalidad un PSA < 4 ng/ml(13), aunque hasta un 25% de los hombres que se diagnostican de cáncer de próstata pueden tener valores de PSA < 4 ng/ml(13,14). Igualmente, un nivel más alto de PSA no confirma la presencia de cáncer(13,14):
- Un tercio de los varones con cifras de PSA entre 4 y 10 ng/ml tienen resultados positivos en la biopsia para cáncer de próstata.
- Más del 25% de los varones con HBP presentan cifras de PSA > 4 ng/ml por el volumen glandular aumentado.
- Los varones de edad avanzada presentan cifras de PSA ligeramente más altas que los hombres más jóvenes(22).
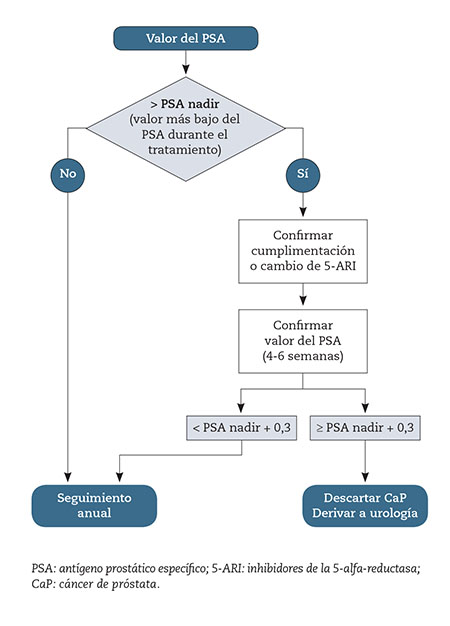
La actuación clínica frente a los niveles de PSA va a depender del valor detectado en la valoración inicial(13,14) (Fig. 2).
Antes de tomar una decisión, cualquier valor > 4 ng/ml debe confirmarse en 4-6 semanas para descartar otras causas de elevación transitoria de PSA (infecciones genitourinarias, retención urinaria, instrumentalización urológica, masaje prostático vigoroso)(13,14).
- Valor de PSA > 10 ng/ml confirmado: obliga a la remisión a urología para la realización de una biopsia guiada por ecografía(13,14).
- Valor PSA entre 4 y 10 ng/ml confirmado: ae aconseja recurrir a otras determinaciones que aumenten la sensibilidad del PSA para el diagnóstico de cáncer de próstata(13,14).
Este comité científico recomienda la determinación de PSA libre y el cálculo del cociente PSA libre/PSA total. Un cociente < 20% es sugestivo de cáncer de próstata y > 20 % de HBP. En el caso de PSA libre < 20%, se recomienda la remisión a urología para valorar la realización de una biopsia(13,14).
En el caso de seguimiento a largo plazo de pacientes con PSA en valores límites, otra variable a tener en cuenta será el valor que aporta la cinética del psa (velocidad de su ascenso anual), de forma que cuando se incremente en más de 1 ng/ml/año será un indicador más de riesgo para derivar el paciente al urólogo para valorar la opción de una biopsia prostática.
No están claros los beneficios del cribado poblacional en pacientes asintomáticos. De manera aislada, el PSA carece de sensibilidad y especificidad suficientes(14).
El valor del PSA es de gran utilidad en varones con STUI/HBP, pues ayuda a predecir la evolución natural de la HBP(1,6,23). Se utiliza para evaluar el riesgo de cirugía relacionado con la HBP o desarrollo de RAO(6).
2.1.g Medición del RPM mediante ecografía abdominal (Nivel de evidencia: bajo; Grado de recomendación: débil a favor)(6)
Un nivel basal elevado de volumen post miccional se asocia con un mayor riesgo de deterioro de los síntomas(6). Los cambios del volumen posmiccional a lo largo del seguimiento permite la identificación de pacientes con riesgo de RAO(6). Por este motivo este comité científico aconseja la determinación basal del residuo posmiccional (RPM) en los pacientes con mayor riesgo de progresión (sintomatología moderada a grave)(14).
Aunque puede valorarse mediante sondaje vesical, la ecografía es el método de elección para la medida semicuantitativa del RPM (24). Se consideran poco significativos los residuos inferiores a 50 ml, y potencialmente patológicos los superiores. Por encima de 100 ml se aconseja al paciente una segunda micción y volver a realizar la exploración(25). La ecografía abdominal es una prueba diagnóstica que facilita la evaluación de la forma de la próstata y del volumen prostático con más precisión que otras exploraciones y nos permite objetivar las repercusiones y anomalías que se generan sobre el tracto urinario inducidas por la HBP(25,26). Por este motivo, además de para medir el RPM, este comité recomienda la realización de ecografía abdominal en pacientes con STUI/HBP en los que se sospeche la presencia de complicaciones (Tabla 6)(13,14).
Además, es una exploración que sirve para determinar con mayor exactitud que el TR el volumen prostático en paciente con STUI/HBP. Por este motivo este comité científico aconseja su utilización con este fin en pacientes en los que el volumen prostático tenga unas implicaciones terapéuticas (STUI moderados a graves)(14).
2.2. Pruebas diagnósticas opcionales en pacientes con STUI/HBP
2.2. a. Flujometría (Nivel de evidencia: moderado; Grado de recomendación: débil a favor)(6)
Es una prueba urodinámica no invasiva utilizada para evaluar el funcionamiento del tracto urinario inferior mediante la cuantificación del flujo urinario máximo (Qmax). Para su medición se requiere un volumen miccional superior a 150 ml e inferior a 500 ml. La precisión diagnóstica (sensibilidad y especificidad) sobre la obstrucción del tracto urinario inferior varía en función del valor del Qmax. Se consideran cifras normales valores ≥ 15 ml/seg de Qmax. Un valor de Qmax < 10 ml/seg es indicativo de obstrucción.
Valores comprendidos entre 15-10 ml/seg son sugestivos de obstrucción. Qmax < 12 ml/seg aumenta el riesgo de padecer una RAO por cuatro (17). No obstante, estos valores pueden ser normales en varones mayores de 70 años de edad. Esta prueba no distingue entre obstrucción orgánica producida por HBP y disfunción del detrusor(14). Por lo tanto, está limitada como prueba de diagnóstico, ya que no puede discriminar entre los distintos mecanismos subyacentes.
Además del Qmax, hay otros parámetros que mejoran la especificidad de la prueba como los valores de tiempo de flujo, tiempo de vaciado y flujo medio, así como la morfología de la curva flujo-volumen, que es distinta para cada patología(13). Es una prueba poco accesible a los médicos de AP, que aporta gran información sin ninguna yatrogenia(14). Tiene utilidad en la correlación de los síntomas con los hallazgos objetivos de obstrucción, especialmente cuando hay discordancia y para el seguimiento de los resultados del tratamiento(6). No obstante, la información que aporta se puede obtener de forma indirecta mediante la cuantificación del RPM(14). La no accesibilidad desde AP a la flujometría no debe ser impedimento para su implicación en el diagnóstico y tratamiento de los pacientes con STUI/HBP(14).
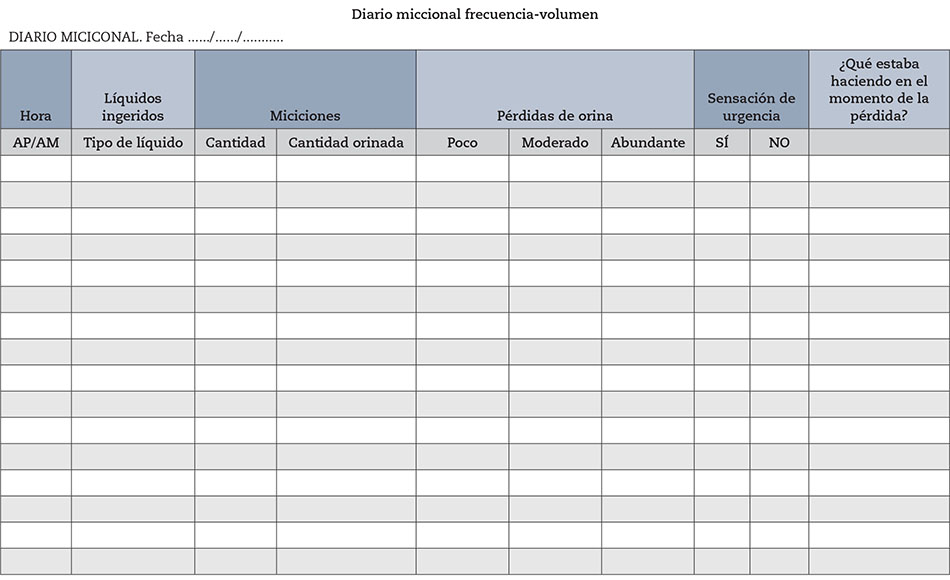
2.2.b Hábitos miccionales y de ingesta de líquidos: diario miccional (Nivel de evidencia: bajo; Grado de recomendación: fuerte a favor)(6)
Es una prueba opcional en la valoración de los STUI sugestivos de HBP(1,14). Útil sobre todo en pacientes con nocturia, en pacientes en los que predominen los STUI de llenado y en pacientes con pérdida involuntaria de orina (6,13). Si se estima oportuno, debe evaluarse mediante diario miccional (gráfico de frecuencia–volumen) (Fig. 3).
Se monitorizan durante 3 a 7 días la ingesta de líquidos, número de micciones, etc. (Nivel de evidencia: moderado; Grado de recomendación: fuerte)(6).
Figura 3 – Diario miccional. Gráfico de frecuencia-volumen
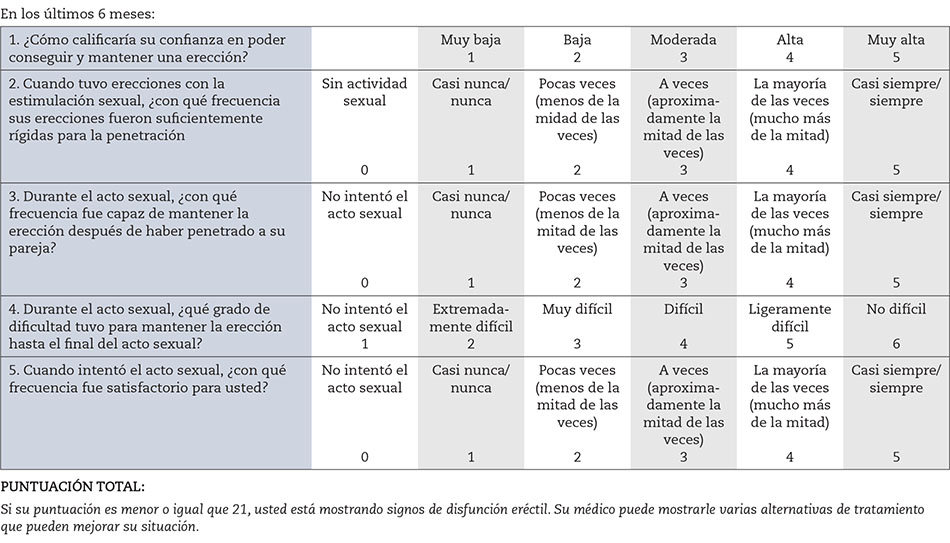
2.2.c Valoración de la función eréctil(1,6,13) (Nivel de evidencia: muy bajo; Grado de recomendación: débil a favor)
Diferentes estudios muestran que existe una fuerte asociación entre los STUI y la disfunción eréctil (DE)(27). En el estudio Multinational Survey of the Aging Male (MSAM 7), que utiliza el Índice Internacional de Función Eréctil (IIFE), se comprobó una relación directa de la DE con la gravedad de los STUI, independientemente de la edad (28).
En varones afectos de HBP que en la anamnesis refieran algún grado de DE, aconsejamos que esta sea evaluada con el cuestionario SHIM (Fig. 4). Se trata de un cuestionario abreviado del IIFE(29). Consta de 5 preguntas en las que se valoran distintos aspectos de la erección, se puntúa cada respuesta de 0 a 5. Se considera alterada la erección si la puntuación es < 22.
Tras la valoración diagnóstica de los varones con STUI secundarios a HBP, derivaremos a urología, para ampliar su estudio, si presenta alguna de estas características recogidas en la Tabla 7(14).
Bibliografía
- Nickel JC, Aaron L, Barkin J, Elterman D, Nachabé M, Zorn K. Canadian Urological Association guideline on male lower urinary tract symptoms/benign prostatic hyperplasia (MLUTS/BPH): 2018 update. Can Urol Assoc J. 2018; 12: 303-12.
- McVary KT, Roehrborn CG, Avins AL, Barry MJ, Bruskewitz RC, Donnell RF, et al. American Urological Association guideline: Management of benign prostatic hyperplasia (BPH). Published 2010; reviewed and validity confirmed 2014. Disponible en: https://www.auanet.org/guidelines/benign-prostatic-hyperplasia-(bph)-guideline/benign-prostatic-hyperplasia-(2010-reviewed-and-validity-confirmed-2014) [Acceso mayo 2019].
- Brenes Bermúdez FJ, Pérez León N, Pimienta Escrihuela M, Dios Diz, JM. Recomendaciones de buena práctica clínica en: Hiperplasia benigna de próstata. Abordaje por el médico de Atención Primaria. SEMERGEN. 2007; 33: 529-39.
- Abrams P. New words for old: Lower urinary tract symptoms for “prostatism”. BMJ. 1994; 308: 929-30.
- Abrams P, Chapple C, Khoury S et al: Evaluation and treatment of lower urinary tract symptoms in older men. J Urol. 2009; 181: 1779.
- Gravas S, Cornu JN, Gacci M, Gratzke C, Herrmann TRW, Mamoulakis C, et al. Guidelines on the management of male lower urinary tract symptoms (LUTS), incl. benign prostatic obstruction (BPO). European Association of Urology. Actualization 2019. Disponible en: http://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts
- Abrams P, Cardozo L, Fall M, Griffiths D, Rosier P, Ulmsten U, et al. The standardisation of terminology of lower urinary tract tract function: report of standarisation Subcommittee of the International continente Society. Neurourol Urodyn. 2002; 21: 167-78.
- Sexton CC, Coyne KS, Kopp ZS, Irwin DE, Milsom I, Aiyer LP, et al. The overlap of storage, voiding and post-micturiction symptoms and implications for treatment seeking in the USA, UK and Sweden: EpiLUTS. BJU Int. 2009; 103(Suppl 3): 12-23.
- McVary K. BPH: epidemiology and comorbidities. Am J Manag Care. 2006; 12(5 Suppl): S122.
- Chapple CR, Wein AJ, Abrams P, Dmochowski RR, Giuliano F, Kaplan SA, et al. Lower urinary tract symptoms revisited: a broader clinical perspective. Eur Urol. 2008; 54: 563-9.
- Carballido J, Fourcade R, Pagliarulo A, Brenes F, Boye A, Sessa A, et al. Can benign prostatic hyperplasia be identified in the primary care setting using only simple tests? Results of the Diagnosis Improvement in Primary Care Trial. Int J Clin Pract. 2011; 65: 989-96.
- NICE Guidelines. Lower urinary tract symptoms in men. Review 2015. [Publicación en línea]. National Institute for Health and Care Excellence, Published September 2013. Disponible en: http://www.nice.org.uk/guidance/conditions-and-diseases/urological-conditions/lower-urinary-tract-symptoms [Consultado 1 de junio de 2019]
- Brenes FJ, Carballido J, Cozar JM, Fernández-Pro A, Hernández C, Miñana B, et al. Pautas de actuación y seguimiento en: hiperplasia prostática benigna. Madrid: ffOMC, Ministerio de Sanidad Servicios Sociales e Igualdad; 2017.
- Brenes FJ, Brotons F, Castiñeiras J, Cozar JM, Fernández-Pro A, Martín JA, et al. Criterios de derivación en hiperplasia benigna de próstata para Atención Primaria. 3ª ed. Madrid: Undergraf; 2015.
- Barry M, Fouler FJ Jr, O’Leary MP, Brustewitz RC, Holtgrewe HL, Mebust WK, et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. J Urol. 1992; 148: 1549-57.
- Badía X, García-Losa M, Dal-Ré R. Ten-language translation and harmonization of International Prostate Symptom Score: developing a methodology for multinacional clinical trials. Eur Urol. 1997; 31: 129-40.
- McConnell JD, Roehrborn CG, Bautista OM, Andriole GL Jr, Dixon CM, Kusek JW, et al. The long-term effect of doxazosin, finasterida, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349: 2387-98.
- Brenes FJ, Angulo JC, Ochayta D, Rejas J, Arumí D, Cañadas A, et al. Validación psicométrica de las escalas OAB-V8 y OAB-V3 para la detección de pacientes con probable vejiga hiperactiva en la población española. Med Clin (Barc). 2014; 143: 521-9.
- Bosch JL, Bohnen AM, Groeneveld FP. Validity of digital rectal examination and serum prostate specific antigen in the estimation of prostate volume in community-based men aged 50 to 78 years: the Krimpen Study. Eur Urol. 2004; 46: 753-9.
- Emberton M, Cornel E, Bassi P, Fourcade R, Gómez M, Castro R. Benign prostatic hyperplasia as a progressive disease: A guide to the risk factors and options for medical management. Int J Clin Pract. 2008; 62: 1076-86.
- Speakman M, Batista J, Berges R. Integrating risk profiles for disease progression in the treatment choice for patients with LUTS/BPH. Prostate Cancer Prostatic Dis. 2005; 8: 369-74.
- Oesterling JE, Jacobsen SJ, Chute CG, Guess HA, Girman CJ, Panser LA, et al. Serum prostate-specific antigen in community-based population of healthy men: Establishment of age-specific reference ranges. JAMA. 1993; 270: 860-4.
- Levitt JM, Slawin KM. PSA and PSA derivatives as predictors of BPH progression. Curr Urol Rep. 2007; 8: 269-74.
- Marks LS, Roehrborn CG, Wolford E, Wilson TH. The effect of Dutasterida on the peripheral and transition zones of the prostate and the value of the transition zone index in predicting treatment response. J Urol. 2007; 177: 1408-13.
- García Navas R, Sanz Mayayo E, Arias Fúnez F, Rodríguez-Patrón E, Mayayo Dehesa T. Diagnóstico y seguimiento de la hipertrofia benigna de próstata mediante ecografía. Arch Esp Urol. 2006; 59: 353-60.
- Bright E, Oelke M, Tubaro A, Abrams P. Ultrasound estimated bladder weight and measurement of bladder wall thickness – useful non invasive methods for assessing the lower urinary tract? J Urol. 2010; 184: 1847-54.
- López-Fando L, Allona A, Bueno C, Cordona L. Sintomatología del tracto urinario inferior y disfunción eréctil. Arch Esp Urol. 2010; 63: 655-62.
- Rosen R, Altwein J, Boyle P. Lower urinary tract symptoms and male sexual dysfunction: the multinational survey of the aging male (MSAM-7). Eur Urol. 2003; 44: 637-49.
- Rosen RC, Riley A, Wagner G, Osterloh IH, Kirkpatrick J, Mishra A. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology. 1997; 49: 822-30.
Tratamiento farmacológico de los STUI/HBP
La HBP es una enfermedad progresiva(1). A largo plazo, la mayoría de las HBP no tratadas van a progresar clínicamente con deterioro de los síntomas, empeoramiento de la calidad de vida y aumento de la incidencia de complicaciones (disfunción vesical irreversible, insuficiencia renal, infecciones recurrentes, litiasis, hematuria, RAO) y la necesidad de cirugía por el empeoramiento clínico de la enfermedad. El sustrato histológico de esta progresión es el aumento del volumen prostático, del grado de obstrucción con deterioro de la velocidad del flujo urinario y del residuo posmiccional(2,3).
Los objetivos del tratamiento de los varones con STUI/HBP son: mejorar los síntomas, la calidad de vida y la satisfacción del paciente, evitar la progresión clínica de la enfermedad y disminuir el riesgo de complicaciones o la necesidad de cirugía por la enfermedad(4-6).
Las decisiones terapéuticas y pautas de tratamiento deben estar basadas en la evidencia científica disponible, tener en cuenta la expectativa de vida, los potenciales efectos adversos de los tratamientos, la presencia de comorbilidades que pueden contraindicar alguna de las opciones terapéuticas y la decisión del propio paciente. Al disponer de diferentes alternativas eficaces, la decisión terapéutica debe ser compartida con el paciente, tras una correcta información sobre los posibles beneficios y riesgos de cada tratamiento.
Las opciones de manejo de los STUI/HBP disponibles en la actualidad son:
- Espera vigilante con cambios activos del estilo de vida y supervisión clínica periódica.
- Tratamiento farmacológico.
- Tratamiento quirúrgico.
1. Espera vigilada con cambios en estilo de vida y medidas higiénicos-dietéticas
Los pacientes asintomáticos o con síntomas leves, con buena calidad de vida y sin un aumento del tamaño de la próstata, no son susceptibles de tratamiento farmacológico. Se recomienda realizar una vigilancia activa periódica (Nivel de evidencia: alto; Grado de recomendación: fuerte a favor). El 85% de estos varones permanecerá estable al año y aproximadamente un 65% presentarán un empeoramiento clínico progresivo a los 5 años(4).
En este grupo de pacientes se puede prevenir o retrasar la aparición de los síntomas realizando cambios del estilo de vida y reforzando una serie las medidas higiénico-dietéticas(7). Factores como la obesidad, síndrome metabólico, diabetes o la inactividad física, aumentan el riesgo de progresión/empeoramiento de los STUI/HBP. En los pacientes asintomáticos o con síntomas leves o poco molestos, la implementación de una serie de medidas higiénico-dietéticas han demostrado ser efectivas reducir los síntomas y la progresión de los STUI(8-10) (Tabla 1) (Nivel de evidencia: alto; Grado de recomendación: fuerte).
Los consejos al paciente deben impartirse dentro del contexto de una actividad programada de educación e información sanitaria. Se ha demostrado que las intervenciones educativas en pacientes con STUI mejoran los síntomas y la calidad de vida en hombres que recibieron tres sesiones de autocontrol, además de la atención estándar, frente a hombres que recibieron únicamente los cuidados estándar en visita anual(8). Así, la autogestión como parte de la vigilancia expectante reduce los síntomas y la progresión(4)(Nivel de evidencia: alto)(4).
Se debe ofrecer a todos los varones con STUI leves y moderados la vigilancia expectante, así como consejos sobre el estilo de vida antes o junto con el tratamiento farmacológico (Grado de recomendación: fuerte a favor)(4).
Los pacientes asintomáticos con próstata aumentada de tamaño podrían beneficiarse del tratamiento farmacológico, como lo demuestra un análisis post hoc del estudio REDUCE, que demostró un beneficio con Dutasteride frente al placebo en el riesgo de progresión clínica y la aparición de complicaciones en varones asintomáticos o levemente sintomáticos con una próstata agrandada (volumen > 40 ml e IPPS < 8)(11). Se precisan más estudios para confirmar este efecto clínico en este tipo de pacientes y un análisis de la eficiencia de la actuación.
2. Tratamiento farmacológico
El tratamiento farmacológico está indicado en pacientes con síntomas de intensidad moderada a grave que repercuten en la calidad de vida, en ausencia de complicaciones y sin una indicación absoluta de cirugía (Nivel de evidencia: alto; Grado de recomendación: fuerte a favor).
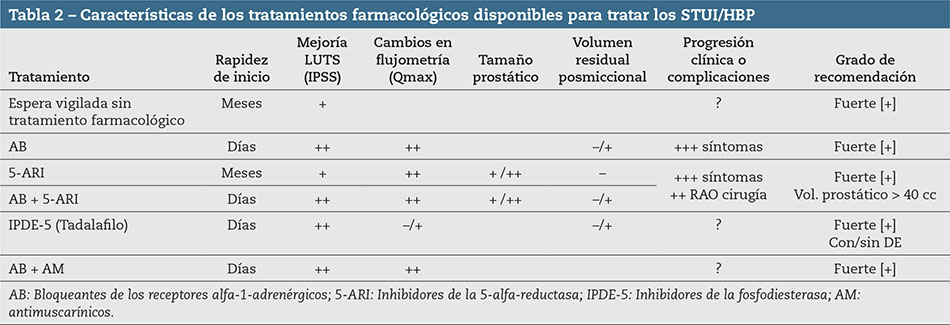
Existen diferentes fármacos autorizados para el tratamiento de los varones con STUI/HBP con eficacia comprobada tanto en monoterapia como en combinación: bloqueantes de los receptores alfa 1-adrenérgicos (AB), inhibidores de la 5-alfa-reductasa (5-ARIs), inhibidores de fosofodiesterasa 5 (IPDE-5), antimuscarínicos (AM)(4-6) (Tabla 2).
2.1 Agentes fitoterapéuticos
Cerca de 30 compuestos fitoterapéuticos han sido utilizados tradicionalmente para el tratamiento de STUI/HBP. La Serenoa repens (extracto del fruto de la palma sierra americana) y Pygeum africanum (extracto de la corteza del ciruelo africano) han sido los más utilizadas(12). También se han utilizado la ortiga blanca (Urtica dioica), los extractos de polen de centeno (Secale cereale), la hierba estrellada de Sudáfrica (raíz de Hypoxis rooperi) o un extracto de la extracto de semilla de calabaza (Cucurbita pepo)(4,5,12). Hay preparaciones de una sola planta (mono preparaciones) y preparaciones que combinan dos o más plantas en una píldora (preparaciones de combinación). Los efectos in vivo de estos compuestos son inciertos, y los mecanismos precisos de los extractos de plantas siguen sin estar claros.
Aunque estos preparados están autorizados para el tratamiento de los STUI/HBP, sigue existiendo gran controversia sobre su eficacia clínica y un desconocimiento sobre su mecanismo de acción. Se trata de un grupo heterogéneo de preparados, con una gran variabilidad en la composición, presentaciones y concentraciones. Además, los efectos biológicos o clínicos de una marca no pueden ser extrapolables a otro extracto de la misma planta de otra marca(13).
Revisiones sistemáticas de estudios conjuntos de distintos principios muestran una falta de consistencia y diseños cuestionables de la mayoría de los estudios (corta duración, escaso número de pacientes, variables clínicas no estandarizadas), y dificultan la interpretación de su utilidad clínica a partir de los resultados(12,14).
Sin embargo, estudios publicados con distintos principios por separado y mejores criterios de calidad metodológica han mostrado resultados que oscilan desde una eficacia moderada, similar a placebo, hasta una mejoría significativa en el control de los síntomas (nocturia) y medidas del flujo urinario, frente al placebo, similares a tamsulosina(13-16). En ningún estudio los agentes fitoterapéuticos han demostrado reducir significativamente el tamaño de próstata, la obstrucción del tracto urinario inferior o modificar la progresión de la enfermedad(17).
En relación con serenoa repens, una revisión sistemática actualizada en 2012 en la que se evaluó el efecto de la Serenoa repens en el tratamiento de los STUI/HBP, los resultados de los estudios realizados entre 4 y 72 semanas mostraron que Serenoa no fue superior a placebo para el tratamiento de los STUI/HBP, en la comparación de la mejoría de la puntuación del IPSS, nocturia, comparación del flujo urinario máximo o en reducción del tamaño de la próstata(13). Los eventos adversos de los extractos de Serenoa repens fueron pocos y leves, y las incidencias no fueron estadísticamente significativas frente a placebo. El análisis agrupado de ensayos con el extracto hexánico lipidoesterólico (HESr, Permixon®) a corto plazo mostró una reducción de la nocturia. Posteriormente se han publicado dos metaanálisis sobre la eficacia del extracto hexánico de Serenoa repens (HESr). En uno de ellos, HESr disminuyó los episodios de nocturia y Qmax en comparación al placebo y tuvo una eficacia en el alivio de STUI/HBP similar a la tamsulosina y la finasterida a corto plazo, con un perfil de seguridad favorable con un impacto muy limitado en la función sexual(18). En el segundo, con ECA y estudios observacionales disponibles hasta marzo de 2017, los extractos de HESr, en una dosis de 320 mg diarios, redujeron la nocturia y mejoró el Qmax en comparación con el placebo y tuvo una eficacia similar a la tamsulosina y al 5-ARI a corto plazo para aliviar los STUI, con un perfil de seguridad favorable, sin afectar negativamente la función sexual. Además, el HESr (Permixon®) parecía ser una opción terapéutica eficaz y bien tolerada para el tratamiento médico a largo plazo de STUI/BPH(19).
En una revisión de 18 estudios que incluyeron un total de 1.562 pacientes con STUI/HBP tratados con diferentes extractos estandarizados de Pygeum africanum frente a placebo y otros tratamientos, se concluyó cierta utilidad de los extractos en cuanto a la mejoría de los síntomas y de algunas variables urodinámicas frente a placebo. No obstante, estas conclusiones no pueden ser extrapoladas a la población por las limitaciones de los estudios (tamaño pequeño, dosis y preparaciones diferentes, y raramente informaron resultados de eficacia usando medidas validadas estandarizadas)(15). Estas revisiones no se han actualizado en más de 15 años, y su calidad de la evidencia es limitada debido al pequeño tamaño de las muestras, los seguimientos cortos, el uso de dosis y preparaciones variadas y la falta de uso de los resultados de los pacientes que utilizan medidas estandarizadas.
Los efectos adversos de la fitoterapia son generalmente leves, comparables a placebo. Los más frecuentes fueron las alteraciones gastrointestinales(13).
En el momento actual no existen suficientes datos para poder realizar una recomendación sólida a favor del uso de los extractos de fitoterapia como un tratamiento específico de los STUI/HBP. Se precisan nuevos estudios en el futuro de cada clase de extractos por separado, incluso de las preparaciones comerciales de forma individualizada, con un diseño adecuado y una duración suficiente, para conocer los posibles de los productos.
2.2 Bloqueantes de los receptores alfa-1-adrenérgicos (AB)
Son fármacos que actúan sobre el componente dinámico de la obstrucción al flujo de salida de la orina en HBP. Existen diferentes subtipos de receptores alfa-1 (A, B, D) que se distribuyen desigualmente en el organismo. Los receptores alfa-1A predominan en la próstata (98%). En la vejiga predomina subtipo alfa-1D. Los receptores alfa-1A se expresan en el cuello vesical, trígono y en el estroma y uretra prostática (solo contiene receptores alfa-1A), aumentando la resistencia de la salida de la vejiga. Los receptores alfa-1 se expresan de forma deficiente y desempeñan un papel funcional limitado en el detrusor vesical. Además, alfa-1A se expresan también en el hígado, el corazón, el cerebelo y el córtex cerebral. El subtipo alfa-1B es más frecuente a nivel del músculo liso vascular, corazón, bazo, riñón y tejido pulmonar. Los alfa-1A, alfa-1B y alfa-1D participan en la dilatación de los vasos sanguíneos(20).
Por lo tanto, los receptores alfa-1A tienen un papel importante en la contracción del cuello vesical, la uretra y la próstata. Su bloqueo reduce el tono de la musculatura lisa del cuello vesical y en menor medida de la próstata, y disminuyen la resistencia de la uretra prostática a la salida de la orina, sin afectar al músculo detrusor de la pared vesical(21).
Los AB disponibles actualmente son: clorhidrato de alfuzosina (alfuzosina), mesilato de doxazosina (doxazosina), silodosina, clorhidrato de tamsulosina (tamsulosina), clorhidrato de terazosina (terazosina) y naftopidil (no comercializado en España). Muestran diferente afinidad por los receptoras alfa-1-terazosina; doxazosina y alfuzosina son menos selectivos al actuar sobre los receptores alfa-1A, 1B, y 1D. Naftopidil presenta afinidad tres veces mayor para alfa-1A que para el subtipo alfa-1D. Tamsulosina con una selectividad predominante sobre los receptores alfa-1A y 1D y silodosina, antagonista muy potente y selectivo de los receptores adrenérgicos alfa-1A, son considerados los más uroselectivos(21).
Son fármacos de primera línea en el tratamiento de STUI/HBP al mejorar los STUI de forma significativa y precoz (desde la 1.ª semana). Reducen 3-7 puntos del IPSS (30-50% frente al 10-20% del placebo), 1-1,5 puntos del cuestionario de calidad de vida y aumentan 1,4-3,2 ml/seg el flujo urinario máximo (20-25% frente al 10-15% del placebo) con disminución del volumen residual posmiccional(21-26). La eficacia máxima se alcanza entre el primer y tercer mes, pero una mejoría significativa de los síntomas frente a placebo puede ocurrir en cuestión de horas o días. La mejoría porcentual del IPPS es similar con independencia de la gravedad. En general, la eficacia no depende del tamaño de la próstata y es similar en todos los grupos de edad. Silodosina ha demostrado ser efectiva y segura para mejorar la nocturia, reduciendo significativamente los episodios(27). Esta mejoría específica sobre la nocturia no se ha demostrado hasta el momento con la tamsulosina(28). El naftopidil parece tener efectos similares en las puntuaciones de los STUI y la Cdv en comparación con la tamsulosina y la silodosina(29). Frente a los 5-ARI, la efectividad clínica a largo plazo es mayor ante volúmenes prostáticos < 40 ml en todos los grupos de edad(4,6,17). Su eficacia clínica se mantiene a largo plazo (4-5 años), evitando la progresión clínica(30-32). No modifican las cifras de PSA, ni el volumen prostático y tampoco reducen el riesgo de retención aguda de orina (RAO) o la necesidad de cirugía a largo plazo(30-32).
La eficacia clínica global de todos los AB es muy similar(33). La mayor o menor uroselectividad y sus perfiles farmacocinéticos determinan algunas diferencias en términos de tolerabilidad y perfil de seguridad. Aunque en general son bien tolerados, en pacientes añosos, solo un tercio continúan con el tratamiento al año del inicio, con tasas ligeramente mayores para los más uroselectivos(17,22,33-35). La clasificación LUTS-FORTA (Fit fOR The Aged) tiene como objetivo la revisión sistemática y clasificación de los fármacos en apropiados e inapropiados para el tratamiento de los LUTS, en pacientes de edad avanzada, en función de la eficacia, seguridad y tolerabilidad (Tabla 3), y establece para tamsulosina y silodosina la clasificación C (cuidado) y para el resto de AB, terazosina, doxazosina y alfuzosina, clasificación D (evitar)(36).
Los principales efectos secundarios son los cardiovasculares (hipotensión postural, mareos, palpitaciones, edema periférico, síncope), sobre el sistema nervioso central (fatiga, astenia, cefalea, somnolencia), rinitis y trastornos eyaculatorios (Tabla 4) (4,6,21-26). La alfuzosina, la terazosina y la doxazosina mostraron un mayor riesgo estadísticamente significativo de desarrollar efectos cardiovasculares en comparación con el placebo (Nivel de evidencia: alto). Los uroselectivos son en general mejor tolerados al presentar menos efectos cardiovasculares. Los menos uroselectivos deberían administrarse en dosis nocturnas, titulando la dosis. Todos deben evitarse si existen antecedentes de hipotensión ortostática. Terazosina y doxazosina están contraindicados en el uso conjunto con IPDE-5 y el resto deberían usarse con precaución. No obstante, la asociación entre tadalafilo con silodosina o tamsulosina ha mostrado ser eficaz y segura para pacientes con LUTS/HBP resistentes a la monoterapia con AB, mejorando fundamentalmente los síntomas de llenado(37,38). En relación con los efectos sobre la función sexual, los AB pueden causar eyaculación anormal, no afectan negativamente a libido y tienen un pequeño efecto beneficioso sobre la función eréctil(39,40). La disfunción eyaculatoria es significativamente más común con los AB que con el placebo y es probablemente mayor con silodosina que con el resto de AB (tamsulosina, naftopidil y alfuzosina) (Nivel de evidencia: alto)(40-42). El naftopidil causa eventos adversos sexuales similares a la tamsulosina, pero menos que con la silodosina (29). Doxazosina y terazosina se relacionan con un bajo riesgo de disfunción eyaculatoria. Originalmente, se pensaba que la eyaculación anormal era retrógrada (aneyaculación o eyaculación retrógrada), pero los datos más recientes demuestran que se debe a una disminución o ausencia de líquido seminal durante la eyaculación, y la edad temprana sería un factor de riesgo aparente(40).
Los AB, especialmente tamsulosina, alfuzosina y doxazosina, aumentan el riesgo de complicaciones quirúrgicas, durante la facoemulsificación de la catarata, derivadas del síndrome del iris flácido intraoperatorio (IFIS) (Nivel de evidencia: alto)(43,44). El IFIS ocurre en el 2% de las cirugías de cataratas y se relaciona con un mayor riesgo de complicaciones quirúrgicas. Aunque la duración de la interrupción del tratamiento aún no está claramente establecida, se recomienda suspender la medicación (o posponer su inicio), al menos 2 semanas antes de la intervención y reiniciarlo posteriormente, cuando ya no conlleve ningún riesgo(31).
La elección del AB debe individualizarse en función de la edad, comorbilidad del paciente (especialmente la cardiovascular), expectativas respecto a la función sexual, efectos secundarios, seguridad, rapidez de acción y la tolerancia.
Los AB, preferentemente uroselectivos y de acción prolongada, son fármacos de primera línea en pacientes con STUI/HBP moderada a grave y próstatas de menor tamaño (< 40 cc). Además, son útiles para el uso intermitente en pacientes con intensidad fluctuante de los síntomas que no necesitan tratamiento a largo plazo (Nivel de evidencia: alto; Grado de recomendación: fuerte a favor).
2.3 Inhibidores de la 5-alfa-reductasa (5-ARI)
El desarrollo normal de la próstata, así como la progresión de la HBP, se produce bajo la influencia de la 5-alfa-dihidrotestosterona (DHT). En las células prostáticas la DHT estimula la proliferación y diferenciación de las células prostáticas y estromales y propicia el crecimiento glandular. La conversión de testosterona a DHT ocurre por la enzima 5-alfa reductasa. En el ser humano existen 2 isoenzimas de 5-alfa-reductasa distintas. La de tipo I está presente en piel y la de tipo II, presente en próstata, vesículas seminales, epidídimo, folículos capilares, hígado(45).
Finasteride y dutasteride son inhibidores selectivos, competitivos e irreversibles de la 5-alfa reductasa. Dutasteride inhibe las isoenzimas 1 y 2 y el finasterida solo el tipo 2(46,47). Ambos reducen la DHT, principalmente a nivel intraprostático. En el suero dutasteride reduce los niveles medios de DHT en suero después de 24 semanas de tratamiento en un 95% frente a un 71%, respectivamente(46,47). Se desconoce la importancia en la clínica de estas características diferenciadoras de dutasteride y finasteride.
La inhibición de DHT por 5-ARI reduce además los niveles del PSA sérico en aproximadamente un 50% entre 6-12 meses después de inicir el tratamiento. El porcentaje de PSA libre no experimenta un cambio significativo(48).
Actúan sobre el crecimiento glandular, reduciendo a largo plazo (2-4 años) un 18-28% el volumen prostático, y mejorando el componente obstructivo estático al flujo de salida vesical de la HBP(46,49). En tratamientos superiores a un año, esta reducción del volumen próstático, minimiza el riesgo de progresión sintomática de la HBP y aproximadamente un 50% el riesgo de complicaciones, como la retención aguda de orina (RAO) y la necesidad de intervención quirúrgica por la HBP(30,31,46,49-54).
Varios estudios doble ciego controlados con placebo han demostrado la utilidad de finasteride y dutasteride en monoterapia para tratar los STUI/HPB(49-54). En varones con STUI/HBP, los 5-ARI mejoran de forma significativa frente a placebo el IPSS (15-30%), la calidad de vida y la Qmax (entre 1,9-2,2 ml/seg) (30,31,46,49-54). Los efectos clínicos sobre los STUI son perceptibles a los 6-12 meses después del inicio. El máximo beneficio se obtiene a partir del año(30,31). Los resultados clínicos y flujométricos son similares a los AB e incluso muestran cierta superioridad a partir de los 2 años de tratamiento(47,51,52). Además, a largo plazo (más de 4 años), reducen aproximadamente ¼ el volumen prostático en comparación con el valor inicial y se asocian a una reducción significativa del riesgo de progresión de la HPB (RAO riesgo de cirugía, ≥ 4 puntos de aumento en la AUASI/IPSS)(46,50-54).
No existen pruebas suficientes para sugerir que existe una ventaja en eficacia o seguridad de uno sobre el otro en términos de resultados clínicamente importantes. En una revisión de ensayos controlados aleatorios, ensayos cuasialeatorios y revisiones sistemáticas que compararon finasteride con dutasteride, tanto en monoterapia como en combinación con AB para el tratamiento de varones con HBP, no existieron diferencias significativas en ninguno de los resultados clínicamente importantes examinados (episodios de RAO, necesidad de cirugía relacionada con la HBP, retirada por eventos adversos, número de pacientes que experimentaron eventos adversos graves, mortalidad o disfunción sexual) (Tabla 5)(55). No obstante, los efectos clínicos, uroflujométricos y el descenso de PSA son más precoces con dutasteride (al tercer mes). Dutasterida puede reducir IPSS, el volumen prostático, el riesgo de RAO y aumentar el flujo urinario en pacientes con volúmenes prostáticos 30 y 40 cc al inicio del estudio(56,57). Finasteride no parece ser más eficaz que el placebo para reducir STUI en pacientes con próstatas < 40 cc(30,50,57).
En general, los 5-ARIs son bien tolerados. La tasa de retirada del tratamiento debido a efectos secundarios del finasteride en diferentes estudios es similar a los grupos placebo, 11,5% frente a 10,9% para finasteride(34) y 9% en ambos grupos para dutasteride(48). Según la clasificación LUTS-FORTA que evalúa la eficacia, seguridad y tolerabilidad de los fármacos utilizados en personas mayores para el tratamiento de STUI, dutasteride y finasteride están asignados al grupo B (beneficioso) (Tabla 3)(36). La incidencia de eventos adversos es baja y similar en ambos fármacos, especialmente en la esfera sexual (Tabla 5) y disminuyen a largo plazo, excepto para la ginecomastia, cuya tasa de incidencia permanece relativamente constante (1,3% en el año 1 y 2, 1,8% en el año 3 y 0,7% en el año 4 para dutasteride)(30,31,36). Los 5-ARI aumentan el riesgo de disfunción sexual en varones con HBP. Los riesgos relativos agrupados de disfunción sexual en varones con HBP se sitúan de 2,56 (IC del 95% = 1,48-4,42), 1,55 (IC 95% = 1,14-2,12) para DE y 1.69 (95% CI = 1,03-2,79) para la disminución de la libido(58). No se han demostrado diferencias entre la finasteride y la dutasteride con respecto al riesgo de deseo sexual hipoactivo y disfunción eréctil. El riesgo de deseo sexual hipoactivo y disfunción eréctil es mayor en varones con menor Qmax(59). El riesgo de diabetes de tipo 2 aumenta un 30% durante 11 años en varones con HBP tratados con 5-ARI (finasteride o dutasteride) en comparación con tamsulosina(60).
Los estudios han demostrado que los 5-ARI disminuyen el riesgo de cáncer de próstata de bajo grado, pero los resultados son contradictorios con respecto a los de alto grado(61,62). En la actualidad no se ha probado que exista una relación causal entre 5-ARI y el cáncer de próstata de alto grado (Gleason ≥ 7)(63). Dos ensayos de prevención del cáncer a largo plazo, el Prostate Cancer Prevention Trial (PCPT) y Reduction by Dutasteride of Prostate Cancer Events (REDUCE), mostraron que el uso de 5-ARI a largo plazo (4-7 años) producía un descenso significativo frente a placebo en la incidencia global del cáncer de próstata (24,8%, IC 95%, 18,6% a 30,6% para finasteride y 22,8%, IC 95%, 15,2% a 29,8% para dutasteride), a expensas de los cánceres de grado bajo e intermedio, con un leve aumento relativo del diagnóstico de tumores de alto grado(64,65). Este aumento era numéricamente muy escaso. Estudios posteriores han mostrado que los 5-ARI son seguros en términos de riesgo de cáncer de próstata y mortalidad(61-63,66-68). Después de 6-8 años de tratamiento, hubo una reducción del 69% en el riesgo general de cáncer de próstata, una reducción del 74% en la enfermedad de Gleason 7, pero ningún cambio estadísticamente significativo en el riesgo de la enfermedad de Gleason 8-10. En un estudio de cohorte de base poblacional, el uso previo al diagnóstico de 5-IRA se relacionó con un diagnóstico tardío y peores resultados específicos del cáncer de próstata(69). Es probable que la tasa más alta de cáncer de próstata de alto grado que se encontró con el tratamiento con 5-ARI sea el resultado de la inhibición selectiva de los cánceres de bajo grado y la disminución del volumen de la próstata que resultó en un mejor rendimiento de la biopsia(70). También el descenso de las cifras de PSA por los 5-ARI puede llevar a retrasos en el diagnóstico, mayor graduación y etapa más avanzada del diagnóstico(69). No obstante, en la ficha técnica de estos fármacos se indica que “la relación con tumores de próstata de alto grado no está clara y se aconseja examinar a los pacientes en tratamiento con 5-ARI de forma regular, incluyendo la monitorización anual del PSA en varones STUI/HBP tratados con 5-ARI, para identificar riesgos de cáncer de próstata”.
Por lo tanto, uno de los beneficios de la acción del 5-ARI, tanto en monoterapia como en combinación, es su efecto sobre el valor y cinética del PSA, tanto como elemento de control de respuesta, dada su relación con el volumen prostático, como por su utilidad en el despistaje de un posible cáncer de próstata coexistente o desarrollado a lo largo de su evolución. La inadecuada interpretación del PSA en los pacientes tratados con 5-ARI, consistente en duplicar los niveles de PSA y actuar en función del nuevo valor corregido, puede llevar a un retraso en el diagnóstico del cáncer de próstata. La elevación del PSA respecto al valor más bajo que se haya obtenido durante el seguimiento que suele obtenerse un año después de iniciar el tratamiento con 5-ARI (nadir) es más precisa que la duplicación del PSA en pacientes tratados con 5-ARI(71). Por este motivo en varones en tratamiento con dutasteride, el incremento confirmado del PSA de ≥ 0,3 ng/ml, respecto al valor nadir durante el seguimiento, obliga a descartar un cáncer de próstata, independientemente del valor absoluto del PSA para no incurrir en diagnósticos tardíos. En este sentido, se hace necesario advertir que un estudio ha detectado que el cambio de un 5-ARI (entre principios activos y entre formulaciones originales y sus genéricos) en los pacientes, puede llevar a un aumento en la velocidad del PSA. Estos cambios en la cinética del PSA podrían colocar a los pacientes en riesgo de una biopsia de próstata innecesaria(72).
Los 5-ARIs es la opción terapéutica recomendada para tratamiento a largo plazo, en pacientes con STUI/HBP moderadas a graves y alto riesgo de progresión de la HBP definida por una próstata agrandada (> 40 cc) o concentración de PSA (> 1,4-1,6 ng/ml) (Nivel de evidencia: alto; Grado de recomendación: fuerte a favor).
2.4 Inhibidores de la fosfodiesterasa (IPDE-5)
Diferentes estudios han demostrado una relación epidemiológica y fisiopatológica entre STUI y disfunción eréctil (DE) y otros trastornos de la función sexual, con independencia de la edad y otras comorbilidades. Entre el 50-70% de los varones con HBP pueden sufrir algún grado de DE y la convivencia de los STUI y DE aumenta con la edad(73). La intensidad de los STUI/HBP se asocian a mayor incidencia de DE y trastornos eyaculatorios. Esta relación es especialmente importante en varones con síntomas más graves, en los de mayor edad y en los que llevaban más tiempo en tratamiento(73). Entre las hipótesis fisiopatológicas que asociaron a los STUI con la DE están la alteración en la vía del óxido nítrico-GMPc, el aumento en la señalización de la contracción RhoA-Rho-quinasa, la hiperactividad adrenérgica autonómica y la aterosclerosis pelviana(73). Además, el tratamiento de los STU/HBP (5-ARI, tratamientos invasivos, cirugía) aumenta el riesgo de DE en varones(59).
Datos preclínicos y clínicos han demostrado que los IPDE-5 inducen la relajación de la vejiga y la próstata, lo que contribuye a la mejora en los síntomas de almacenamiento y de la hipercontractilidad de la vejiga y próstata(74). Diferentes estudios han evaluado los efectos de los IPDE-5 en comparación con placebo y otros fármacos (AB y 5-ARI) en hombres con STUI/HBP:
- En estudios a corto (12 semanas) y medio plazo (hasta un año), frente a placebo, los IPDE-5 dan lugar a una pequeña mejoría en la puntuación IPSS-total (Evidencia de calidad: baja a favor) y en el el índice del impacto de la HBP (BPHII) (Evidencia de calidad: baja a favor)(75,76), con un pequeño aumento de los efectos adversos (Evidencia de calidad: baja a favor)(75). Además, se produce una pequeña, pero estadísticamente significativa mejoría del flujo urinario máximo(75). Estos efectos son más intensos en varones más jóvenes, con menor índice de masa corporal y sintomatología más severa. No se ha demostrado una reducción del volumen prostático ni del riesgo de progresión clínica en varones con STUI/HBP, pero estos datos son limitados pues no existen estudios con experiencia de seguimiento a largo plazo (mayor de un año)(76).
- En estudios de 6-12 semanas de duración, los IPDE-5 proporcionan una mejoría similar a los AB en la puntuación IPSS-total (Evidencia de calidad: moderada a favor) y del BPHII (Evidencia de calidad: baja a favor), sin aumentar la incidencia de efectos adversos(77). La combinación de IPDE-5 y AB (tamsulosina y silodosina) proporcionan una pequeña mejoría en la puntuación IPSS-total en comparación con AB solos (Evidencia de calidad: baja a favor), sin diferencia en las puntuaciones BPHII y con una mayor frecuencia de efectos adversos en la terapia combinada(77). Además, la combinación mejora significativamente Qmax y IIEF en pacientes con LUTS/BPH. Las mejoras significativas en IPSS solo se han detectado en poblaciones caucásicas y en varones que estaban recibiendo tratamiento más prolongado para la HBP o con STUI severos(78). El Qmax aumenta significativamente en la combinación en varones en tratamiento más prolongado y con LUTS moderados(78).
- A corto (hasta 12 semanas) y a más largo plazo (13 a 26 semanas), la combinación de un IPDE-5 con un 5-ARI mejora los síntomas urinarios en un grado algo mayor que un inhibidor de la 5-ARI solos (Evidencia de calidad: moderada), sin diferencias en las puntuaciones BPHII ni de los efectos adversos(77).
Datos obtenidos de diferentes estudios indican que la administración de tadalafilo en dosis de 5 mg/día a corto plazo (12-52 semanas) han demostrado frente a placebo mejorías significativas y rápidas (desde la primera semana) de los STUI/HBP (4,7-6,6 puntos) (Evidencia de calidad: baja a favor), del flujo máximo (1,5-2,4), del BPHII y del IIEF(79,80). La mejoría en los STUI es independiente de la edad, de la existencia de tratamiento previo con un AB, de la gravedad de la HBP en el momento basal o de la presencia o ausencia de DE(74,79,81). La magnitud de la mejoría de los STUI/HBP y el perfil de eventos adversos en hombres sin DE es consistente con el observado en hombres con DE(82,83). Las mejorías en los STUI/BPH y de la Qmax con tadalafilo en comparación con el placebo son similares a las producidas por tamsulosina, pero además mejora la función eréctil(76,80,81,84).
La clasificación LUTS-FORTA, cuyo objetivo es la revisión sistemática y clasificación de los fármacos en apropiados e inapropiados para el tratamiento de los LUTS en pacientes de edad avanzada, en función de la eficacia, seguridad y tolerablidad (Tabla 3), establece para tadalafilo la clasificación C (cuidado).
Existe también evidencia a favor de la eficacia de los IPDE-5 en el tratamiento de los STUI/HBP asociados a la DE(51,52).
Existen estudios de combinacion de tadalafilos con AB y 5-ARIs en varones con STUI/HBP:
- La combinacion de tadalafilo con AB (tamsulosina y silodosina) es segura, bien tolerada y más eficaz que la monoterapia con AB(85,86) o tadalafilo(52) para los STUI/HBP (Grado de recomendación: débil a favor).
- La combinación tadalafilo con finasteride produce mejoras significativas en las puntuaciones totales del IPSS y satisfacción en comparación con la monoterapia con finasteride (Grado de recomendación: débil a favor)(87). Asímismo, mejoran significativamente las puntuaciones de IIEF-EF(87-89). Los efectos son más significativos en varones con volúmenes prostáticos mayores de 30 cc y los que tienen síntomas urinarios de moderados a severos(87).
Los efectos adversos más frecuentes respecto al placebo son cefalea, dolor de espalda, rubor facial y dispepsia(74). Los estudios de combinación con AB no han informado de efectos adversos graves, son similares a los esperados con las monoterapias excepto en la mayor incidencia de trastornos gastrointestinales y cefalea(78). Están contraindicados en pacientes isquémicos recientes (IAM, ACVA), hipotensión, tensión arterial mal controlada, insuficiencia renal o hepática significativa, neuropatía óptica isquémica anterior, pacientes tratados con nitratos y en tratados con AB menos uroselectivos (doxazosina o terazosina)(74).
En tadalafilo en pauta de 5 mg/día, fue autorizado en 2012 en España para el tratamiento de los signos y síntomas de la HBP en varones adultos con o sin disfunción DE.
El tadalafilo a 5 mg diarios es una buena una opción terapéutica en varones con STUI/HBP moderados a graves seleccionados, especialmente los afectos de DE (Nivel de evidencia: alta; Grado de recomendación: fuerte a favor). También se podrían emplearse como monoterapia o en pacientes que no toleran los AB o asociados a 5-ARI en varones que empeoran la función eréctil durante el tratamiento con 5-ARI (Nivel de evidencia: alta; Grado de recomendación: moderada a favor).
2.5 Terapia combinada
2.5.1 Combinación de AB y 5-ARIs
Estudios prospectivos multicéntricos, aleatorizados a doble ciego (MTOPS, CombAT), han demostrado que la terapia combinada de un AB con un 5-ARI a largo plazo (4-5 años), en pacientes con STUI/HBP, son más eficaces que las monoterapias en la reducción de la progresión clínica global y la incidencia de complicaciones, incluidos los episodios de RAO y necesidad de cirugía asociada a HBP(30,31,90). La mayor eficacia se obtiene en pacientes en presencia de factores de riesgo de progresión como el aumento del volumen prostático (volumen prostático > 30 cc), sintomatología moderada o grave, cifras de PSA elevadas (≥ 1,5 ng/ml) y edad > 50 años(30-32,90).
En el estudio Medical Therapy of Prostatic Symptoms (MTOPS) se comparaba la combinación de doxazosina y finasteride frente a la monoterapia y al placebo en pacientes diagnosticados de HBP con y sin riesgo de progresión. La terapia combinada fue significativamente más eficaz para reducir el riesgo de progresión clínica, episodios de RAO o necesidad de cirugía a largo plazo (4,5 años)(30). En un análisis post hoc cuando los pacientes fueron estratificados por tamaño de la próstata, en los varones con próstatas pequeñas (< 25 cc a nivel basal) la terapia combinada no fue más beneficiosa que la doxazosina sola, reduciendo el riesgo de progresión clínica de la HBP, la necesidad de tratamiento invasivo, la mejoría de síntomas y flujo. En varones con próstatas de tamaño moderado (25 – < 40 cc) o aumentado (≥ 40 ml s), el tratamiento combinado tuvo un beneficio significativo sobre ambas monoterapias (51). Tampoco la mejoría constató beneficio en la progresión clínica a corto plazo (1 año).
En el estudio Combination of Avodart and Tamsulosin (CombAT), se incluyeron pacientes con HBP en riesgo de progresión (síntomas moderados-graves, volumen prostáticos ≥ 30 cc y PSA ≥ 1,5 ng/ml). La combinación dutasteride/tamsulosina mejoraba la sintomatología de forma significativa frente a la monoterapia con dutasteride a partir del tercer mes y respecto a tamsulosina a partir del noveno mes, independientemente del volumen prostático y del PSA inicial. También se consiguieron beneficios en la calidad de vida y en el flujo urinario máximo antes del primer año de tratamiento(31). A los 4 años, se observó una diferencia estadísticamente significativa en la incidencia de RAO o la necesidad de cirugía con la combinación (4,2%) frente a tamsulosina (11,9%; p < 0,001), pero no frente a dutasterida (5,2%)(31).
El estudio Comparative Efficacy of Dutasteride Plus Tamulosin With Lifestyle Advice Versus Watchful Waiting Plus Lifestyle Advice in the Management of Treatment naïve Men With Moderately Symptomatic Benign Prostatic Hyperplasia and Prostate Enlargement (CONDUCT) con pacientes que presentan síntomas moderados (IPSS total medio de 13,2 puntos) y riesgo de progresión (PSA ≥ 1,5 ng/dl y volumen prostático ≥ 30 cc), sin tratamiento previo para HBP, comparó dos estrategias (el tratamiento con tamsulosina/dutasteride y pautas del estilo de vida desde el inicio de diagnóstico), frente a terapia escalonada de espera vigilada con pautas de estilo de vida e inicio de terapia con tamsulosina si no existe mejoría de síntomas. El resultado mostró un beneficio clínico durante los 2 años de seguimiento en pacientes que fueron tratados con la combinación frente a la terapia escalonada, en cuanto eficacia clínica (mejoría clínica y de calidad de vida relacionada con STUI y del riesgo de progresión clínica), sin compromiso en la seguridad(89).
En una revisión en la que se plantearon diferentes escenarios de simulación a partir de ensayos clínicos aleatorizados y de estudios de seguimiento que incluyeron placebo, tamsulosina, dutasterida y terapia combinada, para valorar el efecto clínico y sobre la tasa de complicaciones del inicio temprano de la terapia de combinación, se comprobó que el retraso en el inicio de la terapia combinada condujo a disminuciones en la respuesta clínica(91).
En general, los efectos adversos son significativamente más frecuentes durante el tratamiento combinado que en cualquier monoterapia. No obstante, no existió mayor tasa de abandonos y los acontecimientos adversos son consistentes con los conocimientos de seguridad típicos de las monoterapias(30,31,92).
La asociación debe prescribirse en aquellos pacientes en los que esté verdaderamente indicado su uso, incluso desde el inicio del tratamiento de los STUI/HBP, si el paciente presenta alto riesgo de progresión. La combinación 5-ARIs/AB sería coste-efectiva en comparación con la monoterapia AB, debido fundamentalmente a la reducción del riesgo de necesitar cirugía o experimentar RAO(93). La interrupción de cualquier fármaco de la terapia de combinación induce la progresión de la HBP(94).
Las dos únicas asociaciones que han demostrado su eficacia en ensayos clínicos a largo plazo son dutasteride/tamsulosina y finasteride/doxazosina. No existen datos de seguridad y eficacia con otras asociaciones a largo plazo de AB y 5-ARI. Por este motivo y hasta disponer de nuevos datos, no recomendamos la utilización de diferentes asociaciones de las estudiadas en la actualidad.
Una vez iniciado el tratamiento combinado no se justifica retirar el AB, pues los efectos de la combinacion con ambos fármacos frente a la monoterapia se mantienen e incluso se amplían a largo plazo(90).
La terapia combinada de un AB y un 5-ARI se recomienda como tratamiento a largo plazo (4-7 años) en pacientes con STUI/HBP moderados a graves con otros factores de riesgo de progresión clínica: volumen prostático moderado (≥ 30 cc medido por ecografía o ≥ II/IV por TR) o grande (≥ 40 cc medido por ecografía) y PSA ≥1,5 ng/dl. (Nivel de evidencia: alto; Grado de recomendación: fuerte).
2.5.2 AB asociado a AM
Los STUI en el varón pueden tener un origen prostático o vesical. Los STUI de llenado como polaquiuria y nocturia se observan frecuentemente en la HBP, en la vejiga hiperactiva (VH) y en otras situaciones que cursan con obstrucción infravesical. En los varones, los síntomas de llenado son más frecuentes que los de vaciado o posmiccionales y aumentan con la edad(95,96). En la HBP, los síntomas de vaciado u obstructivos son más específicos, pero son los de llenado los que más afectan a la calidad de vida(93).
La obstrucción del tracto urinario inferior secundaria a la HBP no es siempre la causa de los STUI en los varones. Por este motivo es posible que después del tratamiento con AB, 5-ARI o cirugía, persistan o se incrementen con el tiempo los síntomas de llenado.
Por otro lado, la relación existente entre HBP y los síntomas de VH, todavía no está suficientemente aclarada, pero los estudios epidemiológicos confirman la frecuente coexistencia entre VH y obstrucción secundaria del tracto urinario por HBP (48-68% de los casos), presentando STUI superpuestos(97). El 50-70% de varones con obstrucción infravesical presenta signos urodinámicos de VH. Por este motivo, en aquellos varones con coexistencia de STUI/HBP de llenado con un componente de VH, se pueden beneficiar de un tratamiento combinado con AB y AM, siempre que se descarte una obstrucción significativa que pudiese descompensarse(94,96,97).
El bloqueo de la vía parasimpática colinérgica por los AM usados en la VH reduce la hiperactividad vesical y aumenta la capacidad funcional de la vejiga, mejorando preferentemente los síntomas de llenado(96,97).
Tradicionalmente ha existido un rechazo a utilizar los AM en varones con síntomas de VH y HBP, por el potencial riesgo de agravar los síntomas obstructivos. Sin embargo, los resultados de varios ensayos han apoyado la eficacia y la seguridad de AM en el tratamiento de hombres con STUI en ausencia de residuo posmiccional elevado(96,97). Aunque algunos estudios han encontrado una diferencia estadísticamente significativa en el aumento en volumen post micional residual con AM (solo o en combinación), la mayoría de los estudios no encontraron un aumento significativo en RAO con AM(95,96,98).
Diversos estudios han comparado la asociación de AB con AM (solifenacina, tolterodina, fesoterodina) para lograr un mejor control de los síntomas de vaciado y de almacenamiento, obteniendo resultados variables. Aunque por lo general han mostrado mejoría respecto al placebo, no han objetivado ventajas clínicas respecto a la monoterapia con AB(96,98-101).
El estudio Neptune ha comparado en un ensayo doble ciego controlado con placebo, la monoterapia con tamsulosina 0,4 mg/día en sistema de absorción controlada (OCAS) con la combinación con dosis fijas de solifenacina a 6 mg o 9 mg diarios, durante un periodo de 12 semanas. Los pacientes tenían STUI moderados-graves (IPSS > 13), con una combinación de síntomas de vaciado y un componente importante de síntomas de almacenamiento (≥ 2 episodios de urgencia y ≥ 8 micciones diarias) y disminución del flujo urinario máximo (4-12 ml/sg)(101). Este estudio ha demostrado una reducción estadísticamente significativa, frente a placebo, tanto de la puntuación total del IPSS como de los episodios de urgencia y frecuencia en los tres brazos de tratamiento. La dosis de 9 mg de solifenacina no aportaba beneficio frente a la de 6 mg diarios. La combinación a dosis de 6 mg mostraba ventajas estadísticamente significativas respecto a monoterapia con tamsulosina(101).
Aunque los resultados son estadísticamente significativos, su importancia clínica no resulta tan evidente a primera vista. En un grupo de pacientes seleccionados por el impacto de los síntomas de almacenamiento y volúmenes prostáticos bajos, la ventaja en < 1 punto en el IPSS total y < 2 puntos en el TUFS (medida compuesta que valora la frecuencia miccional y la intensidad de la urgencia), comparada con placebo, exige recurrir a comparativas de calidad de vida que también han resultado ventajosas hacia la combinación. La combinación es un tratamiento bien tolerado, aunque la sequedad bucal se observó en un 8% de los tratados con solifenacina a 6 µg. En todo caso, se hace necesario revisar periódicamente la evolución del residuo posmiccional.
Su eficacia se ha mantenido a las 52 semanas en una fase abierta extendida del estudio sin que se haya observado un incremento en los efectos adversos graves, con una incidencia de RAO del 1%, aunque la sequedad bucal afectó al 12% de los tratados(102).
La combinación de solifenacina/tamsulosina OCAS 6/0,4 mg está autorizada para el tratamiento de los síntomas de llenado de moderados a graves (urgencia, aumento de la frecuencia miccional) y de los síntomas de vaciado asociados a la HBP en hombres que no están respondiendo adecuadamente al tratamiento con monoterapia.
Los cambios en el volumen residual posmiccional y del flujo máximo con los AM no parecen clínicamente significativos. No obstante, hasta disponer de más datos de su eficacia y seguridad en la práctica clínica habitual, se recomiendan seleccionar adecuadamente a los pacientes a tratar con AM y reevaluar periódicamente sus síntomas. Antes de la prescripción se deben descartar situaciones que desaconsejen su uso: obstrucción infravesical severa (Qmax < 10 ml/s), IPSS grave o residuo posmiccional > 150 ml, próstatas de gran volumen (> 50 cc) o historia de RAO espontánea(15,90,96,97,103).
La clasificación LUTS-FORTA, que evalúa la eficacia, seguridad y tolerabilidad de los fármacos utilizados en personas mayores para el tratamiento de STUI, establece para fesoterodina la clasificación B (beneficioso), oxybutinina transdérmica, solifenacina, trospium y tolterodina la clasificación C (cuidado) y para propiverina y oxibutinina oral la clasificación D (desaconsejado) (Tabla 3).
La combinación AM asociadas a AB en varones con STUI/HBP se podría reservar como segunda línea de tratamiento en caso de síntomas moderados a graves, en los que persisten los síntomas de almacenamiento, a pesar del tratamiento con AB (Nivel de evidencia: moderado; Grado de recomendación: fuerte a favor). En estos casos se recomienda usar en pacientes seleccionados, descartando situaciones que indiquen alto riesgo de obstrucción del tracto urinario inferior (Qmax < 10 ml/s, residuo postmiccional > 150 ml (Grado de recomendación: débil) síntomas graves, volumen prostático > 50 cc o historia de RAO) y realizar un control preciso y periódico del residuo posmiccional cada 4-6 meses.
La monoterapia con AM tiene unos usos muy limitados. Podría estar indicada en varones con STUI/HBP exclusivamente de llenado y VH, tras descartar suficientemente obstrucción del tracto urinario inferior (Tabla 6).
3. Estrategias de tratamiento
No todos los varones con STUI/HBP tienen el mismo riesgo de progresión. Existen una serie de factores de riesgo de progresión de la HBP validados en diferentes estudios(104-107):
- Edad. El riesgo de RAO se triplica en varones entre 60-69 años.
- Volumen prostático. El riesgo de RAO o de cirugía para tratar la HBP se triplica con un aumento de volumen prostático > 30 cc.
- Concentración plasmática de PSA. Valores ≥ 1,5 ng/ml aumenta entre 2-4 veces el riesgo de progresión de la HBP.
- Gravedad de los STUI. La sintomatología moderada a grave, triplica el riesgo de RAO.
La decisión sobre el tratamiento de los pacientes con STUI/HBP se debe adoptar tras la estratificación de los pacientes en función de riesgo de progresión clínica, con el objetivo de identificar e intensificar el tratamiento en los pacientes que tienen mayor riesgo de progresión (Algoritmo de tratamiento) (Nivel de evidencia: alto; Grado de recomendación: fuerte). La estratificación se debe realizar en función de la edad (mayores de 50 años), gravedad de la sintomatología (moderada a grave), volumen prostático (> 30 cc o grado II/IV en TR) y nivel de PSA (≥ 1,5 ng/ml) (Nivel de evidencia: alto; Grado de recomendación: fuerte).
Bibliografía
- Jacobsen SJ, Girman CJ, Lieber MM. Natural history of benignprostatic hyperplasia. Urology. 2001; 58(6 Suppl 1): 5-16).
- Anderson JB, Roehrborn CG, Schalken JA, Emberton M. The progression of benign prostatic hyperplasia: examining the evidence and determining the risk. Eur Urol. 2001; 39: 390-9.
- Arrighi HM, Metter EJ, Guess HA, Fozzard JL. Natural history of benign prostatic hyperplasia and risk of prostatectomy. The Baltimore Longitudinal Study of Aging. Urology. 1991; 38(1 Suppl): 4-8.
- Gravas S, Cornu JN, Gacci M, Gratzke C, Herrmann TRW, Mamoulakis C, et al. Guidelines on the management of male lower urinary tract symptoms (LUTS), incl. benign prostatic obstruction (BPO). European Association of Urology. Actualization 2019. Disponible en: http://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts
- Brenes FJ, Carballodo J, Cozar JM, Fernández-Pro A, Hernández C, Miñana B, et al. Pautas de actuación y seguimiento en: Hiperplasia Prostática Benigna. Madrid: ffOMC, Ministerio de Sanidad Servicios Sociales e Igualdad; 2013.
- NICE Guidelines. Lower urinary tract symptoms in men. Review 2015. [Publicación en línea]. National Institute for Health and Care Excellence, Published September 2013. Disponible en: http://www.nice.org.uk/guidance/conditions-and-diseases/urological-conditions/lower-urinary-tract-symptoms [Consultado 11 de febrero de 2015]
- Parsons JK. Lifestyle factors, benign prostatic hyperplasia, and lower urinary tract symptoms. Curr Opin Urol. 2011; 21: 1-4.
- Brown CT, Yap T, Cromwell DA, Rixon L, Steed L, Mulligan K, et al. Self management for men with lower urinary tract symptoms: randomised controlled trial. BMJ. 2007 6; 334: 25.
- Mondul AM, Giovannucci E, Platz EA. A prospective study of obesity, and the incidence and progression of lower urinary tract symptoms. J Urol. 2014; 191: 715-21.
- Penson DF, Munro HM, Signorello LB, Blot WJ, Fowke JH; Urologic Diseases in America Project. Obesity, physical activity and lower urinary tract symptoms: results from the Southern Community Cohort Study. J Urol. 2011; 186: 2316-22.
- Toren P, Margel D, Kulkarni G, Finelli A, Zlotta A, Fleshner N. Effect of dutasteride on clinical progression of benign prostatic hyperplasia in asymptomatic men with enlarged prostate: a post hoc analysis of the REDUCE study. BMJ. 2013; 346: f2109.
- Dedhia RC, McVary KT. Phytotherapy for lower urinary tract symptoms secondary to benign prostatic hyperplasia. J Urol. 2008; 179: 2119-25.
- MacDonald R, Tacklind JW, Rutks I, Wilt TJ. Serenoa repens monotherapy for benign prostatic hyperplasia (BPH): an updated Cochrane systematic review. BJU Int. 2012; 109: 1756-61.
- Wilt TJ, Macdonald R, Ishani A, Rutks I, Stark G. WITHDRAWN: Cernilton for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2011; (5): CD001042.
- Wilt T, Ishani A, Mac Donald R, Rutks I, Stark G. Pygeum africanum for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2002; (1): CD001044.
- Wilt TJ, Macdonald R, Ishani A, Rutks I, Stark G. WITHDRAWN: Cernilton for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2011; (5): CD001042.
- Madersbacher S, Marszalek M, Lackner J, Berger P, Schatzl G. The long-term outcome of medical therapy for BPH. Eur Urol. 2007; 51: 1522-33.
- Novara G, Giannarini G, Alcaraz A, Cózar-Olmo JM, Descazeaud A, Montorsi F, et al. Efficacy and safety of hexanic lipidosterolic extract of Serenoa repens (Permixon) in the treatment of lower urinary tract symptoms due to benign prostatic hyperplasia: Systematic review and metanálisis of randomized controlled trials. Eur Urol Focus. 2016; 2: 553-6.
- Vela-Navarrete R, Alcaraz A, Rodríguez-Antolín A, Miñana López B, Fernández-Gómez JM, Angulo JC, et al. Efficacy and safety of a hexanic extract of Serenoa repens (Permixon) for the treatment of lower urinary tract symptoms associated with benign prostatic hyperplasia (LUTS/BPH): systematic review and meta-analysis of randomised controlled trials and observational studies. BJU Int. 2018; 122: 1049-65.
- Yamada S, Ito Y. α(1)-Adrenoceptors in the urinary tract. Handb Exp Pharmacol. 2011; (202): 283-306.
- Chapple CR, Montorsi F, Tammela TL, Wirth M, Koldewijn E, Fernández Fernández E; European Silodosin Study Group. Silodosin therapy for lower urinary tract symptoms in men with suspected benign prostatic hyperplasia: results of an international, randomized, double-blind, placebo- and active-controlled clinical trial performed in Europe. Eur Urol. 2011; 59: 342-52.
- Yuan J, Liu Y, Yang Z, Qin X, Yang K, Mao C. The efficacy and safety of alpha-1 blockers for benign prostatic hyperplasia: an overview of 15 systematic reviews.Curr Med Res Opin. 2013; 29: 279-88.
- Wilt TJ, Macdonald R, Rutks I. WITHDRAWN: Tamsulosin for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2011; (9): CD002081.
- MacDonald R, Wilt TJ, Howe RW. Doxazosin for treating lower urinary tract symptoms compatible with benign prostatic obstruction: a systematic review of efficacy and adverse effects. BJU. Int. 2004; 94: 1263-70.
- MacDonald R, Wilt TJ. Alfuzosin for treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia: a systematic review of efficacy and adverse effects. Urology. 2005; 66: 780-8.
- Wilt TJ, Howe RW, Rutks I, Macdonald R. WITHDRAWN: Terazosin for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2011; (9): CD003851.
- Cho KJ, Lee JZ, Song YS, Choi JB, Kim DK, Kim YT, et al. Evaluating the efficacy and safety of silodosin on nocturia in patients with benign prostatic hyperplasia: A multicenter, prospective, open-label, single-arm, phase IV trial. Urology. 2018 Nov; 121: 153-157.
- Xue Z, Lin Y, Jiang Y, Wei N, Bi J. The evaluation of nocturia in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia and the analysis of the curative effect after medical or placebo therapy for nocturia: a randomized placebo-controlled study. BMC Urol. 2018 Dec 13; 18(1): 115.
- Hwang EC, Gandhi S, Jung JH, Imamura M, Kim MH, Pang R, Dahm P. Naftopidil for the treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia. Cochrane Database Syst Rev. 2018; (10): CD007360.
- McConnell JD, Roehrborn CG, Bautista OM, Andriole GL, Jr., Dixon CM, Kusek JW, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med. 2003; 349: 2387-98.
- Roehrborn CG, Siami P, Barkin J, et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study. Eur Urol. 2010; 57: 123-31.
- Roehrborn CG. BPH progression: concept and key learning from MTOPS, ALTESS, COMBAT, and ALF-ONE. BJU Int. 2008; 101(Suppl 3): 17-21.
- Djavan B, Chapple C, Milani S, Marberger M. State of the art on the efficacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Urology 2004; 64: 1081-8.
- Schoenfeld MJ, Shortridge EF, Gelwicks SC, Cui Z, Wong DG. Treatment patterns in alpha-blocker therapy for benign prostatic hyperplasia. Am J Mens Health. 2014; 8: 267-72.
- Cindolo L, Pirozzi L, Fanizza C, Romero M, Tubaro A, Autorino R, et al. Drug adherence and clinical outcomes for patients under pharmacological therapy for lower urinary tract symptoms related to benign prostatic hyperplasia: Population-based cohort study. Eur Urol. 2015; 68: 418-25.
- Oelke M, Becher K, Castro-Díaz D, Chartier-Kastler E, Kirby M, Wagg A, et al. Appropriateness of oral drugs for long-term treatment of lower urinary tract symptoms in older persons: results of a systematic literature review and international consensus validation process (LUTS-FORTA 2014). Age Ageing. 2015; 44: 745-55.
- Yoshida T, Kinoshita H , Shimada S , Taguchi M, Matsuda T. Comparison of silodosin monotherapy vs silodosin with tadalafil add-on therapy in patients with benign prostatic hyperplasia. Urology. 2017; 106: 153-9.
- Pattanaik S, Sandhu HS, Mavuduru RS, Singh SK, Mandal AK. Efficacy of tamsulosin and tadalafil in relieving benign prostatic hyperplasia related symptoms: A randomized double blind placebo controlled cross-over study. Indian J Urol. 2019; 35: 25-33.
- Shelbaia A, Elsaied WM, Elghamrawy H, Abdullah A, Salaheldin M. Effect of selective alpha-blocker tamsulosin on erectile function in patients with lower urinary tract symptoms due to benign prostatic hyperplasia. Urology. 2013; 82: 130-5.
- Kaplan SA. Side Effects of alpha-blocker use: Retrograde ejaculation. Rev Urol. 2009; 11(Suppl 1): S14-8.
- Gacci M, Ficarra V, Sebastianelli A, Corona G, Serni S, Shariat SF, et al. Impact of medical treatments for male lower urinary tract symptoms due to benign prostatic hyperplasia on ejaculatory function: a systematic review and meta-analysis. J Sex Med. 2014; 11: 1554-66.
- Jung JH, Kim J, MacDonald R, Reddy B, Kim MH, Dahm P. Silodosin for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia. Cochrane Database Syst Rev. 2017; (11): CD012615.
- Chatziralli IP, Sergentanis TN. Risk factors for intraoperative floppy iris syndrome: a meta-analysis. Ophthalmology. 2011; 118: 7.
- Lunacek A, Mohamad Al-Ali B, Radmayr C, Weber M, Horninger W, Findl O, et al. Ten years of intraoperative floppy iris syndrome in the era of α-blockers. Cent European J Urol. 2018; 71: 98-104.
- Steers WD. 5alpha-reductase activity in the prostate. Urology. 2001; 58(6 Suppl 1): 17-24.
- Naslund MJ, Miner M. A review of the clinical efficacy and safety of 5alpha-reductase inhibitors for the enlarged prostate. Clin Ther. 2007; 29: 17-25.
- Evans HC, Goa KL. Dutasteride. Drugs Aging. 2003; 20: 905-16.
- Kim EH, Brockman JA, Andriole GL. The use of 5-alpha reductase inhibitors in the treatment of benign prostatic hyperplasia. Asian J Urol. 2018; 5: 28-32.
- Debruyne F, Barkin J, van Erps P, Reis M, Tammela TL, Roehrborn C. Efficacy and safety of long-term treatment with the dual 5 alpha-reductase inhibitor dutasteride in men with symptomatic benign prostatic hyperplasia. Eur Urol. 2004; 46: 488-94.
- Tacklind J, Fink HA, Macdonald R, Rutks I, Wilt TJ. Finasteride for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2010; (10): CD006015.
- Kaplan SA, Chung DE, Lee RK, Scofield S, Te AE. A 5-year retrospective analysis of 5α-reductase inhibitors in men with benign prostatic hyperplasia: finasteride has comparable urinary symptom efficacy and prostate volume reduction, but less sexual side effects and breast complications than dutasteride. Int J ClinPract. 2012; 66: 1052-5.
- Roehrborn CG, Nickel JC, Andriole GL, Gagnier RP, Black L, Wilson TH, et al. Dutasteride improves outcomes of benign prostatic hyperplasia when evaluated for prostate cancer risk reduction: secondary analysis of the REduction by DUtasteride of prostate Cancer Events (REDUCE) trial. Urology. 2011; 78: 641-6.
- Kaplan SA, Lee JY, Meehan AG, Kusek JW; MTOPS Research Group. Long-term treatment with finasteride improves clinical progression of benign prostatic hyperplasia in men with an enlarged versus a smaller prostate: data from the MTOPS trial. J Urol. 2011; 185: 1369-73.
- McConnell JD, Bruskewitz R, Walsh P, Andriole G, Lieber M, Holtgrewe HL, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. Finasteride Long-Term Efficacy and Safety Study Group. N Engl J Med. 1998; 338: 557-63
- Jun JEJ, Kinkade A, Tung ACH, Tejani AM. 5α-Reductase inhibitors for treatment of benign prostatic hyperplasia: A systematic review and meta-analysis. Can J Hosp Pharm. 2017; 70: 113-9.
- Roehrborn CG, Lukkarinen O, Mark S, Siami P, Ramsdell J, Zinner N. Long-term sustained improvement in symptoms of benign prostatic hyperplasia with the dual 5alpha-reductase inhibitor dutasteride: results of 4-year studies. BJU Int. 2005; 96: 572-7.
- Issa MM, Runken MC, Grogg AL, Shah MB. A large retrospective analysis of acute urinary retention and prostate-related surgery in BPH patients treated with 5-alpha reductase inhibitors: dutasteride versus finasteride. Am J Manag Care. 2007; 13(Suppl 1): S10-6.
- Liu L, Zhao S, Li F, Li E, Kang R, Luo L, Luo J, Wan S, Zhao Z. Effect of 5α-reductase inhibitors on sexual function: A meta-analysis and systematic review of randomized controlled trials. J Sex Med. 2016; 13: 1297-310.
- Corona G, Tirabassi G, Santi D, Maseroli E, Gacci M, Dicuio M, et al. Sexual dysfunction in subjects treated with inhibitors of 5α-reductase for benign prostatic hyperplasia: a comprehensive review and meta-analysis. Andrology. 2017; 5: 671-8.
- Wei L, Lai EC, Kao-Yang YH, Walker BR, MacDonald TM, Andrew R. Incidence of type 2 diabetes mellitus in men receiving steroid 5α-reductase inhibitors: population based cohort study. BMJ. 2019; 365: l1204.
- Preston MA, Wilson KM, Markt SC, Ge R, Morash C, Stampfer MJ, et al. 5α-Reductase inhibitors and risk of high-grade or lethal prostate cancer. JAMA Intern Med. 2014; 174: 1301-7.
- Van Rompay MI, Curtis Nickel J, Ranganathan G, Kantoff PW, Solomon KR, Lund JL, et al. Impact of 5α-reductase inhibitor and α-blocker therapy for benign prostatic hyperplasia on prostate cancer incidence and mortality. BJU Int. 2019; 123: 511-8.
- Azoulay L, Eberg M, Benayoun S, Pollak M. 5α-Reductase inhibitors and the risk of cancer-related mortality in men with prostate cancer. JAMA Oncol. 2015; 1: 314-20.
- Thompson IM, Goodman PJ, Tangen CM, Lucia MS, Miller GJ, Ford LG. The influence of finasteride on the development of prostate cancer. N Engl J Med. 2003; 349: 215-24.
- Andriole GL, Bostwick DG, Brawley OW, Gomella LG, Marberger M, Montorsi F, et al; REDUCE Study Group. Effect of dutasteride on the risk of prostate cancer. N Engl J Med. 2010; 362: 1192-202.
- Thompson IM Jr, Goodman PJ, Tangen CM, Parnes HL, Minasian LM, Godley PA, et al. Long-term survival of participants in the prostate cancer prevention trial. N Engl J Med. 2013; 369: 603-10.
- Wallner LP, DiBello JR, Li BH, Van Den Eeden SK, Weinmann S, Ritzwoller DP, et al. 5-Alpha reductase inhibitors and the risk of prostate cancer mortality in men treated for benign prostatic hyperplasia. Mayo Clin Proc. 2016; 91: 1717-26.
- Wallerstedt A, Strom P, Gronberg H, Nordstrom T, Eklund M. Risk of prostate cancer in men treated with 5α-reductase inhibitors-A large population-based prospective study. J Natl Cancer Inst. 2018; 110: 1216-21.
- Sarkar RR, Parsons JK, Bryant AK, Ryan ST, Kader AK, McKay RR, et al. Association of treatment with 5α-reductase inhibitors with time to diagnosis and mortality in prostate cancer. JAMA Intern Med. 2019; 179: 812-9.
- Monga N, Sayani A, Rubinger DA, Wilson TH, Su Z. The effect of dutasteride on the detection of prostate cancer: A set of meta-analyses. Can Urol Assoc J. 2013; 7: E161-7.
- Marberger M, Freedland SJ, Andriole GL, Emberton M, Pettaway C, Montorsi F, et al. Usefulness of prostate-specific antigen (PSA) rise as a marker of prostate cancer in men treated with dutasteride: lessons from the REDUCE study. BJU Int. 2011; 109: 1162-9.
- Helfand BT, Blackwell RH, McVary KT. Consequences of switching 5alpha-reductase inhibitors on prostate specific antigen velocity. J Urol. 2010; 184: 218-23.
- De Nunzio C, Lombardo R, Tema G, Tubaro A. Erectile dysfunction and lower urinary tract symptoms. Curr Urol Rep. 2018; 19: 61.
- Mónica FZ, De Nucci G. Tadalafil for the treatment of benign prostatic hyperplasia. Expert Opin Pharmacother. 2019; 20: 929-37.
- Pattanaik S, Mavuduru RS, Panda A, Mathew JL, Agarwal MM, Hwang EC, et al. Phosphodiesterase inhibitors for lower urinary tract symptoms consistent with benign prostatic hyperplasia. Cochrane Database Syst Rev. 2018; (11): CD010060.
- Donatucci C, Brock GB, Goldfischer ER, Pommerville PJ, Elion-Mboussa A, Kissel JD, et al. Tadalafil administered once daily for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a 1-year, open-label extension study. BJU Int. 2011; 107: 1110-6.
- Pattanaik S, Mavuduru RS, Panda A, Mathew JL, Agarwal MM, Hwang EC, et al. Phosphodiesterase inhibitors for lower urinary tract symptoms consistent with benign prostatic hyperplasia. BJU Int. 2019; 124: 27-34.
- Zhang J, Li X, Yang B, Wu C, Fan Y, Li H. Alpha-blockers with or without phosphodiesterase type 5 inhibitor for treatment of lower urinary tract symptoms secondary to benign prostatic hyperplasia: a systematic review and meta-analysis. world J Urol. 2019; 37: 143-53.
- Carson CC, Rosenberg M, Kissel J, Wong DG. Tadalafil – a therapeutic option in the management of BPH-LUTS. Int J Clin Pract. 2014; 68: 94-103.
- Gacci M, Andersson KE, Chapple C, Maggi M, Mirone V, Oelke M, et al. Latest evidence on the use of phosphodiesterase type 5 inhibitors for the treatment of lower urinary tract symptoms secondary to benign prostatic hyperplasia. Eur Urol. 2016; 70: 124-33.
- Dong Y, Hao L, Shi Z, Wang G, Zhang Z, Han C. Efficacy and safety of tadalafil monotherapy for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a meta-analysis. Urol Int. 2013; 91: 10-8.
- Brock G, Broderick G, Roehrborn CG, Xu L, Wong D, Viktrup L. Tadalafil once daily in the treatment of lower urinary tract symptoms (LUTS) suggestive of benign prostatic hyperplasia (BPH) in men without erectile dysfunction. BJU Int. 2013; 112: 990-7.
- Wang Y, Bao Y, Liu J, Duan L, Cui Y. Tadalafil 5 mg once daily improves lower urinary tract symptoms and erectile dysfunction: A systematic review and meta-analysis. Low Urin Tract Symptoms. 2018; 10: 84-92.
- Oelke M, Giuliano F, Mirone V, Xu L, Cox D, Viktrup L. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo-controlled clinical trial. Eur Urol. 2012; 61: 917-25.
- Kim SW, Park NC, Lee SW, Yang DY, Park JK, Moon DG, et al. Efficacy and safety of a fixed-dose combination therapy of tamsulosin and tadalafil for patients with lower urinary tract symptoms and erectile dysfunction: Results of a randomized, double-blinded, active-controlled trial. J Sex Med. 2017; 14: 1018-27.
- Olesovsky C, Kapoor A. Evidence for the efficacy and safety of tadalafil and finasteride in combination for the treatment of lower urinary tract symptoms and erectile dysfunction in men with benign prostatic hyperplasia. Ther Adv Urol. 2016; 8: 257-71.
- Elkelany OO, Owen RC, Kim ED Review combination of tadalafil and finasteride for improving the symptoms of benign prostatic hyperplasia: critical appraisal and patient focus. Ther Clin Risk Manag. 2015; 11: 507-13.
- Casabé A, Roehrborn CG, Da Pozzo LF, Zepeda S, Henderson RJ, Sorsaburu S, et al. Efficacy and safety of the coadministration of tadalafil once daily with finasteride for 6 months in men with lower urinary tract symptoms and prostatic enlargement secondary to benign prostatic hyperplasia. J Urol. 2014; 191: 727-33.
- Roehrborn CG, Oyarzabal Perez I, Roos EP, Calomfirescu N, Brotherton B, Wang F, et al. Efficacy and safety of a fixed-dose combination of dutasteride and tamsulosin treatment (Duodart®) compared with watchful waiting with initiation of tamsulosin therapy if symptoms do not improve, both provided with lifestyle advice, in the management of treatment-naïve men with moderately symptomatic benign prostatic hyperplasia: 2-year CONDUCT study results. BJU Int. 2015; 116: 450-9.
- Füllhase C, Chapple C, Cornu JN, De Nunzio C, Gratzke C, Kaplan SA, et al. Systematic review of combination drug therapy for non-neurogenic male lower urinary tract symptoms. Eur Urol. 2013; 64: 228-43.
- D’Agate S, Wilson T, Adalig B, Manyak M, Palacios-Moreno JM, Chavan C, et al. Impact of disease progression on individual IPSS trajectories and consequences of immediate versus delayed start of treatment in patients with moderate or severe LUTS associated with BPH. World J Urol. 2019 [En prensa]. doi: 10.1007/s00345-019-02783-x.
- Kruep EJ, Phillips E, Hogue S, Eaddy M. Early symptom improvement and discontinuation of 5-α-reductase inhibitor (5ARI) therapy in patients with benign prostatic hyperplasia (BPH). Ann Pharmacother. 2014; 48: 343-8.
- Morlock R, Goodwin B, Gomez Rey G, Eaddy M. Clinical progression, acute urinary retention, prostate-related surgeries, and costs in patients with benign prostatic hyperplasia taking early versus delayed combination 5α-reductase inhibitor therapy and α-blocker therapy: a retrospective analysis. Clin Ther. 2013; 35: 624-33.
- Lin VC, Liao CH, Kuo HC. Progression of lower urinary tract symptoms after discontinuation of 1 medication from 2-year combined alpha-blocker and 5-alpha-reductase inhibitor therapy for benign prostatic hyperplasia in men–a randomized multicenter study. Urology. 2014; 83: 416-21.
- Coyne KS, Wein AJ, Tubaro A, Sexton CC, Thompson CL, Kopp ZS, et al. The burden of lower urinary tract symptoms: evaluating the eVects of LUTS on health- related quality of life, anxiety and depression: EpiLUTS. BJU Int 2009; 103(Suppl 3): 4-11.
- Kaplan SA, Roehrborn CG, Abrams P, Chapple CR, Bavendam T, Guan Z. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: a systematic review. Int J Clin Pract. 2011; 65: 487-507.
- Kaplan SA. Utilidad de los antagonistas de los receptores muscarínicos en el tratamiento de los varones con síntomas del tracto urinario inferior secundarios a HBP. Actas Urol Esp. 2007; 31: 86-91.
- Yamaguchi O, Kakizaki H, Homma Y, Takeda M, Nishizawa O, Gotoh M, et al; ASSIST Study Group. Solifenacin as add-on therapy for overactive bladder symptoms in men treated for lower urinary tract symptoms–ASSIST, randomized controlled study. Urology. 2011; 78: 126-33.
- Athanasopoulos A, Gyftopoulos K, Giannitsas K, Fisfis J, Perimenis P, Barbalias G. Combination treatment with an alpha-blocker plus an anticholinergic for bladder outlet obstruction: a prospective, randomized, controlled study. J Urol. 2003; 169: 2253.
- Chapple CR, Herschorn S, Abrams P, Sun F, Brodsky M, Guan Z. Tolterodine treatment improves storage symptoms suggestive of overactive bladder in men treated with a-blockers. Eur Urol 2009; 56: 534-41.
- Van Kerrebroeck P, Chapple C, Drogendijk T, Klaver M, Sokol R, Speakman M, et al; NEPTUNE Study Group. Combination therapy with solifenacin and tamsulosin oral controlled absorption system in a single tablet for lower urinary tract symptoms in men: efficacy and safety results from the randomised controlled NEPTUNE trial. Eur Urol. 2013; 64: 1003-12.
- Drake MJ, Chapple C, Sokol R, Oelke M, Traudtner K, Klaver M, et al; on behalf of the NEPTUNE Study Group. Long-term safety and efficacy of single-tablet combinations of solifenacin and tamsulosin oral controlled absorption system in men with storage and voiding lower urinary tract symptoms: Results from the NEPTUNE study and NEPTUNE II open-label extension. Eur Urol. 2015; 67: 262-70.
- Kaplan SA, McCammon K, Fincher R, Fakhoury A, He W. Safety and tolerability of solifenacin add-on therapy to alpha-blocker treated men with residual urgency and frequency. J Urol. 2009; 182: 2825-30.
- Curtis J. Benign prostatic hyperplasia: Does prostate size matter? Rev Urol. 2003; 5(Suppl 4): S12-7.
- Roehrborn CG, McConnell JD, Saltzman B, Bergner D, Gray T, Narayan P, et al; PLESS Study Group. Proscar Long-term Efficacy and Safety Study. Storage (irritative) and voiding (obstructive) symptoms as predictors of benign prostatic hyperplasia progression and related outcomes. Eur Urol. 2002; 42: 1-6.
- Jacobsen SJ, Jacobson DJ, Girman CJ, Roberts RO, Rhodes T, Guess HA, et al. Natural history of prostatism: risk factors for acute urinary retention. J Urol. 1997; 158: 481-7.
- Kaplan S, Garvin D, Gilhooly P, Koppel M, Labasky R, Milsten R, et al. Impact of baseline symptom severity on future risk of benign prostatic hyperplasia-related outcomes and long-term response to finasteride. The Pless Study Group. Urology. 2000; 56: 610-6.
Seguimiento de la hiperplasia benigna de próstata
La HBP es una enfermedad crónica de alta prevalencia en el varón a partir de los 50 años de edad, que aunque no suele influir en la supervivencia del individuo, se acompaña de síntomas molestos que afectan a su calidad de vida. Los índices de progresión clínica de los varones con HBP son altos y aumentan progresivamente con la edad (1-3), con agravamiento de los síntomas, empeoramiento de la calidad de vida y aparición de complicaciones como la retención aguda de orina (RAO) y la necesidad de realizar un tratamiento quirúrgico, entre otras.
El seguimiento del varón con STUI/HBP debe contemplar la valoración de la respuesta al tratamiento inicial, así como la monitorización de la evolución clínica a largo plazo. En los pacientes que no requieren tratamiento quirúrgico, el seguimiento lo realizará el médico de familia en Atención Primaria, aunque ante la aparición de determinadas situaciones se recomendará la derivación a urología (Tabla 1).
Las recomendaciones respecto al seguimiento para todas las modalidades de tratamiento conservador o quirúrgico se basa en datos empíricos o en consideraciones teóricas, pero no en estudios basados en evidencias (Calidad de la evidencia: débil; Recomendación: fuerte a favor).
1. Seguimiento al inicio del tratamiento farmacológico
En los pacientes que presentan sintomatología moderada (IPSS 8-19) o grave (IPSS ≥ 20) que deben iniciar un tratamiento farmacológico, recomendamos las siguientes visitas de seguimiento:
- Primera visita: se realizará al primer mes de iniciado el tratamiento, su objetivo es valorar la tolerancia a este. Ante la aparición de efectos adversos importantes se debe cambiar el fármaco prescrito.
- Segunda visita: su objetivo es confirmar la efectividad y adherencia al tratamiento. Valora la respuesta al tratamiento mediante la anamnesis y la repetición del cuestionario IPSS. Se considera una buena respuesta al tratamiento a la reducción de la puntuación del cuestionario IPSS ≥ 4 puntos, en cuyo caso se continuará el tratamiento pautado. En caso contrario, se valorará cambiar el tratamiento o la derivación a urología. Sus contenidos y cronología dependerán de que el tratamiento utilizado incluya o no 5-ARIs.
- Sin 5-ARI: se programará al tercer mes de iniciado el tratamiento, por ser el periodo en el que se alcanza su máxima eficacia.
- Con 5-ARI: se programará al sexto mes de iniciado el tratamiento, por ser el periodo en el que se alcanza su máxima eficacia. Además de la anamnesis y la repetición del cuestionario IPSS, se incluye la determinación del PSA. El valor del PSA se reduce al 50% de su valor inicial tras 6 meses de tratamiento con un 5-ARI. Cuando no se consigue esta reducción suele deberse a la falta de adherencia.
- Tercera visita: se programará transcurrido un año de iniciado el tratamiento. Su objetivo es confirmar la efectividad y adherencia al tratamiento a medio plazo, mediante la anamnesis y la monitorización del cuestionario IPSS.
- Cuando se produce un empeoramiento objetivo de los síntomas (definido como el incremento en la puntuación del cuestionario IPSS ≥ 4 puntos), hay que valorar el cambio de tratamiento o la derivación a urología.
- En los pacientes en los que su régimen terapéutico incluye un 5-ARI, además repetiremos la determinación del PSA, ya que su valor sigue disminuyendo al menos durante el primer año del tratamiento, y nos servirá como valor de referencia para futuras monitorizaciones.
- Si el paciente se mantiene clínicamente estable, programaremos su valoración anualmente.
2. Seguimiento del paciente con STUI/HBP en situación estable
Incluye a todos los pacientes con STUI/HBP que siguen un régimen de espera vigilada o tratamiento farmacológico y que se encuentran clínicamente estables.
- Monitorización clínica de los síntomas: se realizará anualmente mediante anamnesis y repetición del cuestionario IPSS. Además, dada la baja adherencia al tratamiento de los pacientes con STUI/HBP(4), es conveniente interrogar sobre su cumplimentación.
- Cuando se produzca un empeoramiento de los síntomas (incremento de la puntuación de cuestionario IPSS ≥ 4 puntos) está indicado revaluar al paciente con el mismo protocolo que en el diagnóstico inicial: exploración física, sedimento de orina, bioquímica (glucemia, creatinina y PSA) y ecografía urológica-abdominal. Según los resultados del estudio, se valorará el cambio de tratamiento o la derivación a urología (Tabla 1).
- Si el paciente se mantiene en situación estable, seguiremos con la valoración anual.
- Cribado oportunista del cáncer de próstata: el cribado del cáncer de próstata con la determinación del valor del PSA es en la actualidad uno de los temas más controvertidos en el campo de la urología. Aunque no es el objetivo de esta guía clínica establecer pautas concretas sobre su manejo, sin embargo, es importante señalar algunos puntos sobre esta cuestión:
- La HBP no supone un aumento del riesgo para padecer un cáncer de próstata(5).
- Los varones a los que se les vaya a realizar cribado del cáncer de próstata con PSA deben ser previa y adecuadamente informados, de forma clara y entendible, de los potenciales beneficios y daños del cribado y otorgar su consentimiento(6,7).
- El cribado del cáncer de próstata se puede ofrecer a hombres que tengan una esperanza de vida de al menos 15 años, por lo que en general no se recomienda a varones mayores de 70 años(6,7).
- Se desconocen los intervalos óptimos de determinación del PSA para el cribado del cáncer de próstata, pero en la mayoría de ensayos clínicos son al menos de periodicidad bienal6).
- En pacientes sin tratamiento con 5-ARIs la interpretación del valor del PSA se debe realizar según aparece en este documento en el apartado de diagnóstico (Algoritmo de tratamiento, Figura 2 del capítulo de diagnóstico).
- En pacientes tratados con 5-ARIs se ha documentado en ensayos clínicos una disminución significativa frente a placebo en la incidencia global del cáncer de próstata, a expensas de los cánceres de grado bajo e intermedio, con un leve aumento relativo del diagnóstico de tumores de alto grado, sin que se pueda establecer una relación causal. En estudios poblacionales posteriores no se ha podido demostrar que el tratamiento con 5-ARI ocasione un aumento de la mortalidad total o cáncer-específica, pero sí un retraso en el diagnóstico(8-12) (ver el capítulo de tratamiento con 5-ARI de este documento).
- Del punto anterior se desprende la importancia de interpretar correctamente el valor del PSA obtenido en pacientes tratados con 5-ARIs. Se debe realizar tomando como referencia el valor más bajo del PSA obtenido durante el tratamiento con finasterida o dutasterida (PSA nadir). Si el valor obtenido es mayor o igual al PSA nadir, se debe confirmar la cumplimentación del tratamiento y descartar posibles cambios entre presentaciones o moléculas de 5-ARIs, que pudieran ser la causa de la elevación del PSA(13). En ausencia de las anteriores circunstancias, se repetirá la determinación del PSA a las 4-6 semanas. Si tras la repetición del PSA su valor es ≥ al PSA nadir + 0,3, se derivará al paciente a urología para descartar un cáncer de próstata(14,15) (Fig. 1).
3. Pacientes con STUI/HBP sometidos a tratamiento quirúrgico
El 88-90% de los pacientes tratados con RTUP mejoran de los STUI de forma significativa. Sin embargo, un porcentaje de ellos necesitarán ser reintervenidos por recidiva de los síntomas. Otro aspecto a considerar es que el tratamiento mediante RTUP de la HBP no evita el riesgo de padecer un cáncer de próstata.
Son pacientes monitorizados habitualmente por urología, por lo que cualquier recidiva de los síntomas deberá ser derivada.
Bibliografía
- Platz EA, Joshu CE, Mondul AM, Peskoe SB, Willett WC, Giovannucci E. Incidence and progression of lower urinary tract symptoms in a large prospective cohort of United States men. J Urol. 2012; 188: 496-501.
- McConnell JD, Roehrborn CG, Bautista OM, Andriole GL, Dixon CM, Kusek JW, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med. 2003; 349: 2387-98.
- Djavan B, Fong YK, Harik M, Milani S, Reissigl A, Chaudry A, et al. Longitudinal study of men with mild symptoms of bladder outlet obstruction treated with watchful waiting for four years. Urology. 2004; 64: 1144-8.
- Cindolo L, Pirozzi L, Fanizza C, Romero M, Tubaro A, Autorino R, et al. Drug adherence and clinical outcomes for patients under pharmacological therapy for lower urinary tract symptoms related to benign prostatic hyperplasia: Population-based cohort study. Eur Urol. 2015; 68: 418-25.
- Schenk JM, Kristal AR, Arnold KB, Tangen CM, Neuhouser ML, Lin DW, et al. Association of symptomatic benign prostatic hyperplasia and prostate cancer: Results from the Prostate Cancer Prevention Trial. Am J Epidemiol. 2011; 173: 1419-28.
- Mottet N, van den Bergh RCN, Briers E, Comford P, De Santis M, Fanti S, et al. EAU-EANM-ESTRO-ESUR-SIOG GUIDELINES ON PROSTATE CANCER [Internet]. Disponible en: https://uroweb.org/guideline/prostate-cancer/#1 [Citadoo 15 Jun 2019].
- US Preventive Services Task Force, Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, et al. Screening for Prostate Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2018; 319: 1901-13.
- Van Rompay MI, Curtis Nickel J, Ranganathan G, Kantoff PW, Solomon KR, Lund JL, et al. Impact of 5α-reductase inhibitor and α-blocker therapy for benign prostatic hyperplasia on prostate cancer incidence and mortality. BJU Int. 2018; 123: 511-8.
- Wallner LP, DiBello JR, Li BH, Van Den Eeden SK, Weinmann S, Ritzwoller DP, et al. Health Services research the use of 5-alpha reductase inhibitors to manage benign prostatic hyperplasia and the risk of all-cause mortality. Urology. 2018; 119: 70-8.
- Wallerstedt A, Strom P, Grönberg H, Nordström T, Eklund M. Risk of prostate cancer in men treated with 5α-reductase inhibitors—A large population-based prospective study. JNCI. 2018; 110: 1216-21.
- Wallner LP, DiBello JR, Li BH, Van Den Eeden SK, Weinmann S, Ritzwoller DP, et al. 5-Alpha reductase inhibitors and the risk of prostate cancer mortality in men treated for benign prostatic hyperplasia. Mayo Clin Proc. 2016; 91: 1717-26.
- Azoulay L, Eberg M, Benayoun S, Pollak M. 5α-Reductase inhibitors and the risk of cancer-related mortality in men with prostate cancer. JAMA Oncol. 2015; 1: 314-7.
- Helfand BT, Blackwell RH, McVary KT. Consequences of switching 5alpha-reductase inhibitors on prostate specific antigen velocity. J Urol. 2010; 184: 218-23.
- Marberger M, Freedland SJ, Andriole GL, Emberton M, Pettaway C, Montorsi F, et al. Usefulness of prostate-specific antigen (PSA) rise as a marker of prostate cancer in men treated with dutasteride: lessons from the REDUCE study. BJU Int. 2011; 109: 1162-9.
- Marks LS, Andriole GL, Fitzpatrick JM, Schulman CC, Roehrborn CG. The interpretation of serum prostate specific antigen in men receiving 5α-reductase inhibitors: A review and clinical recommendations. J Urol. 2006; 176: 868-74.
Glosario
- AB: Alfa1-bloqueantes.
- AM: antimuscarínicos o anticolinérgicos.
- DE: disfunción eréctil.
- HBP: hiperplasia prostática benigna.
- IPDE-5: inhibidores de fosfodiesterasa 5.
- IPSS: Índice Internacional de Síntomas Prostáticos.
- ITS: infecciones de transmisión sexual.
- ITU: infecciones del tracto urinario inferior.
- PSA: antígeno prostático específico.
- RAO: retención urinaria aguda.
- RPM: residuo posmiccional.
- STUI: síntomas del tracto urinario inferior.
- TR: tacto rectal.
- VH: vejiga hiperactiva.
- 5-ARIs: 5-alfa-reductasa por 5-ARIs.