Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 11 de marzo de 2020
Aceptado el 25 de marzo de 2020
On-line el 15 de junio de 2020
Palabras clave:
Microbioma
Microbiota
*Autor para correspondencia
Correo electrónico:
jcucalona@semg.es
(J.M. Cucalón Arenal).
Keywords:
Microbiome
Microbiota
José Manuel Cucalón Arenal*, María Guadalupe Blay Cortés
Grupo de Trabajo de Endocrinología, Metabolismo y Nutrición de la SEMG
Resumen
Desde el comienzo de este nuevo siglo el genoma de los diferentes microbios que pueblan simbióticamente nuestro organismo y las funciones que estos mismos realizan suponen un interesante crecimiento científico y ocupan primeros puestos en revistas de alto impacto.
La repercusión que este enorme volumen de carga viva supone en nuestro cuerpo, así como las relaciones entre esta y nuestras propias células, es de inusitado interés en la comunidad científica. Muchas patologías se relacionan con el microbioma y las diferentes microbiotas y se están ensayando terapias para otras tantas entidades nosológicas. Es un hecho la incuestionable relación entre ambos ecosistemas vivos en el equilibrio salud-enfermedad.
En esta primera parte analizamos la importancia de la carga génica de la flora saprófita y de los diferentes ecosistemas que componen la compleja relación entre flora y cuerpo humano. La flora dérmica, respiratoria y urogenital supone un reto para la Medicina actual.
© 2020 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Update in microbiome and microbiota for the medical practitioner (I)
Abstract
Since the beginning of this new century the genome of the different microbes that symbiotically populate our body and the functions have been of growing scientific interest and occupy the leading positions in high impact journals.
The repercussion that this very high dynamic load volume means in our body, and the relationships between it and our own cells have been shown to have noticeable interest in the scientific community. Many pathologies are related with the microbiome and the different microbiotas and treatments are being tested for so many other nosological entities. The unquestionable relationship between both dynamic ecosystems in the health-disease balance is a fact.
In this first part, we analyze the importance of the genetic load of the saprophyte flora of the different ecosystems making up the complex relationship between the flora and human body. The dermal, respiratory and urogenital flora poses a challenge for the current Medicine.
© 2020 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Desde principios de este siglo se ha hecho evidente un crecimiento exponencial en la investigación del microbioma humano, así como las implicaciones que tiene sobre la salud y la enfermedad.
En 2007 se puso en marcha el proyecto de estudio del microbioma humano (Proyecto Microbioma Humano o HMP) por el Instituto Nacional de Salud de los Estados Unidos. Se incluyeron en el estudio algunas microbiotas, no todas, por lo que se está afianzando el conocimiento en todos estos territorios. Pretendía este proyecto establecer la relación de este microbioma con la salud y la enfermedad humana. Para ello se utilizaron técnicas de estudio a partir de la metagenómica y secuenciación del genoma completo1.
Se entiende por microbioma la carga genética de todos los seres vivos microscópicos (microorganismos) que pueblan nuestro cuerpo y constituyen nichos ecológicos propios en forma de microbiotas (poblaciones de microorganismos). Estas agrupaciones microbiológicas habitan los ecosistemas con carácter generalmente simbiótico o mutualista, y se sitúan en todos los sistemas y órganos humanos que tienen contacto con el exterior (aunque no solamente); influyen de manera decisiva en nuestra salud y están en constante relación con el medio externo, al que se ha llamado exposoma en contraposición al microbioma.
Estos nichos ecológicos o microbiotas se distribuyen en varios lugares estratégicos de nuestro organismo y condicionan el funcionamiento del mismo. Así en la piel, el sistema gastrointestinal, el aparato urinario, el genital, el respiratorio, que tienen contacto con el exterior, se conforma una película de microorganismos que componen auténticos sistemas vivos per se, capaces de organizar y gestionar funciones de tipo defensivo, metabólico, químico, genético; a la postre, determinan un complejo sistema de funciones e interacciones que repercuten en la propia fisiología de nuestro cuerpo.
Las diferentes microbiotas están en constante investigación y se han convertido en auténticos órganos de nuestro organismo, con funciones que ahora se están descubriendo y que muestran unas posibilidades enormes para la comprensión de su funcionamiento, de las posibles acciones que llevan a cabo, de la producción u origen de diversas patologías y para ser diana terapéutica en determinados problemas médicos.
La más conocida y estudiada es la microbiota gastrointestinal, compleja y variopinta en sus funciones y posible origen de muchas disfunciones de nuestro organismo a tenor de lo publicado en las sucesivas investigaciones que aparecen en prestigiosas revistas médicas. Además, se ha convertido en diana terapéutica que da lugar la fabricación de diferentes tratamientos farmacológicos con la intención de repoblar/reponer las múltiples cepas de microorganismos que la pueblan, diferentes en cada edad o situación, a fin de restaurar su normalidad2.
Este mercado de probióticos, compuestos farmacéuticos preparados con distintas cepas de microorganismos pobladores habituales de la microbiota intestinal (u otras), y con un beneficio a la salud del huésped, es uno de los más consumidos y demandados por nuestra población, lo que nos obliga, como médicos de cabecera, a estar al día sobre esta práctica, su función, efectos sobre la salud, posibles indicaciones y formas de uso en clínica médica.
Sirva esta actualización para dotar al médico de familia de un documento de revisión y formación sobre un nuevo protagonista de nuestra salud, el microbioma y las diferentes microbiotas, sus funciones y acciones en nuestro organismo, sus efectos positivos y negativos y el papel terapéutico en la práctica clínica habitual en nuestro medio asistencial que desempeñan los probióticos y prebióticos, simbióticos en general (que serán desarrollados en un próximo artículo). Esperamos cumplir esta expectativa.
Microbioma y exposoma
Denominamos microbioma al conjunto de genes contenidos en todos los microorganismos que forman las diferentes microbiotas de nuestro organismo humano y que se relacionan con nuestro propio genoma. Dentro del microbioma podemos hablar de viroma, entendiendo como tal al conjunto de genes que aportan los virus presentes en las microbiotas y que incluyen los virus intracelulares y los fagolíticos (tanto de células eucariotas como procariotas). Además, se encuentran los genes de todas las bacterias, hongos y protozoos existentes en nuestro cuerpo3.
Si a este conjunto de genes aportados por los microorganismos que pueblan nuestras microbiotas le sumamos nuestro propio genoma humano lo llamamos pangenoma.
Nuestra contribución al pangenoma es más bien escasa, puesto que solo poseemos unos 25.000 genes frente a más de 8 x 108 genes de nuestras microbiotas; nuestro genoma es el que más proteínas genera debido a la capacidad de procesamiento de los ARNm.
El microbioma humano dispone de alrededor de 6.000 genes de tipo viral. Existen virus que aportan beneficios funcionales a las bacterias al integrarse en sus cromosomas. Los fagolíticos (fagos líticos o bacteriófagos) controlan las poblaciones de microorganismos de las microbiotas humanas y definen los ecosistemas existentes. Hasta tal punto son importantes los bacteriófagos que se estima en un 7,5 % de la población bacteriana de la microbiota intestinal la que se destruye cada día a causa de estos virus.
Como decíamos nuestra contribución al pangenoma es escasa: como ejemplo que para digerir los glúcidos contamos con 25 genes; para esta misma función, Bacteroides thetaiotaomicron posee unos 250 genes, y esta bacteria es sólo una de las más de 1.000 especies de la microbiota intestinal. La riqueza del microbioma radica en la enorme plasticidad y adaptación al cambio que posee, mucho mayor que la de nuestros genes. Esta plasticidad nos hace más adaptados a los diferentes medios en que vivimos y permite una mayor evolución como especie humana3.
Frente a este microbioma o pangenoma se define exposoma como el conjunto de factores ambientales que afectan a las personas y que también ejercen acciones sobre nuestra fisiología y modifican o adaptan muchas funciones a los continuos estímulos del exterior.
Por tanto, podemos decir que somos prisioneros de ambos, exposoma y microbioma. Ambos nos construyen, nos modifican, nos adaptan y nos permiten tener eso que llamamos vida.
Microbiotas
Como mencionábamos en la introducción, entendemos como microbiota el conjunto de microorganismos que colonizan establemente la superficie epidérmica y los conductos y cavidades del organismo que tienen comunicación con el exterior. Además de en la piel, podemos encontrar microbiotas en el tracto gastrointestinal, desde la boca hasta el ano; en el tracto genitourinario, tanto vaginal como uretral; en el árbol respiratorio; y en otros menos importantes. De todas ellas la más estudiada es la microbiota intestinal, anteriormente también conocida como flora intestinal, a la que más atención científica se ha prestado con un continuo de publicaciones que arrojan conocimiento sobre su función, utilidad, efectos para la salud y causalidad en determinadas patologías y disfunciones.
Los microorganismos se encuentran en simbiosis con nuestro organismo, habitualmente de carácter mutualista, lo que no implica que en algunas circunstancias puedan convertirse en patógenos si las condiciones en las que se encuentran cambian. Forman, por tanto, un ecosistema estable que proporciona al huésped acciones metabólicas específicas, inmunitarias y defensivas y de protección frente a la invasión de otros microorganismos patógenos.
Estas microbiotas tienen una composición distinta en cada uno de los hábitat que colonizan. Así la microbiota intestinal cuenta con una serie de familias de microorganismos que nada o poco tiene que ver con la microbiota epidérmica, vaginal o uretral, y forma ecosistemas distintos con funciones distintas. Además, cada microbiota es diferente según la edad del individuo (lactancia, niñez o la edad adulta) y se modifica en composición y funciones. También se presentan modificaciones en la microbiota dependiendo de determinadas situaciones vitales, como la alimentación y las costumbres y hábitos de vida del huésped.
Las defensas de nuestro cuerpo reconocen esta relación mutualista y no se produce rechazo a su presencia, por lo que su colonización es bien tolerada y estable en las diferentes localizaciones. Solo si estas especies simbióticas cambian de ecosistema, localización o hábitat se produce un conflicto inmunitario y la relación entre ambos, microorganismo y huésped, se convierte en patológica o parasitaria oportunista con la consiguiente infección endógena3.
La composición de las diferentes microbiotas es diversa y compleja, aunque una serie de familias conforman la mayoría de ellas; así, diferenciamos la existencia de virus, hongos, bacterias y protozoos. Ya hemos comentado que los virus forman el viroma. Los organismos celulares se distribuyen en los 3 grandes dominios taxonómicos: Archaea, Bacteria y Eukarya.
Los métodos para la comprobación y clasificación de los microorganismos detectados en las diferentes microbiotas del cuerpo humano se basan fundamentalmente en el análisis del gen que codifica el ARN ribosómico (16S rRNA). El ribosoma es esencial para la transcripción del ARNm; en las bacterias el gen 16S rRNA se ha mantenido inalterado a lo largo de los siglos, ya que cualquier mutación limita su viabilidad3. Este análisis permite la clasificación taxonómica de cada estirpe bacteriana y su secuenciación, y es utilizada para describir la composición de las bacterias presentes en un ecosistema. Así, podemos clasificar a los gérmenes desde los niveles más altos (filos) hasta los más bajos (género). Este sistema de descripción no es válido para hongos y virus.
La tabla 1 es una adaptación de la publicada por Suárez Fernández, microbiólogo de la facultad de Medicina de Oviedo3.
Se calcula que en nuestro organismo habitan unas 1014 bacterias, más de las 3,7×1013 células que lo componen. A esta cifra habría que añadir algunos miles de hongos, Archaea y protozoos, sin contar tampoco los virus, entre intracelulares y fagolíticos, que se encuentran en una proporción frente a los hospedadores de 1:5.
Así pues, se puede observar la enorme diversidad y complejidad de la microbiota autóctona de cada cuerpo humano. Esta enorme diversidad no significa que cualquier microorganismo se pueda asentar sobre nuestro cuerpo, todo lo contrario: hay una selectividad importante de manera que cada ecosistema o microbiota en particular tiene una composición estable y compite para no dejar espacio para otras colonias bacterianas. Esta relación estable entre huésped y colonizadores mantiene, siguiendo a Suárez Fernández3,4, unas interacciones basadas en tres principios:
- Cada individuo presenta una composición estable de microbiota; aunque se vea alterada por mecanismos externos, tiende a recuperase para parecerse a la que previamente existía. Sin embargo, existen variaciones significativas de las especies bacterianas que albergan personas distintas.
- Es más semejante la microbiota entre individuos que entre las especies que habitan las diferentes localizaciones de estas microbiotas; dicho de otra manera: es más semejante la microbiota intestinal entre diferentes personas que entre la intestinal y la vaginal, por ejemplo. De esta manera podemos generalizar las especies más colonizadoras de diferentes ámbitos o ecosistemas.
- A pesar de la enorme variabilidad interindividual, las funciones que esta microbiota ejerce sobre el organismo son más o menos estables o constantes en cada localización. Aunque esta composición estable de microorganismos varíe, las funciones se suelen mantener estables, lo que permite generalizar las funciones de cada microbiota.
Las diferentes funciones que llevan a cabo las distintas microbiotas hacen posible la vida del huésped, por lo que se puede asumir que nuestra vida depende en gran manera de su concurso. Estas funciones metabólicas, inmunitarias, entre otras, pasan desapercibidas gracias a que tenemos integrada su función en el contexto fisiológico de nuestro cuerpo.
Microbiota de la piel
La piel o sistema tegumentario es la cubierta externa de todos los animales vertebrados y uno de sus órganos más importantes. Es nuestra barrera protectora ante los agentes externos amén de sus funciones internas como órgano sensorial que es y, por tanto, parte fundamental de nuestro sistema de comunicación, parte de nuestra estructura y regulador de múltiples funciones como la termorregulación, la excreción, la síntesis y otras. En el ser humano ocupa una extensión de 2 m2 y su peso es de unos 4 kg. La piel contiene anejos o faneras, como pelo, glándulas sebáceas y sudoríparas y uñas5.
La piel es un órgano vital en la homeostasis al regular el equilibrio exterior e interior del organismo. Se encarga de funciones como la fotoprotección, la inmunidad, la termorregulación, la protección mecánica y química, la percepción, la sensibilidad… Es órgano de barrera, evita la pérdida de agua, electrolitos y otros constituyentes corporales y bloquea la penetración de moléculas indeseables o nocivas desde el exterior.
Como órgano más extenso del cuerpo, la piel contiene una microbiota saprófita bacteriana, fúngica y parasitaria, que desarrolla un papel importante en la función de barrera. Esta función protectora viene definida por la interacción de la capa córnea y la capa lipídica superficial, que determinan la permeabilidad entre el medio interno y externo.
La variabilidad interpersonal es muy elevada en la microbiota dérmica, independientemente de la localización. Esta variabilidad depende más del componente microbiológico minoritario que del dominante. Será la futura investigación la que nos abrirá al conocimiento de estas especificidades y de qué misión tienen en cada organismo.
Podemos dividir la microbiota saprófita en dos grandes grupos5:
- La residente habitual, conformada por bacterias corineiformes y Staphylococcus, así como por un grupo menor de micrococos y Acinetobacter, algunos hongos de la familia Malassezia y algunos parásitos como Demodex. Tanto corineiformes (Corynebacterium, Brevibacterium, Propionibacterium y Dermatobacter) como Staphylococcus, son grampositivos aerobios. Acinetobacter son gramnegativos, algunos de ellos con gran capacidad patógena (E. coli, Proteus, Enterobacter, Klebsiella, Pseudomonas…). Entre los hongos destaca Malassezia furfur y algunos grupos de la familia Candida (C. Glabrata). Los escasos parásitos están representados por Demodex foliculorum, localizado en folículos pilosos y que puede hacerse patógeno.
- La transitoria, conformada fundamentalmente microorganismos grampositivos, como Streptococcus del grupo A, Staphylococcus aureus y Neisseria; también algún elemento fúngico, como Candida albicans, que es considerada siempre patógena en la piel.
Esta composición se puede ver alterada o modificada por agentes externos, como la humedad o la temperatura, que influyen decididamente en la diseminación de la microbiota, su reproducción y colonización. La edad, sexo y raza son también elementos definitorios de su variabilidad. En la niñez predominan Staphylococcus y Streptococcus; en la infancia y juventud predomina Propionibacterium por el estímulo sebáceo; y en la edad adulta predomina nuevamente Streptococcus. En el sexo masculino predomina Staphylococcus aureus y en el femenino micrococos. Así mismo, las diferentes regiones topográficas se ven colonizadas de diferentes formas: el cuero cabelludo es zona mixta y contiene bacterias, hongos y parásitos; en las axilas micrococo y corineiformes; y en las regiones cercanas al ano se encuentran además de los anteriores Acinetobacter y Candida.
Se encuentran más de 1.000 especies diferentes de bacterias, correspondientes a 19 filos. Las Acinetobacter pueden representar el 50 %, los Firmicutes 25 %, las Proteobacteria 15-16 % y los Bacteroidetes 6 %; el resto (5 %) está conformado por Streptococcus y Staphylococcus aureus y epidermidis.
En la piel se pueden encontrar tres ecosistemas distintos: sebáceos, húmedos y secos5:
- En el primer ecosistema encontramos Propionibacterium y Staphylococcus.
- En las regiones húmedas dominan las Corynebacterium y Staphylococcus.
- En las regiones secas Proteobacterium y Flavobacterim.
Según datos revelados tras el estudio del microbioma humano, se han encontrado 14 géneros diferentes de hongos, que incluyen levaduras, dermatofitos y hongos no dermatofíticos oportunistas. El hábitat más rico en hongos es el pie, sobre todo el talón y la región interdigital.
El ombligo presenta una microbiota característica, dada su especial condición de humedad y sin exposición a la luz o secreciones. Este nicho ha merecido la creación de un proyecto de investigación, realizado en 2011 por la Universidad de Carolina del Norte, denominado Biodiversidad Belly Button, que está siendo llevado a cabo en voluntarios y confluye con el proyecto de estudio del microbioma humano.
Las funciones principales de esta microbiota dérmica radican en la defensa por medio de la interferencia bacteriana, las acciones de barrera al degradar lípidos de la superficie, la generación de olor al degradar las sustancias del sudor apocrino (que es inodoro), la interferencia bacteriana mediante la producción de determinadas sustancias bactericidas o por competencia frente a los nutrientes, o bien estimulando el sistema inmunológico.
Dependiendo del sistema inmunitario del huésped y de las condiciones externas, este componente microbiológico puede hacerse patógeno, máxime si se desplaza a otras regiones del cuerpo humano (al torrente circulatorio, por ejemplo). El ejemplo más significativo puede ser la Pseudomonas aeruginosa, que de ser mutualista puede pasar a ser muy patógena. Esta bacteria produce una sustancia antimicrobiana, el ácido pseudomónico, explotado comercialmente como mupirocina, muy eficaz frente a grampositivos como Staphylococcus y Streptococcus. Pero no solamente produce esta sustancia, sino que puede inhibir el crecimiento de hongos o la colonización de Helicobacter pylori, de manera que eliminar Pseudomonas de la piel puede conllevar una colonización levaduriforme.
La piel también se defiende de la colonización de microorganismos mediante mecanismos defensivos, como la secreción de péptidos antimicrobianos (catalicidina, que controla la proliferación microbiana), la acidez de la piel debida al ácido láctico del sudor o a la activación del sistema inmune de tipo celular. Por último, la constante descamación y exfoliación de la piel, recambio fisiológico, también regula la masa colonizadora.
Muchos microorganismos de la piel están involucrados en enfermedades no infecciosas dérmicas, como la dermatitis atópica, rosácea, psoriasis y acné. En todas ellas hay una predominancia de alguna familia bacteriana: así el acné, por su carácter supersebáceo, presenta sobrecrecimiento de Corynebacterium; en dermatitis atópica hay un aumento de Staphylococcus aureus; en psoriasis Firmicutes y Acinetobacter; y en rosácea destaca el sobrecrecimiento de Demodex.
Por tanto, diversas infecciones de la piel y enfermedades dérmicas no infecciosas pueden estar motivadas por la alteración de la normal composición de su microbiota. La piel tiene mecanismos de defensa y de selección natural de las distintas familias bacterianas; estas a su vez controlan el sobrecrecimiento de algunas colonias y el rechazo a la implantación de otras. Este equilibrio es el que mantiene la normalidad de funciones y la ausencia de patología5.
Microbiota urogenital
Tradicionalmente se había mantenido que el tracto urinario era estéril en los individuos sanos; nada más lejos de la realidad. Desde hace algunos años se conoce la existencia de una microbiota autóctona propia, cuyo papel comienza a vislumbrarse a través de la investigación científica. Esta microbiota es diferente en personas sanas y enfermas, por lo que se abre un futuro muy atractivo en busca del origen de la patología urológica así como de su diagnóstico y de las posibilidades terapéuticas que conlleva este conocimiento.
Las infecciones del tracto urinario (ITU) son, junto a las respiratorias, las más frecuentes en patología médica. Niños y mujeres son pasto frecuente de sus consecuencias. Los gérmenes habituales de estas ITU han sido descritos hace ya décadas y son fundamentalmente Escherichia coli (hasta en un 85 % de los casos), Proteus mirabilis, Klebsiella pneumoniae y en menor medida Streptococcus y Staphylococcus. Se sabe que estas bacterias (Firmicutes) provienen mayoritariamente del tracto intestinal; acceden a la uretra y ascienden hasta la vejiga o por el uréter hasta el mismo riñón. Allí pueden colonizar y proliferar hasta hacerse resistentes o habituales, o bien pueden llegar por vía hematógena, menos frecuentemente6.
La microbiota urinaria es sustancialmente distinta de la de los otros ecosistemas del cuerpo, aunque pueda compartir en ocasiones espacios comunes. Diversos factores, como en el caso de las demás microbiotas, definen la composición de la misma. Así, edad, sexo, actividad sexual, toma de antibióticos, entre otros, dan forma individual a este nicho ecológico. La diferencia entre sexos es entendible a tenor de las diferencias no solo anatómicas sino hormonales, inmunitarias… Este hecho puede justificar la mayor mortalidad en mujeres con cáncer de vejiga o la mayor prevalencia de litiasis renal en varones; por tanto, es muy posible que el desequilibrio de esta microbiota desencadene patologías hasta ahora explicadas desde otros puntos de vista.
La composición de la microbiota urinaria es menos conocida que la de la intestinal, pero no por ello es menos interesante. Es menos rica y variada: se estima en 105 UFC (unidades formadoras de colonias) en la orina frente a las 1012 UFC en las heces. Está compuesta fundamentalmente por Lactobacillus y en menor medida por Streptococcus, Staphylococcus, Corynebacterium y Gardnerella7.
En condiciones normales la microbiota del tracto urinario está formada por un rango amplio de 20 a 500 especies bacterianas distribuidas por 9 filos mayoritarios: Firmicutes, Bacteroidetes, Acinetobacter, Fusobacterium, Proteobacteria y en menor medida Chloroflexi, Spirochaeta, Synergistetes y Fibrobacteres.
Actualmente se están realizando estudios para identificar los factores que influyen en su composición y su evolución, sus interacciones con las microbiotas vaginal e intestinal y, sobre todo, el papel de esta microbiota en la aparición de patologías urinarias, dado que el desequilibrio de la misma podría estar implicado en las infecciones urinarias, la incontinencia e incluso ciertas patologías de la próstata7-14.
La microbiota vaginal está más estudiada que la urológica; por tanto, se conocen mejor su composición y sus funciones, aunque suelen coincidir en la misión de barrera frente a otras colonizaciones patógenas. Esta microbiota va modificándose y evolucionando a lo largo de los años de la vida de la mujer en función de su estado hormonal; existen cambios en función de los embarazos, los partos y puerperios, el periodo menstrual, la menopausia…
Aunque se sabe que la colonización se inicia con el alumbramiento, la microbiota es escasa en la infancia; es en la menarquia cuando se establece una microbiota estable y definitiva.
Se ha aislado una familia mayoritaria, Lactobacillus, en la que destacan L. crispatus, L. jensenii, L. iners y L. grasseri. En la menopausia, y tras los cambios estructurales debido a la carencia de estrógenos, se produce una modificación en la microbiota y disminuye la cantidad de Lactobacillus. Este hecho también se ha descrito en otras situaciones, como la menstruación, el envejecimiento, la colocación de dispositivos intrauterinos… En dichas circunstancias se produce un aumento de colonizaciones por otras familias, que pueden desembocar en infecciones por Candida (vaginitis) o por Gardnerella (vaginosis)15.
Son tres los mecanismos que se invocan en la defensa del ecosistema vaginal y, por tanto, en la dificultad de colonización de otras cepas patógenas:
- La adherencia específica al epitelio, que bloquea su asentamiento.
- La producción de sustancias antimicrobianas.
- La congregación con los patógenos, que potencia su efecto microbiocida.
La microbiota vaginal es rica en Lactobacillus y se ha comprobado cómo muy rara vez estos provocan infección; si lo hacen es en estado de franca inmunodepresión. Lo típico es ver infecciones por Candida, Trichomonas, Gardnerella o gérmenes de la vía urinaria o intestinal. El efecto mutualista de los Lactobacillus sugiere que puede regenerar el ecosistema vaginal y por tanto ofrecer un beneficio al huésped15.
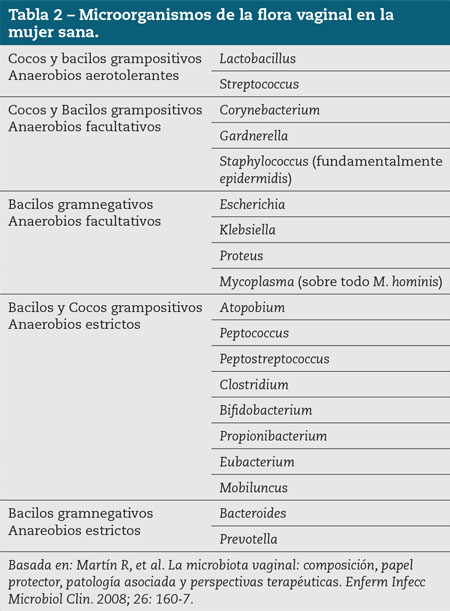
En la tabla 2 se presenta una relación de los microorganismos que se detectan con regularidad en la vagina de mujeres sanas. La mayoría son típicos del hábitat intestinal, lo que sugiere que el tracto entérico puede actuar como reservorio de dichos agentes infecciosos; sin embargo, las frecuencias relativas son muy distintas a las encontradas en la porción final del tubo digestivo. Las diferencias más notables son las siguientes: los Lactobacillus son dominantes en la vagina, hasta el punto de ser prácticamente exclusivos en muchos casos, mientras que son minoritarios en el intestino donde no siempre aparecen; cuando lo hacen, su proporción nunca es mayor del 1 %. En general, el porcentaje de muestras de exudado vaginal que presentan predominancia de los Lactobacillus es superior al 70 %, tanto si el procesamiento de las mismas incluye el cultivo, como si se hace por métodos genotípicos. Por otro lado, las bacterias grampositivas o gramnegativas anaerobias estrictas de los grupos Clostridium-Eubacterium y Bacteroides-Prevotella, respectivamente, que dominan el hábitat intestinal, aparecen esporádicamente en la vagina, lo que sugiere que en esta mucosa son transeúntes más que colonizadoras.
Desde la descripción en 1892 por Döderlein, los Lactobacillus, bacterias del ácido láctico que producen fermentando los azúcares, grampositivas, no esporuladas, catalasa negativos, anaerobias tolerantes y con escasez de información genética que las hace poco infectantes, son las bacterias mayoritarias en este nicho vaginal. Nutricionalmente son muy exigentes y forman una biopelícula en contacto con el epitelio vaginal, que dificulta o impide el asentamiento de otras especies bacterianas que se le agregan, y secreta productos microbiocidas cuando no el propio ácido láctico o el peróxido de hidrógeno.
De esta manera el pH vaginal es normalmente ácido (alrededor de 4), que inhibe el crecimiento bacteriano ya de por sí. En la vaginosis se aprecia un pH muy aproximado a la neutralidad, que da idea de que se ha producido una disbiosis. Este aumento de pH es aprovechado por oportunistas que pueden producir infección. Hay situaciones fisiológicas que pueden aumentar este pH y, por tanto, favorecer el crecimiento de dichas bacterias oportunistas. El aumento del pH se comprueba en estados de hipoestrogenismo, en las niñas recién nacidas, durante la menstruación, en contacto con el semen y por el uso de espermicidas, tampones…
Un pH por encima de 4,7 es aprovechado por Trichomonas y Gardnerella para provocar tricomoniasis y vaginosis; su presencia es un signo definitorio de dichas infecciones en la clínica. Pero estas bacterias, a su vez, producen una potente actividad aminoácido descarboxilasa, que genera aminas biógenas (productoras del mal olor) y eleva el pH, lo que favorece la inhibición de los Lactobacillus. Cuando el pH se coloca por debajo de 4 o 4,2 se restablece de nuevo el crecimiento de Lactobacillus y la normalidad vuelve a ser la norma; es lo que llamamos resiliencia. Así mismo, se correlaciona el nivel de Lactobacillus con otras infecciones como las ITU, ya explicadas, en las que se aprecia una correlación inversa entre Lactobacillus y gérmenes intestinales (E. coli y otros) y en enfermedades de transmisión sexual, en las que se produce un efecto similar que favorece el crecimiento de Neisseria y Chlamydia15.
El desarrollo de cepas bacterianas a base de Lactobacillus se está utilizando con buenos resultados en determinadas enfermedades vaginales: se ha comprobado que favoreciendo el crecimiento de estos Lactobacillus disminuyen los oportunistas y se restaura la homeostasis vaginal. Estos probióticos se están ensayando con esperanzadores resultados que se verán en un próximo artículo.
Microbiota respiratoria
De mucho menos interés clínico en este momento y, por tanto, con menos desarrollo investigador, la microbiota de las vías respiratorias comienza en la boca y abarca la faringe, la laringe y los bronquios. Al igual que el aparato urinario, el pulmón se ha considerado siempre espacio estéril; sin embargo, también hoy sabemos que dispone de una microbiota estable y funcional16.
El método clásico de valoración de la colonización bacteriana pulmonar ha sido el estudio del esputo inducido, pero no constituye una muestra representativa. La utilización del lavado bronco-alveolar o la biopsia son mejores métodos, pero de difícil obtención en la clínica por ser métodos invasivos.
Según los escasos estudios realizados al respecto, parece que la microbiota de las vías inferiores es similar a la de las vías superiores; se diferencia fundamentalmente en densidad y diversidad. Se discute el papel de la aspiración de secreciones durante el sueño. Así mismo presenta similitudes con la microbiota intestinal, pero en este caso parece venir determinada por condiciones como el clima, la zona geográfica, el medio en el que se vive, la exposición a alergenos aéreos, consumo de tabaco…16.
Se han descrito hasta 314 especies de los diferentes filos de Bacteroidetes (Prevotella, Bacteroides), Firmicutes (Streptococcus y Staphylococcus) y Proteobacterias (Pseudomonas, Haemophilus, Moraxella, Neisseria y Acinetobacter). Esta composición microbiológica parece depender de condiciones internas del propio organismo (tos, defensas…) o del exterior al mismo (consumo de tabaco, infecciones virales, tratamientos antibióticos…).
Como ocurre en otros lugares, la disbiosis puede ser causa de enfermedades pulmonares crónicas como asma o enfermedad pulmonar obstructiva crónica (EPOC), al permitir la colonización de hongos o bacterias patógenas. Se ha podido demostrar la presencia de cambios en las especies bacterianas en la EPOC: aumento de Haemophilus, Pseudomonas y Streptococcus. En otros procesos respiratorios, como la fibrosis pulmonar idiopática, se ha observado una sobreexpresión de Streptococcus y Staphylococcus, así como de Prevotella. La presencia de disbiosis, con predominancia de microorganismos de los filos Proteobacterias o Firmicutes en muestras de lavado broncoalveolar, se asocia a respuesta inflamatoria, mientras que la sobrerrepresentación de Bacteroidetes se asocia a remodelación, lo que puede tener trascendencia en las enfermedades del parénquima pulmonar16.
Los futuros estudios de metagenómica y análisis del ARN desvelarán el verdadero papel que desempeña la microbiota en la funcionalidad pulmonar, así como las consecuencias de la disbiosis de este ecosistema en la generación de enfermedad respiratoria crónica17.
En la cavidad oral la microbiota es mucho más frecuente y diversa. Se han descrito más de 600 especies distribuidas en 13 filos entre los que destaca, además de los anteriormente enunciados, las Fusobacterium, Spirochaetes, Chlamydia y otros. Existe un ambiente muy rico para bacterias anaerobias que forman biopelículas, aunque destaca la presencia de Streptococcus. Dentro de la boca existen varios micro-nichos motivados por la propia anatomía: las encías, los dientes o las cavidades; también por las propias condiciones de fricción mecánica (masticación) o químicas (caries, saliva, pH…).
Deberemos esperar a nueva investigación para completar el estudio del papel que desempeña esta microbiota y de las implicaciones en el binomio salud-enfermedad en el árbol respiratorio.
En la segunda parte de este artículo sobre microbioma y microbiotas se tratará la microbiota intestinal, una de las más importantes e investigadas y con mayor proyección en la clínica hasta este momento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Human Microbiome Project – Home. NIH Common Fund. Disponible en: www.commonfund.nih.gov.
- Guarner F, Malagelada JR. La flora bacteriana del tracto digestivo. Gastroenterol Hepatol. 2003; 26(supl 1): 1-5.
- Suárez Juan E. Microbiota autóctona, prebióticos y prebióticos. Nutr Hosp. 2015; 31(supl 1): 3-9.
- Martín R, Escobedo S, Martín C, Suárez JE. Microbiota autóctona: funciones. Microbioma humano. En: Calatayud G, Marcos A, Margolles A (eds). Probióticos, prebióticos y salud: Evidencia científica. Madrid: Ergon; 2016. p. 1-10.
- Santamaría González V, Alvarado Delgadillo A. Flora cutánea como protección y barrera d la piel normal. Rev Cent Dermatol Pascua. 2002; 11: 18-21.
- Alarcón Cavero T, D´Auria G, Delgado Palacio S, del Campo Moreno R, Ferrer Martínez M. Microbiota. En: Cercenado Mansilla E, Cantón Moreno R (eds). Procedimientos en Microbiología Clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. SEIMC; 2016.
- Fouts DE, Pieper R, Szpakowski S, Pohl H, Knoblach S, Shu MJ, et al. Integrated next- generation sequencing of 16S rDNA and metaproteomics differentiate the healthy urine microbiome from asymptomatic bacteriuria in neuropathic bladder associated with spinal cord injury. J Transl Med. 2012; 10: 174.
- Siddiqui H, Nederbragt AJ, Lagesen K, Jeansson SL, Jakobsen KS. Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons. BMC Microbiol. 2011; 11: 244.
- Wolfe AJ, Toh E, Shibata N, Rong R, Kenton K, Fitzgerald MP, et al. Evidence of uncultivated bacteria in the adult female bladder. J Clin Microbiol. 2012;50:1376-83.
- Brubaker L, Wolfe A. The female uriniary microbiota, urinary health and common urinary disorders. Ann Transl Med. 2017; 5: 34
- Pearce MM, Hilt EE, Rosenfeld AB, Xilliox MJ, Thomas-White KJ, Fok C, et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. Mbio. 2014; 5: e01283-14.
- Thomas-White KJ, Hilt EE, Fok C, Pearce MM, Mueller ER, Kliethermes S, et al. Incontinence medication response relates to the female urinary microbiota. Int Urogynecol J. 2016; 27: 723-33.
- Khasriya R, Sathiananthamoorthy S, Ismail S, Kelsey M, Wilson M, Rohn JL, et al. Spectrum of bacterial colonization associated with urothelial cells from patients with chronic lower urinary tract symptoms. J Clin Microbiol. 2013; 51: 2054-62.
- Amarenco G. Microbiote urinaire et troubles mictionnels. Prog Urol. 2015; 25: 625-7.
- Martina R, Soberón N, Vázquez F, Suárez JE. La microbiota vaginal: composición, papel protector, patología asociada y perspectivas terapéuticas. Enferm Infecc Microbiol Clin. 2008; 26: 160-7.
- García-Pachón E. La microbiota de la vía aérea inferior. Med Respir. 2017; 10: 29-35.
- Monsó E. El microbioma respiratorio: más allá del cultivo. Editorial. Arch Bronconeumol. 2017; 53: 473-4.