Artículo Original
Información del artículo
Historia del artículo:
Recibido el 5 de febrero de 2021
Aceptado el 17 de febrero de 2021
On-line el 9 de marzo de 2021
Palabras clave:
Déficit de hierro
Insuficiencia cardiaca
Anemia
Atención primaria
*Autor para correspondencia
Correo electrónico:
megocheaga@semg.es
(M.I. Egocheaga Cabello ).
Keywords:
Iron deficiency
Heart failure
Anaemia
Primary care
María Isabel Egocheaga Cabelloa,*, María Sanz Almazánb, Pilar Rodríguez Ledoc, Yasmín Drak Hernándezd, Carlos Miranda Fernández-Santose, en representación del Grupo de Trabajo de Cardiovascular de SEMG
aCentro de Salud Isla de Oza. Madrid. bCentro de Salud Riaza (Segovia). cGerencia del Área Sanitaria de Lugo, A Mariña e Monforte de Lemos (Lugo). dCentro de Salud Los Rosales. Madrid. eCentro de Salud Buenavista. Toledo.
Resumen
Antecedentes. El déficit de hierro (DH) es una patología común con especial relevancia en pacientes con insuficiencia cardiaca (IC). El hierro, esencial para la formación del grupo hemo, interviene en el metabolismo oxidativo y afecta a la producción celular de energía y, por tanto, a la funcionalidad de los miocitos y los cardiomiocitos. El DH puede presentarse con o sin anemia, lo que vuelve imprescindible su detección como un trastorno independiente. En la práctica clínica el DH en la IC crónica todavía está infradiagnosticado e infratratado, a pesar de que su prevalencia en pacientes atendidos en atención primaria (AP) es alta.
Objetivos. Valorar el grado de conocimiento/actitud de los médicos de AP frente al DH en pacientes con IC.
Material y métodos. Se diseñó una encuesta online de 43 preguntas sobre el DH en la IC, diagnóstico y tratamiento, su abordaje multidisciplinar, seguimiento y necesidades formativas de los médicos de AP.
Resultados. Participaron 464 médicos. Los resultados obtenidos muestran que el conocimiento por parte de muchos médicos es incompleto: aunque la mayoría sabía cuáles son los parámetros necesarios para el diagnóstico del DH, no emplean adecuadamente los criterios establecidos por las guías y desconocen cuáles son el tratamiento y el seguimiento adecuados. También se observó una falta de protocolización y coordinación entre la AP y la atención hospitalaria para el abordaje de los pacientes con IC.
Conclusiones. Actualmente existe un bajo nivel de conocimiento por parte de los médicos generales y de familia sobre la alta prevalencia, las consecuencias clínicas, el diagnóstico y el abordaje terapéutico del DH en los pacientes con IC; también se observa una falta de protocolización y coordinación entre la AP y la atención hospitalaria. Por tanto, los resultados ponen de manifiesto la necesidad de ampliar la formación de los médicos para optimizar el abordaje de los pacientes con IC y DH desde el ámbito de la AP.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Iron deficiency and heart failure: perspective from primary care
Abstract
Background. Iron deficiency (ID) is a common pathology that becomes relevant in Heart Failure (HF). Iron, essential for the formation of the hemi group, is involved in oxidative metabolism, affecting the cellular energy production and therefore the myocytes and cardiomyocytes function. ID can occur with or without anaemia, which makes its detection as an independent disorder essential. In clinical practice ID in chronic HF is still underdiagnosed and undertreated despite its prevalence in patients treated in Primary Care (PC) is high.
Objectives. To assess the degree of knowledge/attitude of physicians about ID in patients with HF.
Methods. A 43-question online survey was designed on ID in HF, diagnosis and treatment, multidisciplinary approach, follow-up, and training needs of PC doctors.
Results. 464 physicians participated. The results obtained showed that the knowledge of many physicians is incomplete: although the majority knew what the necessary parameters are for the diagnosis of ID, they did not adequately handle the criteria established by the guidelines and were unaware of the effective treatment. A lack of protocolization and coordination between PC and hospitals for the management of HF patients was also observed.
Conclusion. Currently, there is a low level of knowledge by general and family doctors about the high prevalence, clinical consequences, diagnosis, and therapeutic management of ID in HF patients; as well as a lack of protocolization and coordination between PC and hospitals. So, the results show the need to expand the training of physicians to optimize the management of patients with HF and ID from the Primary Care.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
El déficit de hierro (DH) es una de las patologías más comunes en todo el mundo1. El hierro (Fe) es un elemento con un papel central en muchos procesos metabólicos, esencial para la producción del grupo hemo durante la formación de eritrocitos, pero también para el metabolismo oxidativo y la síntesis y catabolismo de carbohidratos, lípidos y ácidos nucleicos1. Estas funciones no hematopoyéticas explican por qué las consecuencias del DH no se limitan a la eritropoyesis, sino que también afectan a la producción celular de energía (adenosín-trifosfato o ATP) y limitan la funcionalidad de células como los miocitos y los cardiomiocitos, provocan cansancio y reducen la capacidad de ejercicio2. El Fe participa de manera crucial en la estabilidad electroquímica y el mantenimiento de la estructura y contractilidad de los cardiomiocitos3, por lo que su déficit es importante en la fisiopatología de la insuficiencia cardiaca (IC)3,4.
El DH es frecuente en los pacientes con insuficiencia cardiaca crónica (ICC)1,5. En un estudio de 1.506 pacientes con ICC estable, hasta un 50 % de ellos presentaban DH6. Cuando fueron analizados por el nivel de hemoglobina (Hb), el 46 % de los pacientes sin anemia y el 61 % de los pacientes con anemia presentaban DH1. Estos resultados fueron similares a los de otro estudio con 4.456 pacientes con IC, en el que un 43-68 % de los pacientes con anemia presentaban DH y un 14-35 % con Hb normal presentaban DH7. Asimismo, en otro estudio en que se hizo un análisis de médula ósea a 37 pacientes anémicos con IC avanzada grave, se detectó que el 73 % presentaba DH8.
Las causas de la DH en la IC crónica pueden ser multifactoriales: por inflamación crónica, disminución de la ingestión de Fe (mala nutrición y pérdida de apetito), disminución de la absorción de Fe por edema o pérdida gastrointestinal de sangre9. Es más frecuente en mujeres y pacientes con IC avanzada10, pero también puede afectar a los pacientes con IC de bajo riesgo sin anemia, con una prevalencia superior a 30 %10.
Los síntomas del DH en la IC son inespecíficos: disminución de la capacidad de ejercicio, empeoramiento de la clase funcional NYHA (New York Heart Association), alteraciones cognitivas y del comportamiento y agravamiento de los síntomas depresivos2. Sin embargo, los pacientes con IC y DH experimentan peores síntomas comparados con quienes tienen reservas normales de Fe. Presentan una capacidad para el ejercicio reducida, peor calidad de vida y un riesgo incrementado de morbimortalidad independientemente de si tienen o no anemia5. Se ha visto que los pacientes con IC y DH tienen un peor pronóstico que quienes padecen anemia10. Además, incluso antes del inicio de la anemia, el DH puede ser particularmente grave en estos pacientes, empeorar la enfermedad subyacente, aumentar el riesgo de la hospitalización11 e incrementar hasta un 40-60 % el riesgo de mortalidad9.
Así pues, es indiscutible la importancia de identificar y corregir el DH en pacientes con IC crónica. Por ello, en las últimas guías de la Sociedad Europea de Cardiología para la insuficiencia cardiaca (European Society of Cardiology Guideline, ESC 2016)12, el DH ha sido reconocido como una comorbilidad importante e independiente de la anemia, y se proporcionan recomendaciones específicas relativas a su diagnóstico y su tratamiento, principalmente con Fe intravenoso(iv)5,9,12.
Objetivo
Se ha señalado que en la práctica clínica el DH en la IC crónica todavía está infradiagnosticado e infratratado9. Teniendo en cuenta la alta prevalencia de IC crónica en la población de pacientes atendidos en atención primaria, su alta complejidad y el reciente interés del DH como morbilidad independiente de la anemia, se consideró interesante valorar el grado de conocimiento y la actitud por parte de médicos de atención primaria (AP) sobre el DH en la IC.
Métodos
El estudio consistió en una encuesta online, diseñada por Grupo de Cardiovascular de la SEMG (Sociedad Española de Médicos Generales y de Familia), que fue difundida a través de correo electrónico y redes sociales para ser respondida de forma anónima y voluntaria por los médicos de AP. La encuesta se mantuvo activa durante 5 meses, de junio a octubre de 2020.
El cuestionario constaba de 43 preguntas de respuesta múltiple, que hacían referencia a filiación del médico, generalidades sobre la anemia/DH en la IC, diagnóstico y tratamiento del DH en la IC, así como abordaje multidisciplinar, seguimiento y necesidades formativas de los médicos de AP sobre el DH en IC. El objetivo de la encuesta fue valorar el grado de conocimientos y las actitudes de los médicos de AP en relación con el DH en la IC.
Se ha llevado a cabo un análisis descriptivo de todas las respuestas obtenidas. Para valorar posibles factores que pudiesen influir en las respuestas, se analizaron los resultados en función de determinados factores: sexo, grupo de edad (≤ 40 años, 41-50 años, > 50 años), años de ejercicio profesional (0-9 años, 10-19 años, 20-29 años, ≥ 30 años), ámbito de trabajo (rural, urbano) y lugar de trabajo (consulta en centro de salud de AP, Servicio de Urgencias Extrahospitalario, Urgencias hospitalarias, MIR, centro sociosanitario); se han utilizado pruebas de contraste de distribución de frecuencias. Sin embargo, los análisis mostraron interrelación entre los factores que no permitían extraer conclusiones, por lo que se ha decidido no incluir dichos resultados en este manuscrito. Los resultados de la encuesta se presentan en forma de frecuencia (N) o porcentaje (%) para las variables categóricas u ordinales y en términos de media y desviación estándar (± DE) para las variables continuas.
Resultados
Población de médicos participantes en la encuesta
Han participado 464 médicos de las 17 comunidades autónomas españolas. El 58,6 % fueron mujeres y el 41,4 % hombres. La media de edad fue de 52,79 (± 10,6) años; el grupo más numeroso fue el de mayores de 50 años (53,9 %). El 39 % refería una trayectoria profesional de ≥ 30 años, el 32,3 % de entre 20 y 29 años, el 18,3 % de entre 10 y 19 años y el 10,3 % restante de menos de 10 años. En la tabla 1 se pueden observar las características de la muestra.
Generalidades sobre anemia/DH en la IC
El 87,5 % de los encuestados reconoce el DH como una situación distinta a la anemia, aunque para la mayoría (81,9 %) su impacto en la IC es menor. El 87,1 % lo considera una comorbilidad importante pero solo el 43,5 % sabe que afecta a alrededor del 50 % de los pacientes con IC. Casi todos coinciden en que el DH puede influir en la capacidad funcional (97,2 %) y la calidad de vida (95,7 %); en cambio, un 15 % de médicos no cree que el DH influya en el pronóstico de la IC.
Diagnóstico de DH en IC
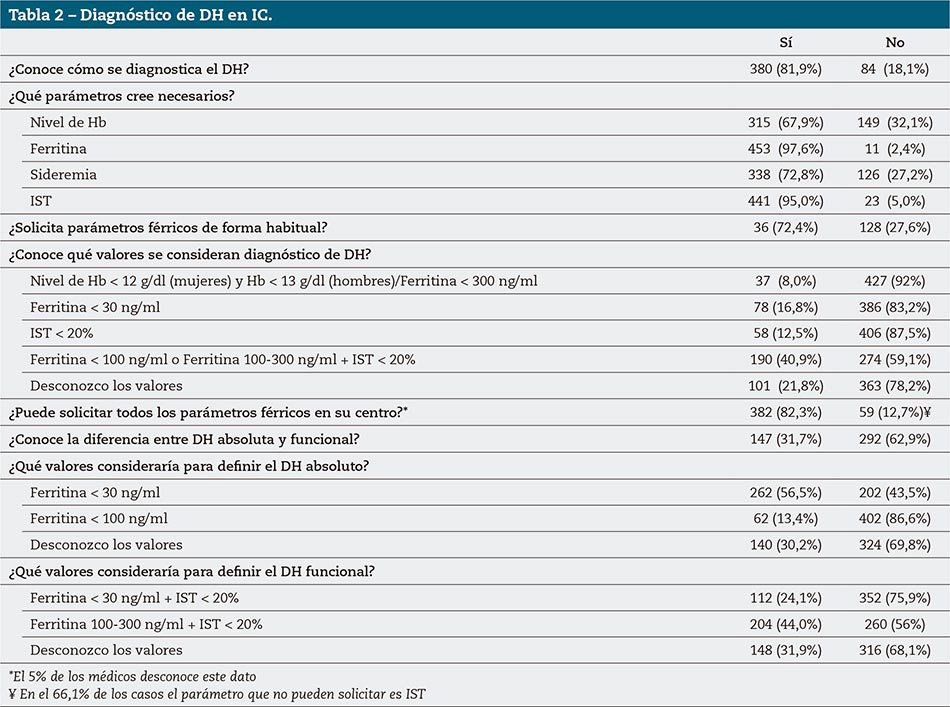
El 81,9 % afirma saber cómo se diagnostica el DH y en su mayoría identifican como parámetros necesarios la ferritina (97,6 %) y el índice de saturación de la transferrina (IST) (95,0 %); muchos también señalan la sideremia (72,8 %) y la Hb (67,9 %). Solo el 72,4 % solicita parámetros férricos (ferritina e IST) en los pacientes con IC para diagnosticar el DH de forma habitual. Respecto a los criterios diagnósticos de DH, el 40,9 % de los médicos los conoce, el 21,8 % admite que no los sabe y el resto (37,3 %) opina que los sabe, pero sus respuestas no son correctas. En general (82,3 %), los médicos pueden solicitar todos los parámetros férricos en su centro; y cuando no, el parámetro más difícil de solicitar es el IST.
El 62,9 % reconoce no saber la diferencia entre déficit absoluto y funcional de Fe. Como criterio de DH absoluto en IC, el 56,5 % de los médicos respondió ferritina < 30 ng/ml, el 13,4 % ferritina < 100 ng/ml y el 30,2 % reconoció no saberlo. Como criterio de DH funcional, el porcentaje de respuestas correctas (ferritina 100-300 ng/ml+ IST < 20 %) fue del 44 % (Tabla 2).
Tratamiento del DH en la IC
El 45,3 % reconoce como criterio para iniciar el tratamiento del DH en la IC niveles de ferritina <100 ng/ml o ferritina 100-300 ng/ml+ IST< 20 % (Tabla 3).
Aunque el 53,4 % de los médicos afirma conocer las recomendaciones de las guías clínicas, el 62,3 % refiere que iniciarían el tratamiento con Fe oral y solo el 28,4 % abordaría el DH con Fe iv. El 23,5 % cree que ambos Fe son igual de efectivos mientras que el 21,3 % lo desconoce. De los 256 médicos que respondieron que no es igual de eficaz, las causas más citadas fueron la mala absorción (85,2 %) y la mala tolerancia (80,4 %), seguidas del proceso inflamatorio asociado a la IC (77,7 %), la eficacia menor demostrada en IC (75,8 %), los problemas gastrointestinales (75,8 %) y otras patologías asociadas (73,0 %).
El 70,5 % refiere no conocer ningún documento sobre recomendaciones para el tratamiento del DH. Solo el 20,3 % conoce el consenso SEC-SEMI y 14,4 % la Guía ESC 2016. Únicamente un 13,1 % dispone en su ámbito de trabajo de un protocolo para el abordaje del DH en pacientes con IC.
El 82,1 % afirma tratar el DH en pacientes con IC indistintamente de si tienen la fracción de eyección reducida (FEr) o preservada (FEp), el 10,6 % únicamente cuando los pacientes con IC muestran una FEr, el 1,5 % solo si tienen FEp y hasta un 5,8 % considera que no es necesario tratar el DH (Tabla 3)
Respecto al beneficio del tratamiento con Fe iv, el 96,8 % considera que mejora la calidad de vida, el 94,6 % que mejora la clase funcional (NYAH) o la capacidad de ejercicio, el 92,5 % que reduce el riesgo de reingreso hospitalario y el 81,9 % que reduce el riesgo de mortalidad.
Abordaje multidisciplinar del DH en la IC
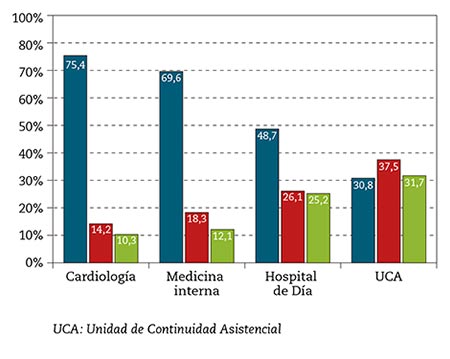
El 65 % afirma trabajar de forma conjunta con atención hospitalaria para el abordaje multidisciplinar del paciente con IC, aunque la mitad de ellos considera que dicha colaboración es insuficiente. Todos (99 %) coinciden en que la comunicación con la atención hospitalaria debe de mejorar. Cuando se diagnostica un DH en un paciente con IC, solo el 38,4 % posee un circuito de derivación claro con su centro hospitalario de referencia, que dispone como estructuras especializadas en IC principalmente los Servicios de Cardiología (75,4 %) y de medicina interna (69,3 %) (Fig. 1).
En caso de derivar a un paciente para recibir tratamiento con Fe iv, el 26,7 % lo deriva al hospital de día, el 25,6 % al Servicio de Medicina Interna, el 12,3 % a la Unidad de Continuidad Asistencial (UCA), el 9,1 % al Servicio de Cardiología, el 7,7 % a Hematología y el 4,9 % a Urgencias. Un 12,1 % de los médicos no sabe dónde debe derivar al paciente para que reciba el tratamiento de Fe iv.
Las vías de comunicación específicas más frecuentes para IC con el hospital de referencia son la e-consulta con el especialista (62,7 %), la comunicación directa con el especialista por teléfono o mail (55,6 %) y las sesiones clínicas periódicas (44,4 %) (Tabla 4).
Seguimiento del DH en IC
El 64,7 % de los médicos hace el seguimiento de la respuesta al tratamiento hospitalario de los pacientes con DH, principalmente los que tienen más años de experiencia profesional y los que trabajan en consultas de AP y centros sociosanitarios. El 87,3 % considera que este seguimiento es importante (puntuación > 8 en una escala de 0 a 10). El parámetro más utilizado para el seguimiento del DH es la ferritina (97,6 %), seguida del IST (87,7 %) y el nivel de Hb (87,9 %). El 42,2 % de los médicos solicitan estos parámetros cada 3 meses, mientras que el 36,6 % los solicita 1 o 2 veces al año.
Necesidades formativas
El 90,1 % considera que no tiene suficiente formación e información sobre el abordaje del DH en pacientes con IC y al 98,7 % le gustaría ampliar su conocimiento sobre el tema. Los métodos preferidos para ello son la formación online (89,2 %) y la información recibida a través de documentación, infografías y cuadros resumen (85,1 %).
Figura 1 – Estructuras especializadas en IC de los centros hospitalarios de referencia del médico de AP.
Comentario
Esta encuesta pone de manifiesto un conocimiento poco profundo sobre el DH en los pacientes con IC, su relevancia, cribado y abordaje desde AP. Asimismo, los resultados indican que el DH en el paciente con IC es un asunto que despierta gran interés en los médicos y que existe una demanda de formación específica para ellos sobre este tema.
La gran mayoría sabe reconocer que el DH es una entidad diferente de la anemia, aunque no le otorgan suficiente relevancia en el contexto de la IC. La diferenciación entre DH y anemia surge a partir de los resultados del ensayo clínico FAIR-HF13, que demostró que la administración de Fe iv aportaba beneficios clínicos significativos en caso de DH, independientemente de la presencia o no de anemia. Desde entonces, la acumulación de experiencias cada vez más sólidas14-17 y su reconocimiento en las guías clínicas como morbilidad independiente asociada a la IC2,12,18, han convertido el DH asociado a IC en un foco de interés creciente.
Más de la mitad de los médicos infraestiman la alta prevalencia del DH en IC y la mayoría considera que tiene menos repercusión en la IC que la anemia, incluso que no influye en el pronóstico de la enfermedad según el 15 %. El DH es común en pacientes con IC crónica y se asocia con una reducción del rendimiento en el ejercicio y de la calidad de vida, pero también, con un mayor riesgo de morbimortalidad1,5, con un aumento de la mortalidad, la hospitalización y el reingreso temprano10; incluso se ha visto que su pronóstico es peor que el de los pacientes con anemia y sin DH10.
Clásicamente, el diagnóstico del DH se ha dividido en absoluto y funcional2. En el DH absoluto hay un déficit en los depósitos de Fe, mientras que el DH funcional es el resultado de una movilización deficiente desde los sitios de almacenamiento, generalmente por mecanismos inflamatorios2. Los pacientes con ICC suelen tener inflamación crónica sistémica que ocasiona un aumento en la producción de hepcidina hepática, que bloquea la absorción de Fe y su movilización desde los depósitos5.
El criterio diagnóstico de DH más utilizado en el contexto de la IC es el recomendado en las Guías Europeas de Cardiología12, que establecen como diagnóstico de DH absoluto un valor de ferritina < 100 ng/ml, y como diagnóstico de DH funcional niveles de ferritina de entre 100 y 300 ng/ml, cuando la saturación de transferrina (ISAT) es < 20 %2,12. La ferritina refleja las reservas totales de Fe corporal y la transferrina, principal transportadora del Fe, aumenta sus concentraciones cuando falta Fe. El índice de saturación de la transferrina (IST) es el principal parámetro para calcular la disponibilidad de Fe circulante. Su disminución (< 20 %) es un marcador de DH funcional, más sensible que la ferritina para detectar DH en la IC2.
Según esta encuesta, la mayoría de los médicos saben que los parámetros para diagnosticar el DH son ferritina y IST, pero solo el 72 % los solicita de forma rutinaria; con frecuencia no aplican adecuadamente los criterios establecidos en las guías para diagnóstico, sino que se utilizan los niveles de referencia de la población general sana, sin tener en cuenta que en la IC el punto de corte es superior (100 ng/dl) por el proceso inflamatorio subyacente2,9. Asimismo, sorprende que 2 de cada 3 médicos consideren necesarias también la sideremia y la Hb para detectar el DH, cuando el DH se encuentra en más de 30 % de pacientes con IC sin anemia10.
El tratamiento del DH en IC consiste en la terapia de reposición de Fe para ambas formas de DH9. Sin embargo, la utilización de Fe oral parece ser ineficaz en los pacientes con IC19 mientras que la terapia con Fe iv ha demostrado su eficacia y actualmente es la recomendada en las guías europeas de IC (ESC 2016)12. Permite restablecer las reservas con independencia de los mecanismos de bloqueo de la hepcidina y puede administrarse a dosis más altas, por lo que corrige el DH de manera rápida21. El Fe carboximaltosa (HCM) intravenoso es el más estudiado y con más experiencias en IC. Puede administrarse en infusión o en bolus, ambulatoriamente (hospital de día)9 y resulta coste-efectivo en términos de años de vida ajustados por calidad de vida2, principalmente por la mejora en la clase funcional NYHA y la reducción de la tasa de hospitalizaciones10. Ensayos como el FAIR-HF13, el CONFIRM-HF14 y EFFECT-HF15, demuestran la superioridad de la terapia con HCM, con mejoras significativas de la clase funcional NYHA, la Evaluación global del paciente (Patient Global Assessment, PGA), la prueba de la marcha de 6 minutos (PM6M), la calidad de vida y la puntuación de fatiga. También los metaanálisis posteriores16,17 confirman sus beneficios, no solo por la mejora en la calidad de vida, clase funcional y capacidad de ejercicio, sino también por la reducción de hospitalizaciones (59 % menos hospitalizaciones recurrentes por IC y reducción de hasta un 41 % la mortalidad y hospitalizaciones de causa cardiovascular)17. Más recientemente, otro ensayo ha demostrado que también en los pacientes con episodio agudo de IC que presentan DH, la administración de HCM antes del alta hospitalaria reduce significativamente el riesgo de reingresos en un 26 %22. Según nuestra encuesta, pocos médicos de AP conocen las recomendaciones de las guías y casi ninguno (solo 1 de cada 10) dispone de protocolos de actuación para el abordaje del DH en pacientes con IC. Así, aunque aproximadamente la mitad afirma conocer las recomendaciones y reconocen muchos de los beneficios del tratamiento con Fe iv en pacientes con ICC y DH13,14,23, todavía hay médicos que consideran que el Fe oral es igual de efectivo que el Fe iv, y un porcentaje no desdeñable afirman que iniciarían la reposición de los depósitos de Fe por vía oral.
Cabe señalar que actualmente existe poca colaboración entre los médicos de AP y los centros hospitalarios para el abordaje multidisciplinar del paciente con IC. Solo 2 de cada 3 médicos de AP trabaja juntamente con atención hospitalaria de su zona y solo en el 38 % de casos disponen de un circuito de derivación claro cuando se diagnostica un DH en un paciente con IC.
En cuanto al seguimiento del DH tras el tratamiento, aunque en general los médicos de AP opinan que es un tema relevante, solo un 40 % de los médicos realiza controles cada 3 meses, de acuerdo con lo que recomiendan las guías. Otra cuestión a tener en cuenta en el seguimiento es la posibilidad de infra dosificación, que puede ser común si consideramos que la dosis de HCM se limita a 1 g por administración, sin corrección por peso corporal o valores de Hb24.
Como conclusión, los datos registrados mediante este cuestionario online han desvelado que existe un bajo nivel de conocimiento por parte de los médicos generales y de familia sobre la alta prevalencia, las consecuencias clínicas, el diagnóstico y el abordaje del DH en los pacientes con IC. Asimismo, no se conocen y aplican las guías actuales sobre IC2,12. El tratamiento del DH en IC tampoco es un tema suficientemente conocido, ya que la mayoría no sabe que el Fe oral en estos pacientes no es eficaz y que el tratamiento recomendado es el Fe iv, principalmente el HCM. Por otro lado, también destaca una falta de protocolización y coordinación entre la AP y la hospitalaria, necesaria para optimizar el abordaje de estos pacientes.
Las principales limitaciones de este estudio son que, si bien se ha contado con la participación de médicos de todas las comunidades autónomas, no podemos garantizar que sean representativos de la población global de médicos generales y de familia, ni por zona geográfica, ni por características de los participantes.
Fuente de financiación
Esta encuesta se ha realizado con el apoyo económico de laboratorios Vifor Pharma.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Kang CK, Pope M, Lang CC, Kalra PR. Iron deficiency in heart failure: Efficacy and safety of intravenous iron therapy. Cardiovasc Ther. 2017;35: e12301.
- Manito N, Cerqueiro JM, Comín-Colet J, García-Pinilla JM, González-Franco A, Grau-Amorós J, et al. Consensus Document of the Spanish Society of Cardiology and the Spanish Society of Internal Medicine on the diagnosis and treatment of iron deficiency in heart failure. Rev Clin Esp. 2017; 217: 35-45.
- Bakogiannis C, Briasoulis A, Mouselimis D, Tsarouchas A, Papageorgiou N, Papadopoulos C, et al. Iron deficiency as therapeutic target in heart failure: a translational approach. Heart Fail Rev. 2020; 25: 173-82.
- Zhou B, Tian R. Mitochondrial dysfunction in pathophysiology of heart failure. J Clin Invest. 2018; 128: 3716-26.
- McDonagh T, Damy T, Doehner W, Lam CSP, Sindone A, Van der Meer P, et al. Screening, diagnosis and treatment of iron deficiency in chronic heart failure: putting the 2016 European Society of Cardiology heart failure guidelines into clinical practice. Eur J Heart Fail. 2018; 20: 1664-72.
- Klip IT, Comin-Colet J, Voors AA, Ponikowski P, Enjuanes C, Banasiak W, et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J. 2013; 165: 575-82.e3.
- Cleland JG, Zhang J, Pellicori P, Dicken B, Dierckx R, Shoaib A, et al. Prevalence and Outcomes of Anemia and Hematinic Deficiencies in Patients with Chronic Heart Failure. JAMA Cardiol. 2016; 1: 539-47.
- Nanas JN, Matsouka C, Karageorgopoulos D, Leonti A, Tsolakis E, Drakos SG, et al. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol. 2006; 48: 2485-9.
- Lam CSP, Doehner W, Comin-Colet J; IRON CORE Group. Iron deficiency in chronic heart failure: case-based practical guidance. ESC Heart Fail. 2018; 5: 764-71.
- Rocha BML, Cunha GJL, Menezes Falcão LF. The Burden of Iron Deficiency in Heart Failure: Therapeutic Approach. J Am Coll Cardiol. 2018; 71: 782-93.
- Toblli JE, Lombraña A, Duarte P, Di Gennaro F. Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol. 2007; 50: 1657-65.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure. Rev Esp Cardiol (Engl Ed). 2016; 69: 1167.
- Anker SD, Comin Colet J, Filippatos G, Willenheimer R, Dickstein K, Drexler H, et al; FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009; 361: 2436-48.
- Ponikowski P, Van Veldhuisen DJ, Comin-Colet J, Ertl G, Komajda M, Mareev V, et al; CONFIRM-HF Investigators. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency†. Eur Heart J. 2015; 36: 657-68.
- Van Veldhuisen DJ, Ponikowski P, Van der Meer P, Metra M, Böhm M, Doletsky A, et al; EFFECT-HF Investigators. Effect of Ferric Carboxymaltose on Exercise Capacity in Patients with Chronic Heart Failure and Iron Deficiency. Circulation. 2017; 136: 1374-83.
- Kapoor M, Schleinitz MD, Gemignani A, Wu WC. Outcomes of patients with chronic heart failure and iron deficiency treated with intravenous iron: a meta-analysis. Cardiovasc Hematol Disord Drug Targets. 2013; 13: 35-44.
- Anker SD, Kirwan BA, Van Veldhuisen DJ, Filippatos G, Comin-Colet J, Ruschitzka F, et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail. 2018; 20: 125-33.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Colvin MM, et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017; 136: e137-61.
- Lewis GD, Malhotra R, Hernandez AF, McNulty SE, Smith A, Felker GM, et al; NHLBI Heart Failure Clinical Research Network. Effect of Oral Iron Repletion on Exercise Capacity in Patients with Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRONOUT HF Randomized Clinical Trial. JAMA. 2017; 317: 1958-66.
- Bregman DB, Morris D, Koch TA, He A, Goodnough LT. Hepcidin levels predict nonresponsiveness to oral iron therapy in patients with iron deficiency anemia. Am J Hematol. 2013; 88: 97-101.
- McDonagh T, McDougall IC. Iron therapy for the treatment of iron deficiency in chronic heart failure: intravenous or oral? Eur J Heart Fail. 2015; 17: 248-62.
- Ponikowski P, Kirwan BA, Anker SD, McDonagh T, Dorobantu M, Drozdz J, et al; AFFIRM-AHF investigators. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lancet. 2020; 396: 1895-904.
- Comín-Colet J, Enjuanes C, González G, Torrens A, Cladellas M, Meroño O, et al. Iron deficiency is a key determinant of health-related quality of life in patients with chronic heart failure regardless of anaemia status. Eur J Heart Fail. 2013; 15: 1164-72.
- Martens P, Minten L, Dupont M, Mullens W. The importance of dose optimisation in the treatment of iron deficiency in heart failure. Acta Cardiol. 2020; 75: 520-4.