Clínica Cotidiana
Información del artículo
Historia del artículo:
Recibido el 22 de julio de 2019
Aceptado el 10 de noviembre de 2019
On-line el 31 de enero de 2020
Palabras clave:
Páncreas
Cáncer
Insuficiencia pancreática
Desnutrición
Enzimas
*Autor para correspondencia
Correo electrónico:
vovejerohcas@msn.com
(V. J. Ovejero Gómez).
Keywords:
Pancreas
Cancer
Pancreatic failure
Malnutrition
Enzymes
Víctor Jacinto Ovejero Gómeza,*, María Victoria Bermúdez Garcíaa, Luiza Cotrutaa, Álvaro Pérez Martínb
aServicio de Cirugía. Hospital Sierrallana. bCentro de Salud Isabel II. Santander. Cantabria.
Resumen
El cáncer de páncreas es uno de los tumores digestivos con peor pronóstico por su agresividad biológica y el escaso número de pacientes susceptibles de resección en el momento del diagnóstico. La malnutrición es un factor de riesgo independiente de complicaciones y mortalidad postoperatoria en pacientes con indicación quirúrgica de duodenopancreatectomía radical. Esta malnutrición suele producirse a partir de la insuficiencia pancreática que acompaña a la enfermedad y manifestarse antes del diagnóstico en forma de pérdida de peso, astenia y anorexia, que conducen progresivamente a una caquexia terminal. La diabetes de reciente aparición supone otro signo de fracaso glandular.
Un manejo adecuado de esta insuficiencia a partir de las primeras manifestaciones de la enfermedad representa la piedra angular no sólo para reducir las complicaciones postquirúrgicas y la mortalidad hospitalaria sino también para mejorar la calidad de vida y supervivencia global de estos pacientes.
La estrategia de tratamiento actual basada en insulina y enzimas de sustitución supone un impacto positivo en la supervivencia de los pacientes con cáncer de páncreas, especialmente en los sometidos a una resección curativa.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Approach to pancreatic insufficiency in a cancer patient subjected to duodenopancreatectomy
Abstract
Pancreatic cancer is one of the worst prognostic digestive tumors due to its biological aggressiveness and the small number of candidates for surgical resection at diagnosis. Malnutrition is an independent risk factor for complications and postoperative mortality in patients with radical duodenopancreatectomy indication. This phenomenon is usually a consequence of the pancreatic failure derived from the disease and appears before diagnosis in the form of weight loss, asthenia and anorexia, which lead progressively to a terminal cachexia. Newly emerging diabetes is another symptom of glandular failure.
A properly management of this disorder from the beginning of disease means the cornerstone both reducing postsurgical complications and hospital mortality, improving the quality of life and overall survival of these patients.
Current treatment approach based on insulin and pancreatic enzymes has got a positive impact on the survival of patients with pancreatic cancer, especially in those undergoing curative resection.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Varón de 63 años de edad, sin alergias medicamentosas, fumador de 20 cigarrillos al día, con antecedentes de hipertensión arterial en tratamiento con valsartán e hidroclorotiazida (320/12,5 mg, 1 comprimido diario), ulcus péptico y apendicectomía en la infancia.
Consulta por aparición de ictericia cutánea progresiva en las dos últimas semanas. La anamnesis revela una pérdida de peso en los meses previos que atribuye a una cierta inapetencia y excesivo trabajo en su puesto laboral.
La analítica urgente no muestra alteraciones relevantes, a excepción de una discreta elevación de la ALT. En la ecografía abdominal se visualiza una dilatación de la vía biliar asociada a distensión vesicular sin aparente relación con patología litiásica.
El paciente ingresa para completar estudios diagnósticos. En la analítica completa se objetiva un perfil hepático alterado con bilirrubina total 10,2 mg/dl, bilirrubina directa 8,5 mg/dl, AST 112 mU/ml, ALT 187 mU/ml, fosfatasa alcalina 775 mU/ml, GGT 1130 mU/ml y glucemia 157 mg/dl. El resto de parámetros bioquímicos, incluida la función renal, se encuentran dentro de la normalidad.
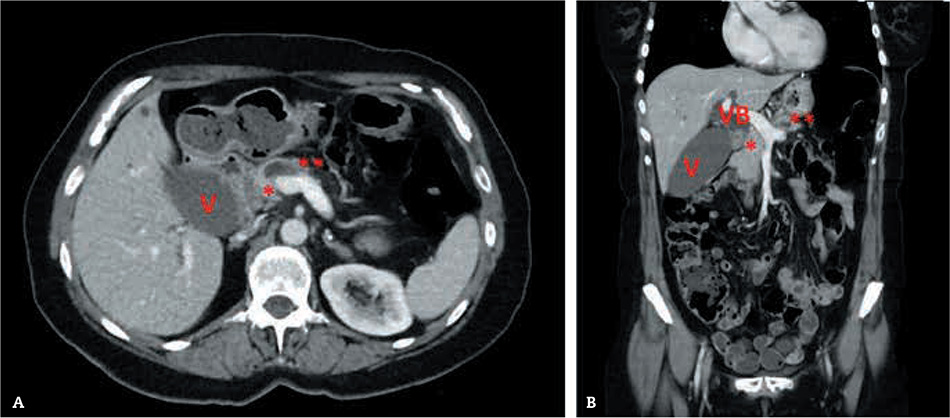
En la tomografía computarizada abdominal se correlacionan los hallazgos ecográficos con una tumoración de la cabeza pancreática que también dilata el conducto de Wirsung (Fig. 1).
La biopsia dirigida por ecoendoscopia es negativa para malignidad.
Se propone intervención quirúrgica efectuándose una valoración nutricional previa que estima una pérdida ponderal del 21 % en los 6 meses anteriores al ingreso.
Se pautan complementos dietéticos hiperproteicos e hipercalóricos para diabéticos hasta la realización de una duodenopancreatectomía cefálica con linfadenectomía radical y reconstrucción tipo Child.
El diagnóstico histopatológico es de adenocarcinoma pancreático con afectación de dos adenopatías peripancreáticas y permeación perineural (pT2pN1M0 – estadio IIB).
En el postoperatorio se administra nutrición parenteral total complementada con 4 unidades de insulina y 6 mg de somatostatina diarios, hasta lograr un adecuado aporte nutricional oral.
No se producen complicaciones postquirúrgicas. Es dado de alta hospitalaria en espera de quimioterapia adyuvante. Se pauta tratamiento con dieta blanda pobre en grasas con suplementación enteral polimérica, hiperproteica y normocalórica con fibra (dos batidos diarios de 250 ml), insulina subcutánea (10 U diarias) y enzimas pancreáticas (50.000 U cada 8 horas con las principales comidas).
En los seis siguientes meses las revisiones oncológicas se llevan a cabo con apoyo de la enfermera nutricionista.
La primera visita se produce a los 7 días del alta hospitalaria. El paciente refiere plenitud postprandial y una media de dos deposiciones diarreicas diarias.
Es citado con un control analítico y la misma pauta terapéutica un mes después. En este tiempo, no presenta ganancia ponderal, aunque sí un mayor número de deposiciones semilíquidas. Refiere mayor apetito y una restauración parcial de su estado general previo. En las primeras horas de la mañana suele encontrarse algo mareado.
La analítica presenta hemoglobina 10,2 gr/dl y glucemia 67 mg/dl. Los parámetros nutricionales se encuentran dentro del rango de la normalidad.
Se propone progresar en la dieta oral, suspensión de los suplementos nutricionales, reducir la pauta de insulina a 8 U diarias e incrementar la dosis de enzimas pancreáticas en dos cápsulas, una al mediodía y otra a media tarde.
Se realizan diversas valoraciones en los meses posteriores. Presenta normalización de los parámetros nutricionales y del tránsito intestinal con una ganancia ponderal de 4 kg. No presenta signos radiológicos de recurrencia tumoral.
Figura 1 – Visión axial (A) y coronal (B) de la TC abdominal donde se pone de manifiesto la vesícula (V) y vía biliar (VB) dilatadas debido a un tumor de cabeza pancreática que impronta en el eje venoso mesentericoportal (*) y condiciona una dilatación del conducto de Wirsung (**) sobre la confluencia portal de las venas esplénica y mesentérica.
Comentario
El cáncer de páncreas es uno de los tumores abdominales con peor pronóstico. Su diagnóstico suele realizarse en estadios avanzados.
La resección quirúrgica es considerada el tratamiento curativo de elección con apoyo de la radioquimioterapia adyuvante. La mayoría de las series quirúrgicas presentan tasas de resecabilidad de 15-20 %. La supervivencia global no supera el 20 % a los cinco años, aunque los márgenes de resección hubieran sido negativos1,2.
Suele acompañarse de elevados porcentajes de desnutrición calórico-proteica, relacionados con un excesivo catabolismo3 por la propia agresividad de la enfermedad. Por otro lado, estos enfermos habitualmente sufren las consecuencias clínicas derivadas de la insuficiencia pancreática endocrina y exocrina experimentadas en el transcurso evolutivo de la enfermedad.
La desnutrición afecta a más de tres cuartos de los pacientes4 pero no siempre se acompaña de caquexia. Este factor es de gran importancia a la hora de decidir sobre la indicación quirúrgica pero también resulta trascendental en el resultado de cualquier tratamiento adyuvante y en la tasa de supervivencia al cáncer. La apariencia de un estado nutricional normal, como fue nuestro caso, no descarta una desnutrición subyacente por lo que debe realizarse una analítica con perfil nutricional en previsión de una actuación específica antes de la intervención quirúrgica, en forma de suplementos nutricionales orales o nutrición parenteral. Consideramos que esta segunda forma también es fundamental en el postoperatorio inmediato hasta asegurar una adecuada ingesta oral (Fig. 2).
La caquexia empeora el pronóstico y aumenta el riesgo de complicaciones quirúrgicas siendo imposible su reversibilidad una vez instaurada5. Estas circunstancias motivan que nuestro grupo recomiende complementar la dieta oral de forma sistemática en presencia de cualquier signo de desnutrición.
Figura 2 – Algoritmo de actuación perioperatoria en previsión de una insuficiencia pancreática secundaria a cáncer de páncreas potencialmente resecable.
Las complicaciones postquirúrgicas graves, como la hemorragia, la fístula anastomótica o el retraso del vaciamiento gástrico, son factores que también pueden contribuir a la inestabilidad metabólica por acentuación del deterioro prediagnóstico6.
El apoyo nutricional postoperatorio se debe realizar de una forma individualizada dependiendo de las condiciones basales y del tipo de tratamiento adyuvante previsto. Inicialmente, se recomienda complementar la ingesta con suplementos enterales en mayor o menor cuantía según tolerancia ya que pueden ocasionar sensación de plenitud postprandial, distensión abdominal y diarrea. Existen fórmulas enterales con fibra capaces de prevenir dicha diarrea pero no debemos olvidar que también pueden producirse por la propia insuficiencia pancreática acompañante.
Esta insuficiencia se relaciona con un defecto en la síntesis enzimática en el páncreas, consecuencia de la propia resección quirúrgica o del deterioro funcional del remanente glandular, o bien con alteraciones en la activación enzimática. Un inicio preoperatorio suele traducir una atrofia fibrótica del parénquima por el tumor manifestada por una desnutrición, de origen malabsortivo, que acentúa la motivada por el proceso oncológico.
Su diagnóstico ambulatorio suele resultar complejo por lo que en la práctica puede asumirse ante diarreas esteatorreicas mantenidas, dolor abdominal, hinchazón o flatulencia. No obstante, en muchos casos la enfermedad puede pasar desapercibida en ausencia de sospecha clínica porque estos enfermos son capaces de adaptar su dieta a los síntomas que experimentan. Esta circunstancia no excluye la indicación de tratamiento ya que las alteraciones secundarias repercuten en la función de muchos micronutrientes fundamentales para la homeostasis del organismo7. Algunos estudios diagnósticos han correlacionado el déficit enzimático con la supervivencia de la enfermedad8,9.
Si estimamos que este tipo de insuficiencia pancreática genera una limitación en la calidad de vida, atribuible a la pérdida de peso y caquexia asociadas, y que dicho déficit enzimático es un factor independiente de peor supervivencia, el beneficio potencial de su tratamiento resulta incuestionable9,10, advirtiéndose una mayor tasa de supervivencia, con significación estadística, no sólo en los pacientes resecados sino también con enfermedad metastásica. El tratamiento enzimático de sustitución, más allá de controlar la sintomatología, persigue regularizar el estado nutricional11,12. La dosis habitual mínima en cáncer suele ser de 75.000 U en cada comida principal y 50.000 U por cada ingesta adicional13. En nuestro paciente probablemente se hubiera evitado una parte de la sintomatología con una pauta inicial mayor a la prescrita. Es importante realizar un seguimiento estrecho del paciente para asegurar una correcta adherencia al tratamiento y descartar otras causas de fracaso terapéutico como una dosis insuficiente, focos de sobrecrecimiento bacteriano o la existencia de un pH intestinal menor de 5, que impide la actuación de las enzimas pancreáticas.
De forma concomitante es frecuente la presencia de diabetes mellitus tipo IIIC, que muchas veces aparece como preámbulo diagnóstico relacionado con un deterioro funcional de la glándula por afectación neurohormonal o pérdida parenquimatosa14. No obstante, esta diabetes puede aparecer con posterioridad a la resección quirúrgica por una atrofia glandular progresiva, el efecto local del tratamiento radioquimioterápico o bien por la propia progresión de la enfermedad. Su mal control clínico es debido a un déficit de insulina y glucagón, que exige la administración de insulina exógena como tratamiento de elección, ya que su acción anabólica puede contrarrestar los efectos de la desnutrición y otras complicaciones sistémicas.
En conclusión, la malnutrición por insuficiencia pancreática y la diabetes acompañante son dos fenómenos frecuentes en el cáncer de páncreas. Su tratamiento precoz y mantenido mediante enzimas de sustitución e insulina exógena en el postoperatorio representan las piedras angulares terapéuticas al modificar la historia natural de la enfermedad proporcionando una mejor calidad de vida y una mayor supervivencia.
La creación de protocolos de actuación consensuados y de carácter multidisciplinar, tanto preoperatorios como postoperatorios, pueden contribuir a mejorar el pronóstico de la enfermedad.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Kuhlmann KF, de Castro SM, Wesseling JG, Ten Kate FJ, Offerhaus GJ, Busch OR, et al. Surgical treatment of pancreatic adenocarcinoma: actual survival and prognostic factors in 343 patients. Eur J Cancer. 2004; 40: 549-58.
- Toesca DAS, Koong AJ, Poultsides GA, Visser BC, Haraldsdottir S, Koong AC, et al. Management of borderline resectable pancreatic cancer. Int J Radiat Oncol Biol Phys. 2018; 100: 1155-74.
- Buscemi S, Damiano G, Palumbo VD, Spinelli G, Ficarella S, Lo Monte G, et al. Enteral nutrition in pancreaticoduodenectomy: A literature review. Nutrients. 2015; 7: 3154-65.
- Santarpia L, Contaldo F, Pasanisi F. Nutritional screening and early treatment of malnutrition in cancer patients. J Cachexia Sarcopenia Muscle. 2011; 2: 27-35.
- Muscarotoli M, Anker SD, Argilés J, Aversa Z, Bauer JM, Biolo G, et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special Interest Groups (SIG) “cachexia-anorexia in chronic wasting diseases” and “nutrition in geriatrics”. Clin Nutr. 2010; 29: 154-9.
- Herrera-Cabezón FJ, Sánchez-Acedo P, Zazpe-Ripa C, Tarifa-Castilla A, Lera-Tricas JM. Quality standards in 480 pancreatic resections: a prospective observational study. Rev Esp Enferm Dig. 2015; 107: 143-51.
- Sikkens EC, Cahen DL, Koch AD, Braat H, Poley JW, Kuipers EJ, et al. The prevalence of fat-soluble vitamin deficiencies and decreased bone mass in patients with chronic pancreatitis. Pancreatology. 2013; 13: 238-42.
- Domínguez-Muñoz JE, Hardt P, Lerch MM, Löhr MJ. Potential for Screening for pancreatic exocrine insufficiency using the fecal elastase-1 test. Dig Dis Sci. 2017; 62: 1119-30.
- Partelli S, Frulloni L, Minnniti C, Bassi C, Barugola G, D’Onofrio M, et al. Faecal elastase-1 is an independent predictor of survival in advanced pancreatic cancer. Dig Liver Dis. 2012; 44: 945-51.
- Gooden HM, White KJ. Pancreatic cancer and support care-pancreatic exocrine insufficiency negatively impacts on quality of life. Support Care Cancer. 2013; 21: 1835-41.
- Roberts KJ, Bannister CA, Schrem H. Enzyme replacement improves survival among patients with pancreatic cancer: results of a population-based study. Pancreatology. 2019; 19: 114-21.
- Gianotti L, Besselink MG, Sandini M, Hackert T, Conlon K, Gerritsen A, et al. Nutritional support and therapy in pancreatic surgery: A position paper of the International Study Group on Pancreatic Surgery (ISGPS). Surgery. 2018; 164: 1035-48.
- De Madaria E, Abad-González A, Aparicio JR, Aparisi L, Boadas J, Boix E, et al. The Spanish Pancreatic Club´s recommendations for the diagnosis and treatment of chronic pancreatitis: part 2 (treatment). Pancreatology. 2013; 13: 18-28.
- Ewald N, Bretzel RG. Diabetes mellitus secondary to pancreatic diseases (Type 3c) – are we neglecting an important disease? Eur J Intern Med. 2013; 24: 203-6.