Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 15 de marzo de 2019
Aceptado el 28 de abril de 20197
On-line el 25 de julio de 2019
Palabras clave:
Vitamina D
(Pro) Hormona D
Atención Primaria
Endocrinología y Metabolismo
Suplementación
*Autor para correspondencia
Correo electrónico:
jcucalona@semg.es
(J.M. Cucalón Arenal).
Keywords:
Vitamin D
(Pro) Hormone D
Primary Care
Endocrinology and Metabolism
Supplementation
José Manuel Cucalón Arenal*, María Guadalupe Blay Cortés, Jesús Zumeta Fustero, Vicente Blay Cortés
Grupo de Trabajo de Endocrinología, Metabolismo y Nutrición de la SEMG.
Resumen
La mal llamada vitamina D está de actualidad debido a varios factores, como son la alta prevalencia de déficit poblacional detectada, máxime en determinada población en riesgo, el mejor conocimiento de sus funciones orgánicas y no solo del metabolismo fosfo-cálcico clásico, la creciente prescripción de este elemento por los facultativos así como el aumento de solicitudes analíticas que se están produciendo con el consiguiente aumento del gasto y la llamada de atención de la EMEA (agencia del medicamento) sobre la posible toxicidad de la prescripción no adecuadamente pautada. Esta situación nos ofrece la oportunidad de actualizar su conocimiento con el fin de tomar las mejores decisiones posibles en su manejo clínico diario. Se realiza una revisión que pretende ofrecer algo de luz a la espera de resultados más concluyentes y definitivos en la investigación que despejen las dudas o rellenen las lagunas que ahora pueden existir.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Update in cholecalciferol treatment in hypovitaminosis D in primary care
Abstract
The so-called Vitamin D deficit is currently due to several factors such as the high prevalence of population deficit detected, particularly in a certain risk population, the better knowledge of its organic functions and not only of the classic calcium phosphorus metabolism, the growing prescription of this element by the medical professionals and the increase of analytic requests that is occurring with the consequent increase in cost and attention called to it by the EMEA (drug medical agency) to the possible toxicity of a prescription that is not adequately prescribed. This situation offers us the opportunity to update knowledge on it in order to make better possible decisions on its daily clinical management. A review is done that offers some knowledge while awaiting more conclusive and definitive research that clarifies the doubts and fills the gaps that may now exist.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Ha sido en este último milenio cuando más estudios se están publicando sobre la hasta ahora conocida como vitamina D o colecalciferol, en parte por su implicación en numerosos sistemas y funciones orgánicas fuera del tradicional y bien comprobado papel en el metabolismo fosfocálcico. Además, el propio nombre de vitamina se ha puesto en cuestión, pues, si una vitamina es un compuesto que el organismo requiere como nutriente en pequeñas cantidades por no poder sintetizarlo, no es el caso de la vitamina D, pues se puede sintetizar gracias a la exposición solar, por lo que se debería considerar una prohormona.
El déficit de vitamina u hormona D ha supuesto un área de conocimiento que ha sufrido en los últimos años un enorme empuje, tanto en cuanto a investigación como a docencia, que amplía la utilidad de su conocimiento en la clínica práctica de la medicina general. Se ha comprobado su papel de hormona en varios procesos enzimáticos, metabólicos, fisiológicos y fisiopatológicos relacionados con muchos órganos y sistemas del organismo.
Las dudas que se plantean sobre si la exposición solar es suficiente o no para poder mantener unos niveles aceptables y suficientes para atender los numerosos procesos fisiológicos en los que intervienen el colecalciferol y sus derivados en nuestro organismo, máxime cuando dicha exposición depende de tantos factores y variables, han producido un aluvión de información sobre la necesidad de suplementación de dicho compuesto químico así como de sus niveles óptimos en sangre, sus niveles de deficiencia o insuficiencia y su dosificación en la suplementación. Las numerosas presentaciones de vitamina D, dosis, formas de tratar en diferentes situaciones clínicas y la necesidad o no de controles analíticos periódicos hacen más complejo el abordaje de esta deficiencia. Este arsenal de información debe ser tamizado para poder proponer unas recomendaciones prácticas al médico de familia que es, a la postre, el actor principal que deberá abordar esta situación clínica en la población.
Nos parece ilustrativo mencionar, a modo de ejemplo, una noticia aparecida en el portal Nutri-Facts (todo sobre vitaminas y más) que en 2013-14 se hacía eco de la enorme diferencia de regímenes terapéuticos que los médicos franceses prescribían en torno a la vitamina D. En dicho artículo se mencionaba que el 81,6 % de los pacientes había recibido una alta dosis de vitamina D en administración única (dosis de choque), el 12 % una dosis mixta (choque y diaria) y solo el 6,3 % una dosis diaria. Las dosis de choque varían entre las 100.000 y 200.000 UI. La mayoría de las dosis de choque se utilizaron en mujeres (93 %) y en mayores. Por último, hay que indicar que más del 50 % de los pacientes no recibieron terapia de mantenimiento. Este artículo muestra la gran variabilidad que se ha dado en el tratamiento de la deficiencia de vitamina D y que puede suponer un riesgo para nuestros pacientes.
Así mismo, y por lo reciente de su publicación, debemos mencionar el editorial de López García-Franco y cols., que la revista Atención Primaria ha publicado en el primer número de este año 2019 y que se referencia en último lugar. La crítica nunca es enemiga de la ciencia45.
Este artículo solo pretende, pues, acercar la información más reciente al médico de atención primaria y ofrecerle una actualización y propuesta básica de abordaje de esta situación clínica tan peculiar. Como todo nuestro bagaje de conocimiento, está y estará supeditado a la revisión constante con la aportación de los numerosos estudios de investigación que están en marcha y que irán viendo la luz en los próximos años.
¿Qué es la vitamina D?
Es una vitamina liposoluble, de estructura molecular esteroidea, derivada del colesterol; en su forma activa es capaz de intervenir en la regulación de la actividad de múltiples líneas celulares. Su actividad viene determinada por la presencia en estas células de receptores para la vitamina D (VDR por sus siglas en inglés). Recientemente se ha puesto de manifiesto la presencia de VDR en casi todos los tejidos humanos capaces de regular la expresión de múltiples genes1.
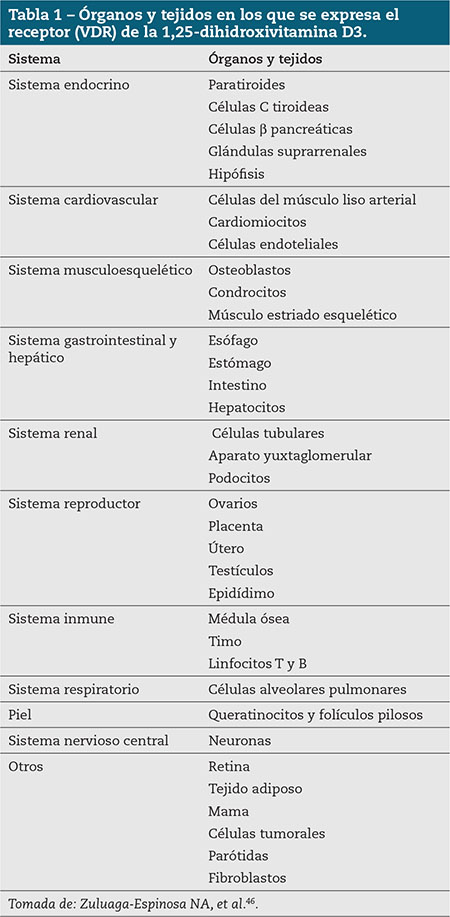
Esta enorme dispersión de receptores hace que la actividad biológica no se centre solo en la regulación del metabolismo fosfocálcico, sino que se trate de un sistema mucho más complejo, que interviene en procesos de síntesis y liberación de hormonas, regulación de funcionalidad del sistema inmune o en procesos de proliferación y diferenciación celular, entre otros (Tabla 1)2.
Vitamina D: ¿de dónde la obtenemos?
Más del 90 % de la vitamina D3 (colecalciferol) de nuestro organismo es sintetizada en la piel a partir de la exposición solar. En España, a pesar de residir en uno de los países más soleados de Europa, la latitud en la que nos encontramos (por encima del paralelo 35 N), el sedentarismo, la escasa exposición al sol y el uso de fotoprotectores constituyen factores que reducen drásticamente la síntesis fisiológica de vitamina D3 (ver más adelante)1,3.
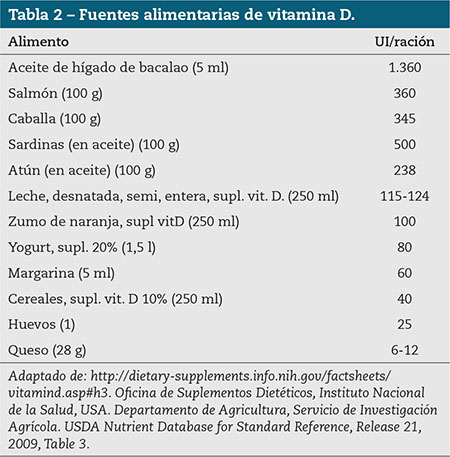
Podemos plantearnos obtenerla a través de la dieta; desafortunadamente muy pocos alimentos contienen vitamina D (Tabla 2) y los alimentos que la contienen, al no ser de consumo habitual, no aportan la cantidad suficiente como para alcanzar la ingestión diaria recomendada (IDR) en población adulta (unas 800 UI/día de colecalciferol)1,3.
Por otro lado, terapias farmacológicas como los glucocorticoides, anticonvulsivantes, antirretrovirales, entre otros, que aumentan su catabolismo, y condiciones como la obesidad, la malabsorción intestinal, la insuficiencia renal o hepática, y otras, reducen drásticamente la biodisponibilidad fisiológica de la vitamina D3 (ver más adelante)1,3.
Diferentes formas de vitamina D: ¿cuál es la fisiológica?
Cuando hablamos de vitamina D de forma genérica nos referimos tanto a la vitamina D3 (colecalciferol) como a la vitamina D2 (ergocalciferol): la primera, sustrato fisiológico de base en el ser humano y animales, recomendada por las Sociedades Científicas y formada en la piel a partir de la absorción de la radiación ultravioleta (UV) por el 7-dehidrocolesterol; la segunda, de origen vegetal, obtenida a partir de los hongos y plantas tras la exposición de los rayos UV sobre el esteroide ergosterol de las mismas, pero que no se comercializa en España como medicamento1.
Desde una perspectiva evolutiva, la vitamina D es un avance remoto. El fitoplancton y el zooplancton que existen en los océanos desde hace 500 millones de años producen vitamina D cuando se exponen al sol4.
El precursor provitamina D (ergosterol o 7-dehidrocolesterol) está incorporado en la bicapa lipídica de la membrana plasmática. Durante el proceso de producción de la pre-vitamina D, debido a la exposición a la radiación UV B solar, su anillo se abre y se convierte en una estructura menos rígida, que proporciona a la membrana una mayor permeabilidad a diversos iones, incluido el calcio. Esta puede ser la causa por la que la vitamina D se ha mantenido tan importante en la regulación del metabolismo del calcio y en última instancia en la evolución de las formas vivas para desarrollar endoesqueletos y aventurarse a la vida en la tierra4.
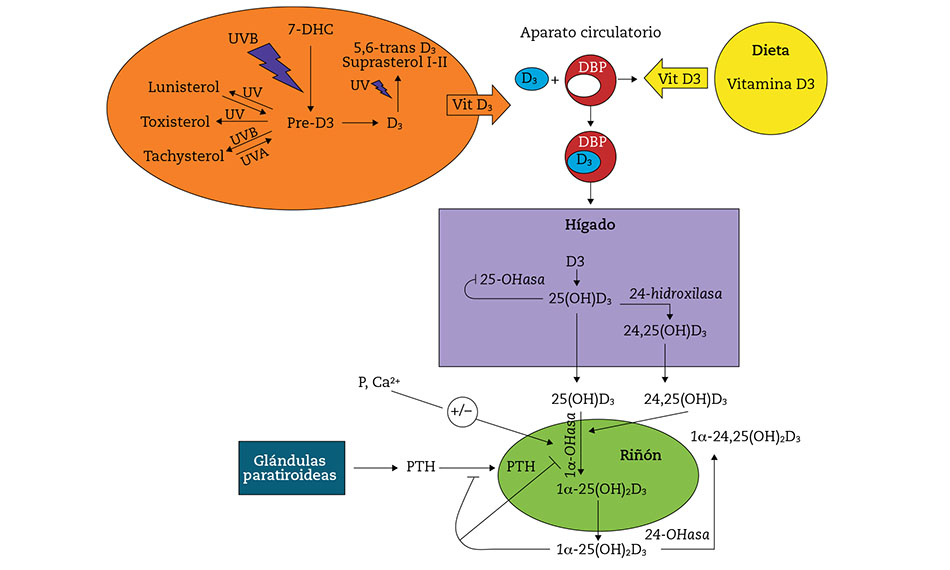
El colecalciferol y el ergosterol no son las únicas moléculas originadas a partir de sus predecesores esteroides mediante la activación termoquímica por los rayos UV tipos A y B. También se forman otras moléculas no activas, como lumisterol y taquisterol u otras; así se regula mediante un sistema de feed back la síntesis de provitamina D activa (Fig. 1).
La ruta metabólica de síntesis endógena está perfectamente descrita. Se inicia, como hemos mencionado, en la piel por acción de la radiación UV sobre el 7-dehidrocolesterol, que da lugar a la vitamina D3 o colecalciferol, fuente principal y molécula base de toda la vía metabólica. Transportada en la sangre por una proteína fijadora de la vitamina D (DBP por sus siglas en inglés), alcanza el hígado, donde sufre la primera hidroxilación a cargo de la 25-hidroxilasa hepática y da lugar al calcidiol o calcifediol o 25(OH)D. La segunda hidroxilación tiene lugar principalmente en el riñón por la 1-hidroxilasa, y da lugar a la forma activa biológica, el calcitriol o 1,25-(OH)2D (Fig. 2)1.
El calcidiol, también conocido por calcifediol o 25(OH)D, es el metabolito intermedio que se encuentra libre en el plasma y resulta ser el mejor indicador del estado fisiológico de la vitamina D en el organismo, por reflejar la cantidad de vitamina D3 (colecalciferol) producida por la piel u obtenida por la dieta5.
El calcitriol o 1,25(OH)2D es el metabolito final que se une a diferentes receptores de la vitamina D (VDR), situados en numerosos tejidos del cuerpo humano donde ejercer la actividad hormonal correspondiente1.
Las moléculas anteriormente referidas se diferencian en sus características fisiológicas, como la lipofilia, liposolubilidad, afinidad por receptores y proteínas transportadoras… De esta manera se determinan diferencias en el grado de difusión a través de membranas celulares, acúmulo de depósitos o vida media de eliminación6; en definitiva, se trata de diferencias farmacodinámicas y farmacocinéticas.
Todo ello tiene como consecuencia su utilización en pautas terapéuticas distintas y, recogiendo la opinión de la Sociedad Española de Investigación Ósea y del Metabolismo Mineral (SEIOMM): “Deben tenerse en cuenta estas diferencias, pues no existe una bioequivalencia establecida entre los distintos metabolitos y tampoco son equipotentes la vitamina D3 o colecalciferol, la 25-hidroxivitamina D3 o calcidiol (calcifediol) ni el metabolito final o 1,25-hidroxicolecalciferol (calcitriol)”7.
Figura 1 – Vías metabólicas de la síntesis de vitamina D. (Adaptada de: Gilaberte Y, et al.4).
Figura 1 – Síntesis y metabolismo de la vitamina D en la regulación del metabolismo del calcio, el fósforo y el hueso. (Adaptada de: Zuluaga-Espinosa NA, et al.46).
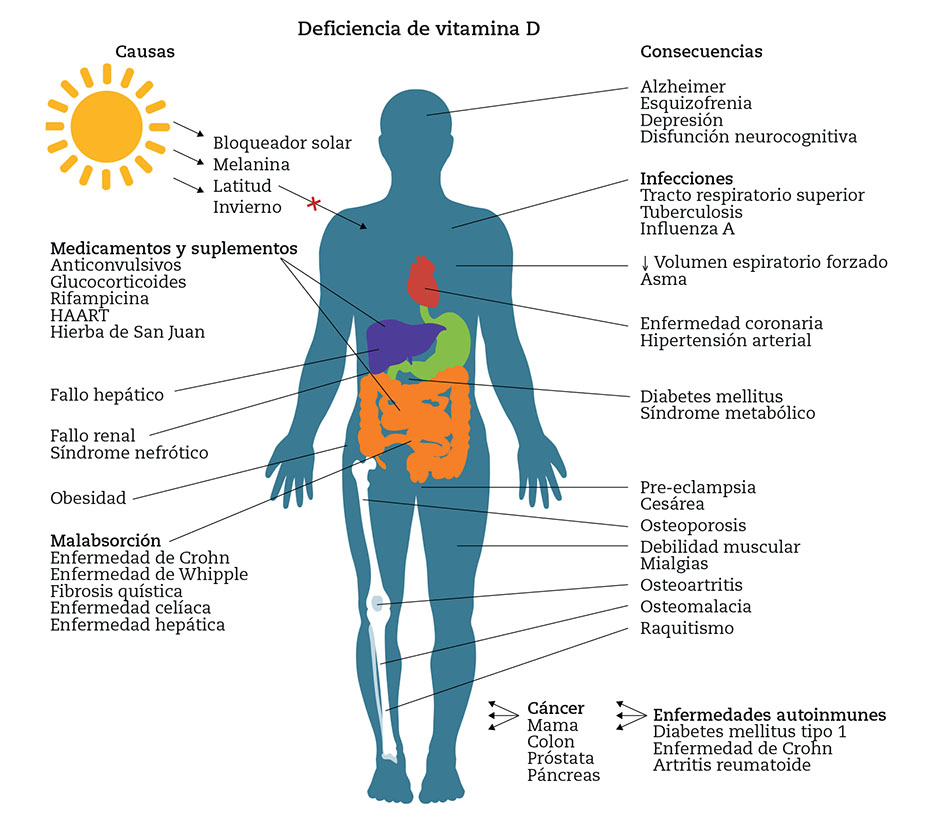
Figura 1 – Principales causas de deficiencia de vitamina D y consecuencias potenciales en el estado de salud. (Adaptada de: Zuluaga-Espinosa NA, et al.46).
Factores que reducen la disponibilidad de vitamina D3 (colecalciferol)
- Existen numerosos factores que interfieren con la síntesis fisiológica de la vitamina D3, su absorción o su metabolismo. Entre ellos cabe destacar los siguientes2:
- Inadecuada exposición solar: actividad física en interior, insolación a través de cristales, institucionalización, superficie corporal expuesta, ropa oscura, cremas fotoprotectoras, contaminación…
- Ambiente de baja exposición a rayos UV: latitud, temporada del año, hora del día…
- Factores fisiológicos: fototipo de piel, síndromes malabsortivos, obesidad, cirugía bariátrica, enfermedad hepática o renal, lactancia exclusiva de pecho, embarazo, envejecimiento…
- Baja ingestión de vitamina D3: bajo uso de suplementos o alimentos sin fortificar, intolerancia a la lactosa, estatus socioeconómico…
- Toma de medicamentos: antiepilépticos, antirretrovirales, glucocorticoides, laxantes, colestiramina, antiácidos…
¿Qué procesos patológicos se asocian a la hipovitaminosis D?
Según los últimos estudios publicados sobre los procesos patológicos asociados al déficit de vitamina D, sin incluir las conocidas osteoporosis, osteomalacia y raquitismo o enfermedades relacionadas con el metabolismo fosfocálcico ya conocidas, entre ellos se incluyen las relacionadas con la regulación del sistema inmune, el deterioro cognitivo, la regulación del sistema hormonal y la regulación de la proliferación y diferenciación celular, también conocidas como acciones no clásicas de la vitamina D.
Entre las acciones hormonales no solo se encuentra la relación con la parathormona (PTH), sino que se conoce bien el mecanismo de interacción con la insulina, a la que estimula además de disminuir la acción apoptótica de las células beta mediada por citoquinas; por tanto, está relacionada con el síndrome metabólico, la diabetes mellitus, la diabetes gestacional…8,9. Así mismo se conoce su papel como modulador de la respuesta inmune, al estar presente en los receptores de las células inflamatorias y su capacidad para inhibir la proliferación de las células T. Por tanto, puede desempeñar un papel en la inmunidad innata y adquirida y tener importancia en procesos patológicos como las enfermedades infecciosas (tuberculosis), inmunes como la diabetes mellitus tipo 1, la enfermedad de Crohn o la esclerosis múltiple9,10. De igual manera parece tener un papel destacado en la enfermedad cardiovascular y la obesidad, en las que subyace una inflamación crónica; de momento la experiencia es baja y hacen falta más estudios para establecer una relación causal11,12.
Así mismo se han establecido relaciones con la proliferación y diferenciación celular y, por tanto, con el cáncer, a partir de la acción antiproliferativa en muchos tipos celulares y tejidos tumorales que expresan el receptor de la vitamina D13. En los próximos años veremos estudios que van despejando algunas incógnitas en este campo (Tabla 3).
Una publicación reciente muestra los resultados del Estudio VITAL, un ensayo clínico aleatorizado con más de 25.000 participantes. En él los autores observan que la suplementación con vitamina D no logra una menor incidencia de cáncer invasivo o de eventos cardiovasculares que el placebo. Hay que indicar que en este estudio la inmensa mayoría de pacientes estaban ya en la basal en niveles óptimos (30, DE10, ng/ml), por lo que los resultados no han sido los esperados (Manson y cols.)14.
Tal vez merezca la pena leer las conclusiones de un trabajo publicado en 2014 por Theodoratou y cols.15, en el que se hace un análisis más pormenorizado de las enfermedades relacionadas con el déficit de vitamina D y sus niveles de evidencia. Se pone de manifiesto la ausencia aún de estudios de alta evidencia, pero termina con esta frase: “Sobre la base de los resultados de esta revisión, es probable una asociación entre las concentraciones de vitamina D y el peso al nacer, las caries dentales en niños, las concentraciones maternas de vitamina D a término y las concentraciones de hormona paratiroidea en pacientes con enfermedad renal crónica que requieren diálisis, pero se necesitan estudios adicionales y ensayos mejor diseñados para sacar conclusiones más firmes”.
En el documento de consenso de la Sociedad Española de Endocrinología (SEEN), publicado en EDN en 201716, se propone una tabla de causas de déficit por mecanismo patogénico (Tabla 4).
¿Cómo medimos la vitamina D?
El mejor método para determinar el estado corporal de vitamina D consiste en medir la concentración plasmática de 25(OH)D. El valor obtenido indica si los depósitos son suficientes, insuficientes o existe intoxicación.
La vida media de la 25(OH)D es de aproximadamente dos semanas. Aunque no es la hormona activa, la medida de 1,25(OH)2D no se debe utilizar para valorar los depósitos de la misma, ya que su vida media es menor de 4 horas, circula en sangre con una concentración 1.000 veces menor y, lo que es más importante, está estrechamente regulada. Cuando un individuo es deficiente en vitamina D hay un aumento compensatorio de PTH, la cual estimula la 1-hidroxilasa renal. Como consecuencia, en estados de déficit de vitamina D las concentraciones plasmáticas de 1,25(OH)2D pueden ser normales e incluso ligeramente elevadas. Se considera la concentración plasmática óptima de 25(OH)D la que mantiene la PTH en límites normales17.
¿Cómo medimos la vitamina D?
El mejor método para determinar el estado corporal de vitamina D consiste en medir la concentración plasmática de 25(OH)D. El valor obtenido indica si los depósitos son suficientes, insuficientes o existe intoxicación.
La vida media de la 25(OH)D es de aproximadamente dos semanas. Aunque no es la hormona activa, la medida de 1,25(OH)2D no se debe utilizar para valorar los depósitos de la misma, ya que su vida media es menor de 4 horas, circula en sangre con una concentración 1.000 veces menor y, lo que es más importante, está estrechamente regulada. Cuando un individuo es deficiente en vitamina D hay un aumento compensatorio de PTH, la cual estimula la 1-hidroxilasa renal. Como consecuencia, en estados de déficit de vitamina D las concentraciones plasmáticas de 1,25(OH)2D pueden ser normales e incluso ligeramente elevadas. Se considera la concentración plasmática óptima de 25(OH)D la que mantiene la PTH en límites normales17.
¿A quién medimos la vitamina D?
A raíz del creciente interés por el tratamiento de la hipovitaminosis D, el número de determinaciones tanto iniciales como de seguimiento han aumentado en los últimos años en la consulta de atención primaria, lo que ha desembocado en la restricción de las peticiones en algunos centros de salud con el fin de racionalizarlas y contener el gasto.
El cribado universal de vitamina D no está indicado en la población general; tan solo debe realizarse en población de riesgo (Tabla 5). No obstante, a tenor de las experiencias que se van incorporando al conocimiento de esta deficiencia, habrá que ir añadiendo otros grupos de riesgo o pacientes en estudio por otras entidades nosológicas de las que aún se carece de experiencia de alta calidad.
¿Cuáles son los niveles óptimos en la sangre?
Sociedades científicas nacionales, como la SEIOMM1, e internacionales como IOF18, American Association of Clinical Endocrinologists (AACE)19, la ES20 y la NOF21, han acordado que las necesidades óptimas de colecalciferol son las que permiten mantener unos niveles séricos en torno a 30 ng/ml. Tal vez niveles más bajos de vitamina D puedan ser también considerados en el rango de la normalidad. La razón de establecer este punto de corte radica en que a partir de este nivel se consigue la máxima absorción intestinal de calcio y, por consiguiente, unos niveles más bajos de hormona paratiroidea (PTH), lo que minimiza el riesgo de hiperparatiroidismo secundario y, por tanto, de resorción ósea (Tabla 6).
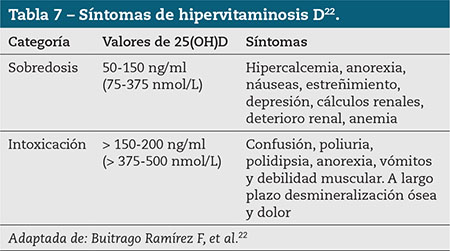
Por otra parte, aunque el nivel de toxicidad esté en 100 ng/ml, es importante tener en cuenta que alcanzar niveles superiores a 50-60 ng/ml de forma continuada puede llegar a ser perjudicial para el individuo22, tal y como reconoce el Institute of Medicine (IOM)5 (Tablas 6 y 7)
Población en riesgo de sufrir hipovitaminosis D
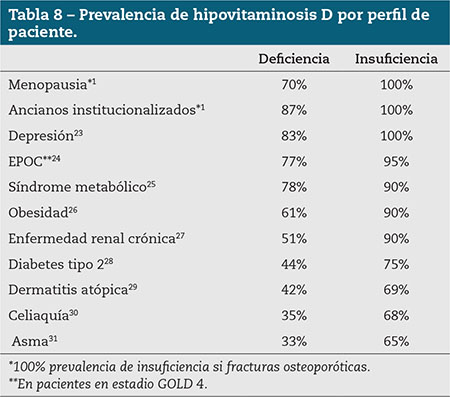
La deficiencia de vitamina D se ha convertido en un problema de salud pública en todo el mundo y afecta a más de la mitad de la población. En España, la insuficiencia/deficiencia de vitamina D ha sido descrita en todas las edades y en ambos sexos (niños, jóvenes, adultos, mujeres posmenopáusicas y ancianos)3. De igual modo, la prevalencia es alta entre muchos tipos de procesos patológicos, como se recoge en la tabla 8. Debemos estar vigilantes ante la osteoporosis o el riesgo de caídas o de fracturas previas en los ancianos institucionalizados e inmovilizados, los obesos, las gestantes, la baja exposición solar (estacional, cultural, patología de piel…), exceso de fotoprotección, fototipos de piel oscura y otras situaciones clínicas: enfermedad renal o hepática, síndrome de malabsorción, corticoterapia…
¿Cómo tratar la hipovitaminosis D?
Idealmente debería realizarse un control de niveles para detectar cuál es el basal y tratar con la pauta posológica que, de forma fisiológica, permita recuperar y mantener al paciente unos niveles de vitamina D óptimos y estables a lo largo del tiempo, por encima de 30 ng/ml1.
Según la SEIOMM los requerimientos de vitamina D en las diversas situaciones vitales son:
- Niños, adolescentes: 400-600 UI/ día.
- Postmenopausia: 600-800 UI/ día.
- Ancianos: 800-1000 UI/ día.
- Pacientes con osteoporosis: 800-1000 UI/ día.
- Pacientes con fractura: 800-1000 UI/ día. Sobre la base de la alta prevalencia de deficiencia grave de vitamina D en los pacientes con fractura osteoporótica de la cadera, el panel de SEIOMM y de las sociedades afines considera que es aconsejable realizar una determinación de los niveles de vitamina D y, cuando no fuera posible, recomienda el uso de dosis superiores1.
- Pacientes que reciben corticoides: 800-1000 UI/ día.
Otros autores como Goñi y Torre, del Hospital de Basurto, consideran necesidades mayores en su revisión “La vitamina D en la práctica clínica” (Tabla 9).
Por tanto, la primera medida debe ser asegurar un aporte de vitamina D (colecalciferol) que se aproxime a los valores estándar recomendados en dicha tabla, mediante la exposición solar o la suplementación dietética:
Luz solar
Un adulto de raza blanca expuesto a la luz solar o a una lámpara de luz ultravioleta produce 1 ng de colecalciferol por cm2 de piel. Aunque el contenido de 7-dehidrocolesterol disminuye con la edad, los ancianos expuestos a la luz solar son capaces de satisfacer sus necesidades de vitamina D32. Se estima que la exposición solar de 5-15 minutos/día en la cara y los brazos durante la primavera, verano y otoño es capaz de mantener los depósitos de la vitamina D en niveles adecuados. La exposición prolongada o en grandes zonas del organismo no ha demostrado la producción en exceso de colecalciferol a niveles capaces de causar intoxicación. Esto es debido a que durante la exposición solar parte de la previtamina D3 se isomeriza a varios fotoproductos que tienen escasa actividad en el metabolismo calcio-fósforo.
Se han descrito varios factores que influyen en la síntesis cutánea de vitamina D.
- En primer lugar, depende de la cantidad de 7-dehidrocolesterol en la epidermis. Los ancianos presentan menor cantidad de 7-dehidrocolesterol en su piel. Así, un individuo mayor de 70 años expuesto a la misma cantidad de luz solar produce un 25 % de la vitamina D que una persona de 20 años.
- En segundo lugar, depende de la cantidad de melanina. Las personas con mayor contenido de melanina requieren exposiciones más prolongadas al sol para sintetizar la misma cantidad de colecalciferol. Esto es debido a la capacidad de la melanina de absorber los fotones solares. De igual forma, las cremas con protección solar absorben las radiaciones antes de que estas penetren en la piel. Cremas protectoras con un factor superior al 8 reducen la capacidad de la piel para producir vitamina D en un 95 %; cremas con factor de protección de 15 reducen su capacidad en más del 98 %.
- Por último, la propia intensidad de la luz solar (que varía según la hora del día), la estación y la latitud, son factores que influyen en la síntesis cutánea de vitamina D. Durante el invierno los rayos solares entran en la Tierra con un ángulo más oblicuo. En esta situación más cantidad de fotones son absorbidos por la capa de ozono. De igual forma, durante las primeras horas de la mañana y las últimas de la tarde el ángulo con el que penetran los rayos solares en la Tierra es más oblicuo. Por ello, se recomienda tomar el sol desde las 10:00 a las 15:00 h. En latitudes superiores a los 37 º al norte y al sur del ecuador, especialmente durante los meses de invierno, el número de fotones que alcanza la superficie terrestre es menor. En estas situaciones la síntesis de vitamina D en la piel es prácticamente nula.
A pesar de los beneficios conocidos de la exposición solar sobre los depósitos corporales de vitamina D, en la actualidad se recomienda prudencia a la hora de tomar el sol por el riesgo de cáncer de piel y de envejecimiento precoz. Sin embargo, se sabe que si la exposición solar causa un ligero eritema e inmediatamente después se aplica una crema de protección solar, el riesgo para la piel es mínimo32.
Dieta
Muy pocos alimentos contienen vitamina D. Los ácidos grasos del pescado marino representan la fuente más rica de colecalciferol: el salmón es la fuente principal, por ser el más frecuentemente consumido. Los huevos, la mantequilla, el hígado y otras vísceras son también alimentos que contienen la vitamina, pero su consumo es escaso por su alto contenido en colesterol. La cantidad de vitamina D en los alimentos es estable y no se destruye por el calor ni por los procesos tecnológicos33.
Alimentos funcionales
En países donde el consumo de aceites de pescado es escaso, la mayor fuente dietética de vitamina D son los alimentos funcionales. Estos son alimentos básicos a los que la industria alimentaria añade uno o más nutrientes esenciales, estén o no contenidos normalmente en ese alimento, con el propósito de prevenir o corregir una deficiencia demostrada de uno o más nutrientes en toda la población o en un grupo específico de la misma. Así, en el mercado se pueden encontrar alimentos fortificados con calcio, vitamina D, ácido fólico, vitaminas del grupo B, E, C y fibra: los zumos, la leche y otros lácteos se enriquecen con calcio; otros como la leche, la mantequilla, la margarina y los cereales del desayuno se fortifican con vitamina D33.
La industria alimentaria utiliza tanto el ergocalciferol como el colecalciferol para enriquecer los alimentos, aunque el uso de este último es más frecuente. En Canadá la leche, la margarina y los zumos están enriquecidos con vitamina D por ley. La leche aporta 400 UI/250 ml, la margarina 530 UI/100 g y los zumos y bebidas similares100-400 UI/1.000 Kcal33. En Estados Unidos el enriquecimiento de los alimentos con vitamina D no es obligada, a menos que lo indique el etiquetado. El contenido de vitamina no se expresa en microgramos o unidades internacionales, sino como porcentaje de ingestión adecuada para individuos adultos (AI = 400 UI)34. En el resto de los países, entre los que se incluye España, el enriquecimiento de alimentos con vitamina D es escasa. Algunas leches, especialmente la desnatada y semidesnatada, algunos zumos y cereales se enriquecen con cantidades variables de vitamina.
Tratamiento farmacológico
Como se ha comentado más arriba se ha demostrado que tanto la exposición solar como el consumo de alimentos ricos en vitamina D es insuficiente para proporcionar la dosis adecuada diaria de vitamina D, aunque sería la recomendación inicial obligatoria, por lo que la deficiencia es frecuente en la población, máxime en población sensible.
Para el tratamiento del déficit de vitamina D en España disponemos de preparados de vitamina D3 (colecalciferol), 25(OH)D3 (calcifediol), 1,25(OH)2D3 (calcitriol) y 1α(OH)D3 (alfacalcidiol). La 1,25(OH)2D3 y la 1α(OH)D3 tienen una vida media corta y, al ser metabolitos activos, su toma supone un mayor riesgo de hipercalcemia, por lo que no se recomiendan para el tratamiento habitual del déficit de vitamina D.
Debemos tener en cuenta que la vitamina D3 y la 25(OH)D3 no son equipotentes. La 25(OH)D3 es más hidrofílica, tiene una vida media más corta, más rápida en su comienzo de acción y es de 3 a 6 veces más potente para elevar las concentraciones séricas de 25(OH)D3. La dosis a utilizar depende de la causa y de la gravedad del déficit, así como de la formulación de vitamina D utilizada.
Según la IOF, las formas hidroxiladas, aunque comercializadas en algún país, no se deberían utilizar como un sustituto de la adecuada ingestión de vitamina D3 (colecalciferol)18.
En pacientes con capacidad absortiva normal se ha observado que con cada 100 UI de vitamina D3 se aumentan las concentraciones séricas de 25(OH)D3 entre un 0,7 a 1 ng/ml. La potencia biológica de la vitamina D se establece de forma que 40 UI equivalen a 1 µg de colecalciferol.
Se han estudiado múltiples regímenes de dosis y se ha encontrado que con posologías diarias, semanales, mensuales, bimensuales e incluso trimestrales se obtienen resultados similares. Se deben evitar las pautas de administración anual con dosis altas (300.000-500.000 UI) por el aumento de riesgo de caídas y fracturas observado. La monitorización del tratamiento se debe realizar a intervalos de 3-4 meses; una vez alcanzadas las concentraciones séricas deseadas de 25(OH)D3, se debe continuar con dosis de mantenimiento para prevenir un nuevo descenso en las concentraciones de 25(OH)D3.
Si tenemos en cuenta las diferencias entre ambos productos (colecalciferol y calcidiol), el perfil de seguridad de la vitamina D3 (colecalciferol) ofrece al profesional sanitario la ventaja de poder realizar un tratamiento empírico al menos a la población de riesgo y reducir así el número de determinaciones a partir de tener en cuenta algunas consideraciones:
- La vitamina D3 (colecalciferol), por sus características de lipofilia y liposolubilidad (que resultan ser distintas de las del calcidiol), presenta una vida media de aproximadamente 60 días (frente a los 15 días del calcidiol)7, lo que acaba dando lugar por parte de la vitamina D3 (colecalciferol) a niveles plasmáticos más estables, predecibles y mantenidos en el tiempo35-39.
- A diferencia del calcidiol, el colecalciferol cuenta con un mecanismo específico de retroalimentación en su hidroxilación hepática, que evita la actividad excesiva de la vitamina D35-39 y permite que el tratamiento pueda realizarse tanto de forma semanal o mensual (en sus equivalentes diarios) para recuperar de forma segura y eficaz el déficit de vitamina D40‑41.
- Por otro lado, la Autoridad Europea de Seguridad Alimentaria, que se encarga de establecer los límites máximos de ingestión crónica de nutrientes, ha establecido el tolerable upper intake level para la vitamina D3 (colecalciferol) en 4.000 UI/día; es decir, la ingestión de 4.000 UI/día de vitamina D3 (colecalciferol) en población general y de manera crónica es segura (no hay evidencia de hipercalcemia, ni de hipercalciuria, ni de ningún otro efecto adverso observado). De hecho, la posología recogida por las Fichas Técnicas de los medicamentos a base de vitamina D3 (colecalciferol) comercializados en España se ajusta a esta recomendación. Calcidiol no tiene asignado UL: no es un nutriente42.
- En una revisión exhaustiva de la evidencia por parte de Ana Isabel Rigueira García, farmacéutica del Hospital San Agustín de Avilés, publicada en la Revista Española de Salud Pública en 2012, se destaca la siguiente frase: “Entre las sustancias formulables como suplemento, el colecalciferol o vitamina D3 muestra mejor relación beneficio/riesgo para uso en población general”43.
Por tanto, y teniendo en cuenta estas premisas, en un tratamiento de hipovitaminosis D pueden utilizarse de inicio 25.000 UI de vitamina D3 (colecalciferol) a la semana durante los primeros meses para recuperar los niveles de vitamina D, y continuar con un mantenimiento con 25.000 UI de colecalciferol mensual o quincenal. La IOF y la ES recomiendan en la población de riesgo y en osteoporosis mantener una ingestión de 1.500-2.000 UI de colecalciferol/día (equivalentes a 25.000 UI de colecalciferol quincenal).
Los pacientes con disfunción hepática grave o insuficiencia renal crónica son los únicos que requieren el empleo de metabolitos activos de vitamina D. En la insuficiencia hepática está recomendado el empleo de calcifediol; en la insuficiencia renal, el de 1,25-dihidroxivitamina D3, 1,25(OH)2D3 o calcitriol. En estos últimos, es recomendable un aporte de vitamina D suficiente para alcanzar niveles plasmáticos de, al menos, 30 ng/ml (75 nmol/l), para lograr efectos pleiotrópicos (Pludowski y cols.)44.
Conclusiones
Mucha información y aún lagunas en la evidencia final obligan al profesional a tomar decisiones basadas en el cuidado de sus pacientes, su experiencia, guías de práctica clínica y recomendaciones de instituciones nacionales e internacionales.
En nuestro grupo de trabajo ha parecido oportuno incluir una propuesta de tratamiento con colecalciferol a modo de orientación terapéutica para facilitar el abordaje de la deficiencia vitamínica con esta molécula en nuestro ámbito profesional; asumimos que pueden existir otros regímenes u opciones terapéuticas.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Gómez de la Tejada MJ, Sosa Henríquez M, Del Pino Montes J, Jódar Gimeno E, Quesada Gómez JM, Cancelo Hidalgo MJ, et al. Documento de posición sobre las necesidades y niveles óptimos de Vitamina D. Rev Osteoporos Metab Miner. 2011; 3: 53-64.
- Holick MF. The Vitamin D deficiency pandemic: approaches for diagnosis, treatment and prevention. Rev Endrocr Metab Disord. 2017; 18: 153-65.
- Navarro C, Quesada Gómez JM. Deficiencia de Vitamina D en España. ¿Realidad o mito? Rev Osteoporos Metab Miner. 2014; 6(supl 1): S5-10.
- Gilaberte Y, Aguilera J, Carrascosa JM, Figueroa FL, Romaní de Gabriel J, Nagore E. Revisión: La vitamina D: evidencias y controversias. Rev Actas Dermosifilograf. 2011; 102: 559-646.
- Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington: Institute of Medicine. Report Brief; 2010.
- Jones G. Pharmacokinetics of Vitamin D toxicity. Am J Clin Nutr. 2008; 88: S582-8.
- Sosa M, Gómez de Tejada Romero MJ. La Vitamina D en el siglo XXI. Más allá de la osteoporosis. Rev Osteoporos Metab Miner. 2017; 9(supl 1): S3-4.
- Pittas AG, Lau J, Hu FB, Dawson-Hughes B. The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. J Clin Endocrinol Metab. 2007; 92: 2017-29.
- Hypponen E, Laara E, Reunanen A, Jarvelin MR, Vir-tanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001; 358: 1500-3.
- Adams JS, Sharma OP, Gacad MA, Singer FR. Metabo-lism of 25-hydroxyvitamin D3 by cultured pulmonary alveolar macrophages in sarcoidosis. J Clin Inves. 1983; 72: 1856-60.
- Elamin MB, Elnour NOA, Elamin KB, Fatourechi MM, Alkatib AA, Almandoz JP, et al. Vitamin D and cardiovascular outcomes: A systematic review and meta-analysis. J Clin Endocrinol Metab. 2011; 96: 1931-42.
- Chowdhury R, Stevens S, Ward H, Chowdhury S, Saj-jad A, Franco OH. Circulating vitamin D, calcium and risk of cerebrovascular disease: a systematic review and meta-analysis. Eur J Epidemiol. 2012; 27: 581-91.
- Ingranham BA, Bragdon B, Nohe A. Molecular basis of the potential of vitamin D to prevent cancer. Current Med Res Opin. 2008; 24: 139-49.
- Manson JE, Cook NR, Lee I-M, Christen W, Bassuk SS, Mora S et al. Vitamin D Supplements and Prevention of Cancer and Cardiovascular Disease. N Engl J Med. 2019; 380: 33-44.
- Theodoratou E, Tzoulaki I, Zgaga L, Ioannidis JPA. Vitamin D and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomised trials. BMJ [Internet]. 2014; 1: 348: g2035.
- Varsavsky M, Rozas Moreno P, Becerra Fernández A, Luque Fernández I, Quesada Gómez JM, Ávila Rubio V, et al. Recomendaciones de vitamina D para la población general. Endocrinol Diabetes Nutr. 2017; 64: 7-14.
- Valero Zanuy MA, Hawkins Carranza F. Metabolismo, Fuentes endógenas y exógenas de Vitamina D. REEMO. 2017; 18: 63-70.
- Dawson-Hughes B, Mithal A, Bonjour JP, Boonen S, Burckhardt P, Fuleihan GE, et al. IOF Position Statement: Vitamin D Recommendations for older adults. Osteoporos Int. 2010; 21: 1151-4.
- Camacho PM, Petak SM, Binkley N, Clarke BL, Harris ST, Hurley DL, et al. AACE/ACE Postmenopausal osteoporosis CPG. Endocr Pract. 2016; 22: 1111-8.
- Holick FM, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Treatment and prevention of Vitamin D deficiency: An Endocrine Society Clinical Practice Guideline. J. Clin Endocrinol Metab. 2011; 96: 1911-30.
- National Osteoporosis Foundation. Clinicians Guide to prevention and treatment of osteoporosis. Washington: Nacional Osteoporosis Foundation; 2013.
- Buitrago Ramírez F, Rodríguez Pérez L, Pagador Trigo A, Gato Núñez C, González Pulido B. Tratamiento de la hipovitaminosis D. FMC. 2016; 23: 474-9.
- Józefowicz O, Rabe-Jablonska J, Wozniacka A, Strzelecki D. Analysis of Vitamin D Status in Major Depression. J Psychiatr Pract. 2014; 20: 329-37.
- Janssens W, Bouillon R, Claes B, Carremans C, Lehouck A, Buysschaert I, et al. Vitamin D deficiency is highly prevalent in COPD and correlates with variants in the vitamin D-binding gene. Thorax. 2010; 65: 215-20.
- Miñambres I. Hipovitaminosis D: relación con el síndrome metabólico y sus componentes. Tesis Doctoral. Universitat Autònoma de Barcelona. 2013. Disponible en: https: //www.tdx.cat/handle/10803/120162.
- Gutiérrez Medina S, Gavela Pérez T, Domínguez Garrido MN, Blanco Rodríguez M, Garcés C, Rovira A, et al. Elevada prevalencia de déficit de vitamina D en individuos obesos: ¿existe relación entre los niveles de vitamina D y algunos componentes del síndrome metabólico? Endocrinol Diabetes Nutr. 2017; 64(espec Cong 2): 358.
- Yuste C, García de Vinuesa S, Goicoechea M, Barraca D, Panizo N, Quiroga B, et al. Vitamin D deficiency in a Spanish cohort of patients with chronic kidney disease. Med Clin (Barc). 2013; 141: 338-42.
- Castillo JM, Callejas MR, Fernández S, Galván AI, Salas F, Sicilia JF, et al. Deficiencia de vitamina D en pacientes con diabetes mellitus tipo 2 en Cantabria. Endocrinol Nutr. 2016; 63(espec Cong): 65.
- Van der Schaft J, Ariens LF, Bruijnzeel-Koomen CA, de Bruin-Weller MS. Serum vitamin D status in adult patients with atopic dermatitis: Recommendations for daily practice. J Am Acad Dermatol. 2016; 75: 1257-9.
- Lerner A, Shapira Y, Agmon-Levin N, Pacht A, Ben-Ami Shor D, López HM, et al. The clinical significance of 25OH-vitamin D status in celiac disease. Clinic Rev Allerg Immunol. 2012; 42: 322-30.
- Korn S, Hübner M, Jung M, Blettner M, Buhl R. Severe and uncontrolled adult asthma is associated with vitamin D insufficiency and deficiency. Respir Res. 2013; 14: 25.
- Holick MF, Matsuoka LY, Wortsman J. Age, vitamin D, and solar ultraviolet. Lancet. 1989; 2: 1104-5.
- Calvo MS, Whiting SJ, Barton CN. Vitamin D intake; a global perspective of current status. J Nutr. 2005; 135: 310-6.
- Calvo MS, Whiting SJ, Barton CN. Vitamin D fortification in the United States and Canada: current status and data needs. Am J Clin Nutr. 2004; 80: S1710-6.
- Guyton AC, Hall JE. Hormona Paratiroidea, calcitonina, metabolismo del calcio y el fosfato, vitamina E, huesos y dientes. En: Hall JE (ed). Guyton y Hall Compendio de Fisiología Médica, 12ª ed. Elsevier; 2011. p. 1087-8.
- Vieth R, Chan PC, MacFarlane GD. Efficacy and safety of vitamin D3 intake exceeding the lowest observed adverse effect level. Am J Clin Nutr. 2001; 73: 288-94.
- Navarro-Valverde C, Sosa-Henríquez M, Alhambra-Expósito MR, Quesada-Gómez JM. Vitamin D3 and calcidiol are not equipotent. J Steroid Biochem Mol Biol. 2016; 164: 205-8.
- Olmos JM, Arnaiz F, Hernández JL, Olmos Martínez JM, González Macías J. Calcifediol mensual frente a calcifediol quincenal en el tratamiento de pacientes osteoporóticos. Estudio en la vida real. Rev Osteoporos Metab Miner. 2018; 10: 89-95.
- Ilahi M, Armas LA, Heaney RP. Pharmacokinetics of a single, large dose of cholecalciferol. Am J Clin Nutr. 2008; 87: 688-91
- Takács I, Tóth BE, Szekeres L, Azabó B, Bakos B, Lakatos P. Randomized clinical trial to comparing efficacy of daily, weekly and monthly administration of vitamin D3. Endocrine. 2017; 55: 60-5.
- Ish-Shalom S, Segal E, Salganik T, Raz B, Bromberg IL, Vieth R. Comparison of daily, weekly, and monthly vitamin D3 in ethanol dosing protocols for two months in elderly hip fracture patients. J Clin Endocrinol Metab. 2008; 93: 3430–5.
- Scientific Opinion on the tolerable upper intake level of vitamin D. EFSA. 2012; 10: 2813.
- Rigueira García AI. Recomendaciones sobre suplementos de vitamina D y Calcio para las personas adultas en España. Rev Esp Salud Pública. 2012; 86: 461-82.
- Pludowski P, Holick MF, Grant WB, Konstantynowicz J, Mascarenhas MR, Haq A, et al. Vitamin D supplementation guidelines. J Steroid Biochem Mol Biol. 2018 ; 175: 125–35.
- López García-Franco A, Fraile Navarro D, Cardona Corrochano E. Vitamina D: El traje nuevo del rey sol. Aten Primaria. 2019; 51: 57-8.
- Zuluaga-Espinosa NA, Alfaro-Velásquez JM, Balthazar-González V, Jiménez-Blanco KE, Campuzano-Maya G. Vitamina D: nuevos paradigmas. Medicina & Laboratorio. 2011; 17: 211-46.