Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 10 de enero de 2020
Aceptado el 10 de agosto de 2021
On-line el 16 de septiembre de 2021
Palabras clave:
Farmacoterapia
Hiperactividad del detrusor
Incontinencia urinaria
Medicina personalizada
Vejiga hiperactiva
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero).
Keywords:
Pharmacotherapy
Detrusor overactivity
Urinary incontinence
Personalized medicine
Overactive bladder
Antonio Alcántara Monteroa,*, Sandra Raquel Pacheco de Vasconcelosb, Fernando Peñato Tarifaa, Mario Tovar Matsuki Martín de Pradoa
aCentro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres, Cáceres. bComplejo Hospitalario Universitario de Cáceres. Cáceres.
Resumen
Esta revisión proporciona una descripción completa de la fisiopatología de la vejiga hiperactiva (VH) en un intento de aclarar la complejidad subyacente al concepto de VH “idiopática” y abogar por un cambio hacia una nomenclatura más precisa de VH “multifactorial”. En esta primera parte se desarrollan las diversas hipótesis y los mecanismos diferentes que pueden provocar la sensación de urgencia urinaria.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Update in physiopathology of hyperactive bladder: on the road towards a change of diagnostic and therapeutic paradigm (I)
Abstract
This review provides a comprehensive overview of overactive bladder (OAB) pathophysiology in an attempt to clarify the complexity underlying the concept of “idiopathic” OAB and to plead for a shift towards the more accurate nomenclature of “multifactorial” OAB. In this first part the various hypotheses and the different mechanisms that could provoke the sensation of urinary urgency are developed.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
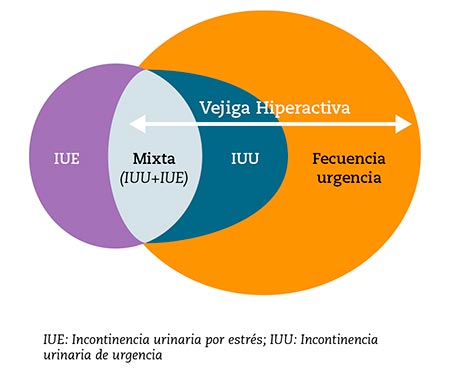
La vejiga hiperactiva (VH) fue definida en 2002 por la Sociedad Internacional de Continencia (ICS, por las siglas en inglés de International Continence Society) como un síndrome sintomático caracterizado por «urgencia, con o sin incontinencia urinaria de urgencia (IUU), generalmente asociada a un aumento de la frecuencia miccional diurna y nocturia” (Fig. 1)1. La ICS también reconoció en esta definición que estos síntomas suelen “sugerir hiperactividad del detrusor demostrable urodinámicamente, pero pueden deberse a otras formas de disfunción uretrovesical”2.
La VH representa un problema de salud importante por su alta prevalencia (en torno al 20 % en la mayoría de los estudios) y por el impacto en la calidad de vida de las personas que la padecen. Estudios poblacionales han demostrado que el número de personas con incontinencia urinaria y VH aumenta con la edad, lo que supone que, con el incremento progresivo de la esperanza de vida, la proporción de población afectada por este problema vaya en aumento, dado que no hay medidas preventivas poblacionales establecidas3,4. La prevalencia global de la VH en la mujer es más elevada que en el varón y el tipo de síntomas también difiere entre un sexo y otro: la IUU es más prevalente en las mujeres que en los varones2,5,6.
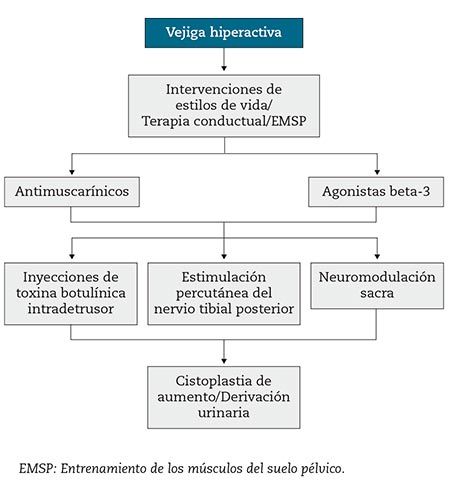
Las guías clínicas actuales proponen un tratamiento escalonado, basado puramente en la “invasividad” del mismo (terapias conservadoras y posteriormente fármacos, cirugía mínimamente invasiva y cirugía invasiva)7,8 (Fig. 2). Sin embargo, la alta tasa de abandonos de los medicamentos para la VH9 y los resultados poco claros de los ensayos controlados aleatorizados (ECA) recientes que comparan las opciones quirúrgicas10 destacan la limitación de este enfoque “clásico”.
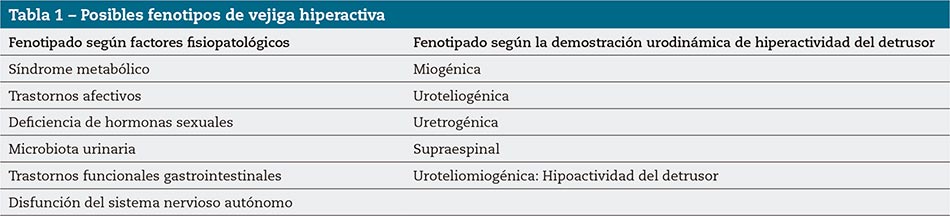
Debido a la dificultad de identificar la patología subyacente para el desarrollo de la VH en la mayoría de los pacientes, a menudo se la denomina “VH idiopática”. Recientemente se ha sugerido que existen varios subtipos de VH11,12 (Tabla 1). El objetivo de la presente revisión es proporcionar una descripción actualizada y completa de la fisiopatología subyacente a la VH, con la esperanza de que la descripción de los fenotipos clínicos pueda llevar a un enfoque más personalizado del tratamiento.
Figura 1 – Espectro de síntomas de la vejiga hiperactiva.
Figura 2 – Algoritmo actual de tratamiento de la vejiga hiperactiva.
Fisiopatología de la vejiga hiperactiva
Fenotipado según demostración urodinámica de hiperactividad del detrusor
La hiperactividad del detrusor (HD) se define como “una observación urodinámica caracterizada por contracciones involuntarias del detrusor durante la fase de llenado, que pueden ser espontáneas o provocadas”1. A menudo se ha asumido que HD es sinónimo de VH; sin embargo, la presencia de HD solo se ha demostrado en el 50 % de las mujeres con VH femenina, lo cual ha llevado a una mayor investigación para considerar la existencia de mecanismos alternativos relacionados con el papel del urotelio, suburotelio, uretra y sistema nervioso central (SNC) en la patogenia de la VH13. Esto sugiere que un mecanismo de “señalización aferente de la vejiga” contribuye al complejo de síntomas de la VH. Cada uno de estos mecanismos ejerce su efecto en diferentes niveles de la vía aferente de la vejiga. A continuación, resumimos estas diversas hipótesis.
Hipótesis miogénica: urgencia originada desde el detrusor
Los trabajos pioneros de Brading sugieren que la urgencia impulsada por la HD está relacionada principalmente con la disfunción miogénica inherente a una supersensibilidad relacionada con la denervación. Drake y cols.14 propusieron más tarde que la HD puede ser el resultado de cambios histológicos del detrusor, lo que parece producir un acoplamiento eléctrico anormal de las células musculares lisas, de modo que los registros fisiológicos se sincronicen en una contracción activa involuntaria del detrusor15. Sin embargo, otros datos sugieren que el aumento de la señalización aferente que resulta de la disfunción urotelial/suburotelial puede contribuir a las contracciones desinhibidas del detrusor o que la HD puede iniciarse a partir de cambios en el control neural central del reflejo de la micción16. Dado que la definición y el diagnóstico de HD están bien estandarizados1, este criterio ha sido considerado buen candidato para perfilar a los pacientes con VH y se ha investigado en consecuencia, pero los resultados han sido deficientes con respecto a su impacto en los objetivos del tratamiento13,17. Entre el arsenal terapéutico actual, solo el tratamiento conservador y la aplicación vaginal de estradiol, antimuscarínicos, neuromodulación sacra (SNM, por sus siglas en inglés sacral neuromodulation) o inyecciones de toxina botulínica intradetrusor están respaldados por nivel 1 de evidencia en pacientes con HD comprobada urodinámicamente13.
Hipótesis uroteliogénica: urgencia originada desde el urotelio/suburotelio de la vejiga
A fines de la década de 1980 los estudios demostraron que la HD o una percepción anormal del llenado de la vejiga podían provocar la sensación de urgencia18. Desde entonces varios estudios han mostrado una función sensorial anormal del detrusor en pacientes con VH19. La experiencia actual sobre el papel del aumento de la actividad de los aferentes de vejiga13,16 apoya la idea11,13 de que la urgencia resulta de la disfunción urotelial/suburotelial en algunos pacientes, que puede no manifestarse como HD. La IUU puede ser menos frecuente en este subgrupo de pacientes, pero la frecuencia urinaria puede ser más común19,20. Se cree que esto está mediado por una señalización anormal y las propiedades de señalización de los fibroblastos uroteliales y suburoteliales, así como posiblemente por una disfunción simpática13,16. Más allá de la función sensorial del urotelio/suburotelio, se ha sugerido que las contracciones espontáneas de la mucosa en sí, originadas en la muscularis mucosae, sean un posible origen de urgencia21. Los fármacos que modulan las vías sensoriales, la activación aferente de la vejiga y la liberación de neurotransmisores, como la toxina botulínica, los agonistas del receptor adrenérgico β3 o los inhibidores de la fosfodiesterasa, pueden ser consideradas opciones valiosas en estos pacientes22. Aunque los mecanismos de acción no se han dilucidado completamente, se ha demostrado que el biofeedback o biorretroalimentación23, los antimuscarínicos24 y la SNM25 reducen la hipersensibilidad de la vejiga, y también pueden considerarse opciones interesantes para hacer frente a estas disfunciones uroteliales/suburoteliales.
Hipótesis uretrogénica: urgencia originada en la uretra
A principios del siglo XX, Barrington26 describió diversos reflejos componentes de la micción en gatos. El segundo de esos reflejos se inducía haciendo circular agua por la uretra y daba lugar a una fuerte contracción de la vejiga mediada por señales aferentes y eferentes pélvicas y pudendas. Empleando un modelo animal, Jung y cols.27 hallaron que la activación de aferentes uretrales mediante la perfusión uretral podría modular el reflejo de la micción y, por tanto, plantearon la hipótesis de que la entrada de orina en la región proximal de la uretra en pacientes con incontinencia urinaria por estrés (IUE) podía estimular los aferentes uretrales e inducir o aumentar la HD. Sus resultados se confirmaron varios años después en voluntarios humanos sanos con la hipótesis de un reflejo uretrovesical28. Muchos pacientes experimentan urgencia al cambiar de posición, de estar sentados o tumbados a ponerse de pie. Se ha postulado que este signo es una característica clínica de una VH que se origina en la uretra29. Es posible que estos pacientes no presenten HD durante el estudio urodinámico, dado que la investigación suele realizarse solo en posición sentada y quizá el catéter selle parcialmente el cuello de la vejiga. También puede formularse la hipótesis de que la posición del paciente durante la cistomanometría de llenado influye en las contracciones involuntarias del detrusor. Se ha propuesto usar las contracciones involuntarias del detrusor inducidas por la maniobra de Valsalva como una forma de desenmascarar la HD en estos pacientes30. Es bien sabido que la reparación quirúrgica de la IUE mejora los síntomas de llenado del tracto urinario inferior (STUI) en algunos pacientes con incontinencia mixta31, pero hasta la fecha todavía no se ha evaluado el papel de la cirugía de IUE para la VH aislada (en particular la VH seca) en determinados pacientes con “urgencia uretral”. De hecho, es poco probable que haya interés por un ensayo así, especialmente si los pacientes ya no presentan incontinencia urinaria. En cambio, se ha comunicado que más del 10 % de los pacientes que se someten a cualquier tipo de cirugía para la IUE presentan urgencia de novo. Se ha postulado, como parte de la teoría integral, que en pacientes con prolapso de órganos pélvicos la urgencia puede deberse a un reflejo de micción activado de forma prematura a causa de la incapacidad, por parte de una vagina laxa, de soportar los receptores de estiramiento del cuello vesical/región proximal de la uretra, lo cual puede explicar las elevadas tasas de resolución de los síntomas de VH tras la corrección quirúrgica del prolapso de órganos pélvicos32.
Mientras que se ha defendido el deterioro primario del tono uretral como posible causa de la VH, el concepto de inestabilidad del esfínter uretral (es decir, la variación de la presión uretral durante el llenado de la vejiga) ha sido propuesto como otro mecanismo de urgencia originado en la uretra, lo cual puede deberse a una ausencia de control nervioso central o pudendo33. Alguna experiencia respalda el papel de la cirugía para la IUE en pacientes con variación de la presión uretral34. Al comunicar que los pacientes con VH refractaria tratados con éxito mediante SNM presentaban una recurrencia inmediata tanto de HD como de variación de la presión uretral tras la modulación bilateral de los nervios pudendos (lo cual estimula la función uretral), Groenendijk y cols.35 sugirieron que la SNM puede ser una opción valiosa en los pacientes con VH originada en la uretra. Hipotéticamente, la duloxetina, un inhibidor de la recaptación de serotonina y noradrenalina, puede ser una opción interesante en pacientes con “urgencia uretral” al mejorar el tono uretral; se ha demostrado que este fármaco es un tratamiento eficaz de la VH en un ECA36.
Pueden incluirse otros dos mecanismos de los síntomas de VH debidos a una IUE severa en esta hipótesis uretrogénica. Primero, las pérdidas constantes en pacientes con este tipo de IUE pueden dar lugar a una vejiga crónicamente demasiado poco llena, “disfuncionalizada”. Estos pacientes pueden desarrollar una HD artificial o una alteración en la distensibilidad que provoca urgencia37. Se ha demostrado que esas disfunciones de la vejiga en muchos casos se resuelven tras la corrección quirúrgica de la IUE, al restituirse los ciclos fisiológicos del llenado y vaciado vesical37. El segundo mecanismo puede ser la frecuencia urinaria preventiva para evitar los episodios de incontinencia en pacientes con IUE severa.
Hipótesis supraespinal: urgencia originada en el cerebro y el tronco del encéfalo
Se ha estudiado exhaustivamente en las últimas décadas el control neural central de la micción38; desde finales de la década de 1990, con la aparición de los estudios de neuroimagen funcional, se ha propuesto que la menor capacidad de integrar funcionalmente la información aferente o el menor control inhibitorio supraespinal sobre el reflejo miccional es un posible mecanismo fisiopatológico de la VH39. Cada vez más experiencia respalda la idea de dos subtipos distintos de “VH cerebral”: uno con HD y otro sin ella40. La ínsula (volúmenes vesicales menores) y la región anterior de la circunvolución del cíngulo/el área motora suplementaria (volúmenes mayores) pueden constituir las características neurales de la urgencia sin HD, mientras que la firma neural de la HD parece ser la desactivación en la corteza prefrontal40. La diferencia en la actividad supraespinal entre los pacientes con VH que presentan HD y los que no presentan HD fue confirmada por Tadic et al (41), que demostraron que una edad avanzada y una mayor carga de daños en la sustancia blanca en pacientes con HD estaban asociadas a una alteración urinaria funcional más grave. Varios informes respaldan la hipótesis de que esa “enfermedad de la sustancia blanca” puede ser el sustrato anatómico de la etiología cerebral de la VH asociada a la HD, quizá mediante la hipoperfusión frontal42.
Los tratamientos conductuales parecen ser adecuados para tratar la “VH cerebral”, al ofrecer la posibilidad de reentrenar la red supraespinal para funcionar con normalidad, como han demostrado recientemente Griffiths y cols.43. Resulta interesante que estos autores observaron dos patrones de reacciones cerebrales frente al llenado de la vejiga y fueron capaces de predecir una respuesta o una ausencia de respuesta a la biorretroalimentación43. Se ha demostrado que la SNM influye en la actividad de varias áreas cerebrales involucradas en el control de la micción y fomenta la reorganización neuroplástica de la actividad cortical44. Alguna experiencia sugiere que la estimulación percutánea del nervio tibial posterior (PTNS por sus siglas en inglés posterior tibial nerve stimulation) también puede desencadenar la reorganización plástica de la red cortical implicada en el control de la micción45.
Hipoactividad del detrusor
En los últimos años la comunidad urológica ha realizado esfuerzos significativos por definir el complejo de síntomas de la vejiga hipoactiva como una entidad clínica nueva46. Mientras que la vejiga hipoactiva se considera el factor clínico relacionado con la hipoactividad urológicamente definida del detrusor, se ha demostrado que la sintomatología de vaciado de la hipoactividad del detrusor se solapa con la VH, y se ha comunicado que la urgencia es el síntoma más frecuente en pacientes con hipoactividad urodinámicamente probada del detrusor (que se observa en un 50 % de los pacientes)47. No es sorprendente que los síntomas de la vejiga hipoactiva estén asociados con una mayor prevalencia de la urgencia, la IUU y la nocturia en un estudio epidemiológico basado en encuestas en el que participaron 977 pacientes48. La incidencia de la urgencia urinaria en pacientes con HD también se puede atribuir a la bien conocida entidad HD/deficiencia de la contractilidad49, la cual, en este contexto, sin duda está relacionada con mayor cantidad de residuos postvaciados y la reducción subsiguiente en la capacidad vesical funcional. Asimismo, la urgencia en la hipoactividad del detrusor es atribuible a las infecciones del tracto urinario (ITU) secundarias a la retención urinaria crónica o el impacto de esta retención sobre la microbiota urinaria50. Los datos actuales indican que la hipoactividad del detrusor puede ser consecuencia de la disfunción urotelial/suburotelial (hipótesis uroteliogénica) o de la disfunción del músculo detrusor (hipótesis miogénica)51. Pese a los alentadores datos preliminares sobre los inhibidores de la colinesterasa, ningún tratamiento ha resultado todavía ser clínicamente eficaz para la restitución de la contractilidad del detrusor52, por lo que el autosondaje intermitente limpio sigue considerándose el tratamiento estándar para estos pacientes, a pesar del hecho de que aún no se ha evaluado con claridad la eficacia del sondaje solo para el alivio de los STUI de llenado en estos pacientes53. Actualmente, los posibles tratamientos futuros, como los fármacos procontráctiles o el tratamiento con células madre, se encuentran en investigación, pero siguen siendo hipotéticos53; y se ha demostrado que la SNM ayuda en pacientes con hipoactividad del detrusor y síntomas de VH, especialmente en quienes tienen una cierta contractilidad residual del detrusor y HD50.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Abrams P, Cardozo L, Fall M, Griffiths D, Rosier P, Ulmsten U, et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. Neurourol Urodyn. 2002; 2: 167-78.
- Alcántara Montero A. Novedades en el tratamiento médico de la vejiga hiperactiva. Semergen. 2016; 42: 557-65.
- Coyne KS, Sexton CC, Thompson CL, Milsom I, Irwin D, Kopp ZS, et al. The prevalence of lower urinary tract symptoms (LUTS) in the USA, the UK and Sweden: results from the Epidemiology of LUTS (EpiLUTS) study. BJU Int. 2009; 104: 352-60.
- Andrades M, Paul R, Ambreen A, Dodani S, Dhanani RH, Qidwai W. Distribution of lower urinary tract symptoms (LUTS) in adult women. J Coll Physicians Surg Pak. 2004; 14: 132-5.
- Boyle P, Robertson C, Mazzetta C, Keech M, Hobbs FD, Fourcade R, et al. The prevalence of lower urinary tract symptoms in men and women in four centres. The UrEpik study. BJU Int. 2003; 92: 409-14.
- Maserejian NN, Chen S, Chiu GR, Wager CG, Kupelian V, Araujo AB, et al. Incidence of lower urinary tract symptoms in a population-based study of men and women. Urology. 2013; 82: 560-4.
- Burkhard FC, Bosch JLHR, Cruz F, Lemack GE, Nambiar AK, Thiruchelvam N, et al. EAU Guidelines on Urinary Incontinence in Adults. European Association of Urology (EAU). 2019 [consultado 20 Julio 2019]. Disponible en: https://uroweb.org/guideline/urinary-incontinence/
- Alcántara Montero A. Propuesta de algoritmo de tratamiento para pacientes con síndrome de vejiga hiperactiva resistente a fármacos. Actas Urol Esp. 2017; 41: 657-8.
- Chapple CR, Nazir J, Hakimi Z, Bowditch S, Fatoye F, Guelfucci F, et al. Persistence and adherence with mirabegron versus antimuscarinic agents in patients with overactive bladder: A retrospective observational study in UK clinical practice. Eur Urol. 2017; 72: 389-99.
- Alcántara Montero A, Müller-Arteaga C. Comentario editorial a «Estimulación transcutánea del nervio tibial posterior en el tratamiento de la incontinencia urinaria de urgencia refractaria, de origen idiopático y neurogénico». Actas Urol Esp. 2019; 43: 1-3.
- Apostolidis A, Averbeck MA, Sahai A, Rahnama’i MS, Anding R, Robinson D, et al. Can we create a valid treatment algorithm for patients with drug resistant overactive bladder (OAB) syndrome or detrusor overactivity (DO)? Results from a think tank (ICI-RS 2015). Neurourol Urodyn. 2017; 36: 882-93.
- Peyronnet B, Mironska E, Chapple C, Cardozo L, Oelke M, Dmochowski R, et al. A comprehensive review of overactive bladder pathophysiology: on the way to tailored treatment. Eur Urol. 2019; 75: 988-1000.
- Roosen A, Chapple CR, Dmochowski RR, Fowler CJ, Gratzke C, Roehrborn CG, et al. A refocus on the bladder as the originator of storage lower urinary tract symptoms: a systematic review of the latest literature. Eur Urol. 2009; 56: 810-9.
- Drake MJ, Mills IW, Gillespie JI.Model of peripheral autonomous modules and a myovesical plexus in normal and overactive bladder function. Lancet. 2001; 358: 401-3.
- Hulls CM, Lentle RG, King QM, Reynolds GW, Chambers JP. Spatiotemporal analysis of spontaneous myogenic contractions in the urinary bladder of the rabbit: timing and patterns reflect reported electrophysiology. Am J Physiol Renal Physiol. 2017; 313: F687-98.
- Chapple C. Chapter 2: Pathophysiology of neurogenic detrusor overactivity and the symptom complex of «overactive bladder». Neurourol Urodyn. 2014; 33(Suppl 3): S6-13.
- Rachaneni S, Latthe P. Effectiveness of BTX-A and neuromodulation in treating OAB with or without detrusor overactivity: a systematic review. Int Urogynecol J. 2017; 28: 805-16.
- Creighton SM, Pearce JM, Robson I, Wang K, Stanton SL. Sensory urgency: how full is your bladder? Br J Obstet Gynaecol. 1991; 98: 1287-9.
- Lee SR, Kim HJ, Kim A, Kim JH. Overactive bladder is not only overactive but also hypersensitive. Urology. 2010; 75: 1053-9.
- Chen SL, Ng SC, Huang YH, Chen GD. Are patients with bladder oversensitivity different from those with urodynamically proven detrusor overactivity in female overactive bladder syndrome? J Chin Med Assoc. 2017; 80: 644-50.
- Kushida N, Fry CH. On the origin of spontaneous activity in the bladder. BJU Int. 2016; 117: 982-92.
- Kanai A, Zabbarova I, Oefelein M, Radziszewski P, Ikeda Y, Andersson KE. Mechanisms of action of botulinum neurotoxins, β3-adrenergic receptor agonists, and PDE5 inhibitors in modulating detrusor function in overactive bladders: ICI-RS 2011. Neurourol Urodyn. 2012; 31: 300-8.
- Wyndaele JJ, Hoekx L, Vermandel A. Bladder biofeedback for the treatment of refractory sensory urgency in adults. Eur Urol. 1997; 32: 429-32.
- Vijaya G, Digesu GA, Derpapas A, Hendricken C, Fernando R, Khullar V. Antimuscarinic effects on current perception threshold: a prospective placebo control study. Neurourol Urodyn. 2012; 31: 75-9.
- Oliver S, Fowler C, Mundy A, Craggs M. Measuring the sensations of urge and bladder filling during cystometry in urge incontinence and the effects of neuromodulation. Neurourol Urodyn. 2003; 22: 7-16.
- Barrington FJF. The component reflexes of micturition in the cats, parts 1 and 2. Brain 1931; 54: 177.
- Jung SY, Fraser MO, Ozawa H, Yokoyama O, Yoshiyama M, De Groat WC, et al. Urethral afferent nerve activity affects the micturition reflex; implication for the relationship between stress incontinence and detrusor instability. J Urol. 1999; 162: 204-12.
- Shafik A, Shafik AA, El-Sibai O, Ahmed I. Role of positive urethrovesical feedback in vesical evacuation. The concept of a second micturition reflex: the urethrovesical reflex. World J Urol. 2003; 21: 167-70.
- Hubeaux K, Deffieux X, Desseaux K, Verollet D, Damphousse M, Amarenco G. Stand up urgency: is this symptom related to a urethral mechanism? Prog Urol. 2012; 22: 475-81.
- Serels SR, Rackley RR, Appell RA. Surgical treatment for stress urinary incontinence associated with valsalva induced detrusor instability. J Urol. 2000; 163: 884-7.
- Jain P, Jirschele K, Botros SM, Latthe PM. Effectiveness of midurethral slings in mixed urinary incontinence: a systematic review and meta-analysis. Int Urogynecol J. 2011; 22: 923-32.
- Petros PE, Woodman PJ.The Integral Theory of continence. Int Urogynecol J Pelvic Floor Dysfunct. 2008; 19: 35-40.
- Kirschner-Hermanns R, Anding R, Rosier P, Birder L, Andersson KE, Djurhuus JC. Fundamentals and clinical perspective of urethral sphincter instability as a contributing factor in patients with lower urinary tract dysfunction–ICI-RS 2014. Neurourol Urodyn. 2016; 35: 318-23.
- Koonings P, Bergman A, Ballard CA. Combined detrusor instability and stress urinary incontinence: where is the primary pathology? Gynecol Obstet Invest. 1988; 26: 250-6.
- Groenendijk PM, Heesakkers JP, Lycklama A Nijeholt AA. Urethral instability and sacral nerve stimulation-a better parameter to predict efficacy? J Urol. 2007; 178: 568-72.
- Steers WD, Herschorn S, Kreder KJ, Moore K, Strohbehn K, Yalcin I, et al. Duloxetine compared with placebo for treating women with symptoms of overactive bladder. BJU Int. 2007; 100: 337-45.
- Afraa TA, Campeau L, Mahfouz W, Corcos J. Urodynamic parameters evolution after artificial urinary sphincter implantation for post-radical prostatectomy incontinence with concomitant bladder dysfunction. Can J Urol. 2011; 18: 5695-8.
- Holstege G, Griffiths D, de Wall H, Dalm E. Anatomical and physiological observations on supraspinal control of bladder and urethral sphincter muscles in the cat. J Comp Neurol. 1986; 250: 449-61.
- Griffiths D, Derbyshire S, Stenger A, Resnick N. Brain control of normal and overactive bladder. J Urol. 2005; 174: 1862-7.
- Griffiths D, Tadic SD. Bladder control, urgency, and urge incontinence: evidence from functional brain imaging. Neurourol Urodyn. 2008; 27: 466-74.
- Tadic SD, Griffiths D, Schaefer W, Murrin A, Clarkson B, Resnick NM. Brain activity underlying impaired continence control in older women with overactive bladder. Neurourol Urodyn. 2012; 31: 652-8.
- Apostolidis A, Wagg A, Rahnam A’i MS, Panicker JN, Vrijens D, von Gontard A. Is there «brain OAB» and how can we recognize it? International Consultation on Incontinence-Research Society (ICI-RS) 2017. Neurourol Urodyn. 2018; 37(S4): S38-45.
- Griffiths D, Clarkson B, Tadic SD, Resnick NM. Brain mechanisms underlying urge incontinence and its response to pelvic floor muscle training. J Urol. 2015; 194: 708-15.
- Blok BF, Groen J, Bosch JL, Veltman DJ, Lammertsma AA.Different brain effects during chronic and acute sacral neuromodulation in urge incontinent patients with implanted neurostimulators. BJU Int. 2006; 98: 1238-43.
- Finazzi-Agrò E, Rocchi C, Pachatz C, Petta F, Spera E, Mori F, et al. Percutaneous tibial nerve stimulation produces effects on brain activity: study on the modifications of the long latency somatosensory evoked potentials. Neurourol Urodyn. 2009; 28: 320-4.
- Chapple CR, Osman NI, Birder L, van Koeveringe GA, Oelke M, Nitti VW, et al. The underactive bladder: a new clinical concept? Eur Urol. 2015; 68: 351-3.
- Uren AD, Cotterill N, Harding C, Hillary C, Chapple C, Klaver M, et al. Qualitative exploration of the patient experience of underactive bladder. Eur Urol. 2017; 72: 402-7.
- Faraj K, Doo F, Boura J, Vereecke A, Chancellor MB. A cross-sectional study in the USA of the epidemiology and quality of life of underactive bladder symptoms. Int Urol Nephrol. 2016; 48: 1797-802.
- Rademakers KL, Drossaerts JM, van Kerrebroeck PE, Oelke M, van Koeveringe GA. Prediction of sacral neuromodulation treatment success in men with impaired bladder emptying-time for a new diagnostic approach. Neurourol Urodyn. 2017; 36: 808-10.
- Kim DK. Origin of urgency symptom in underactive bladder: commentary on «underactive bladder: clinical features, urodynamic parameters, and treatment». Int Neurourol J. 2015; 19: 293-4.
- Kerdraon J, Peyronnet B, Gamé X, Fatton B, Haddad R, Hentzen C, et al. Pathophysiology of detrusor underactivity in the elderly. Prog Urol. 2017; 27: 402-12.
- Smith PP, Tyagi P, Kuchel GA, Pore S, Chermansky C, Chancellor M, et al. Advanced therapeutic directions to treat the underactive bladder. Int Urol Nephrol. 2014; 46(Suppl 1): S35-44.
- Gani J, Hennessey D.The underactive bladder: diagnosis and surgical treatment options. Transl Androl Urol. 2017; 6(Suppl 2): S186-95.