Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 15 de mayo de 2020
Aceptado el 7 de agosto de 2020
On-line el 9 de septiembre de 2020
Palabras clave:
Microbioma
Microbiota
*Autor para correspondencia
Correo electrónico:
jcucalona@semg.es
(J.M. Cucalón Arenal).
Keywords:
Microbiome
Microbiota
José Manuel Cucalón Arenal*, María Guadalupe Blay Cortés
Grupo de Trabajo de Endocrinología, Metabolismo y Nutrición de la SEMG
Resumen
De todos los ecosistemas vivos que crecen y se relacionan con nuestro organismo, es, sin duda, la flora intestinal el más conocido e investigado. Ha sido la patología digestiva, tanto funcional como orgánica, la que más revisiones ha suscitado.
Aún se desconocen muchas de las relaciones entre la masa microorgánica saprófita y nuestra propia celularidad. No solo se estudia la relación entre ambos ecosistemas, sino las diferentes causas de disbiosis o desequilibrio entre ambos sistemas, que suponen un verdadero riesgo para la salud. Otras patologías alejadas del tubo digestivo pueden tener su origen en este espacio.
Nuevas aportaciones terapéuticas, como el trasplante fecal, suponen un reto para nuestro conocimiento. El médico de familia debe tener formación actualizada de esta gran fábrica de vida y relación que supone la microbiota intestinal.
© 2020 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Update in microbiome and microbiota for the medical practitioner (II)
Abstract
Of all the live ecosystems that grow and are related with our organism, intestinal flora is undoubtedly the best known and investigated. Digestive diseases, both functional as well as organic, have been those which have resulted in the most reviews.
Many of the relationships between the saprophytic microorganic mass and our own cellularity are still unknown. Study is not only made between both ecosystems, but also regarding the different causes of dysbiosis or imbalance between both systems, which entails a true risk for the health. It is possible that other conditions outside of the digestive tract may have their origin in this space.
Our therapeutic contributions, such as fecal transplant, can be a challenge for our knowledge. The family doctor needs to have updated training of this great factory of life and the relationship that the intestinal microbiota has.
© 2020 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Microbiota gastrointestinal
La microbiota gastrointestinal humana, comúnmente conocida como flora intestinal, consiste en un conjunto de microorganismos que viven en el tracto digestivo1.
El ecosistema microbiano gastrointestinal incluye especies nativas que colonizan permanentemente el tracto gastrointestinal y una serie variable de microorganismos vivos que transitan temporalmente por el tubo digestivo. Las bacterias nativas se adquieren al nacer y durante el primer año de vida, mientras que las bacterias en tránsito se ingieren continuamente a través de alimentos, bebidas…2.
Son más de 1014 microorganismos los que habitan en la superficie del tracto digestivo; sin embargo, la distribución y composición de la microbiota está determinada por el genotipo de cada individuo y por la colonización inicial que comienza en el momento del nacimiento1.
En la microbiota intestinal conviven bacterias, virus y hongos en un equilibrio armónico y dinámico3. Principalmente las bacterias se han adaptado a la vida en la luz del intestino y han alcanzado una presencia total de unos 100 billones, los cuales se corresponden con unas 500 a 1.000 especies diferentes4. En el estómago y duodeno la presencia de microorganismos es menor debido a las secreciones ácidas, biliares y pancreáticas, así como a la actividad motora propulsiva (alrededor de 1.000 bacterias por ml). En el yeyuno e íleon aumenta de forma progresiva la presencia de bacterias (de 104 a 107 bacterias/ml en el íleon terminal) y alcanza la mayor densidad de población en el intestino grueso, principalmente en el colon, ya que el tránsito es lento y permite a los microorganismos proliferar4 hasta concentraciones de 1011 y 1012 bacterias/ml. En conjunto la población viva del colon puede alcanzar un peso variable de entre 300 y 600 g, lo que supone un tercio del peso de las heces y un 95 % de la microbiota del huésped.
La gran biodiversidad de especies del ecosistema intestinal facilita la vida del anfitrión. Las interacciones entre las diferentes especies bacterianas completan un dibujo metabólico de coordinación y cooperación entre ellas. Los productos metabólicos que generan unas los utilizan otras para su proliferación. Muchas de ellas no podrían vivir fuera de este hábitat. El equilibrio entre microbiota y huésped marca la diferencia entre salud y enfermedad (Fig. 1).
La microbiota de un ser humano, en estado saludable, está compuesta principalmente por los filos Firmicutes y Bacteroidetes, cuyo conjunto representa aproximadamente el 70 % del total de la microbiota3. Destacan géneros como Bacteroides, Eubacterium, Bifidobacterium, Peptostreptococcus, Clostridium y Ruminococcus. Otros gérmenes menos frecuentes o no dominantes son Enterobacteriaceae, Lactobacilus, Streptococcus, Staphylococus y Fusobacterium. Los Bacteroides proporcionan el 37 % del genoma bacteriano intestinal.
Esta microbiota bacteriana se adquiere inmediatamente después del nacimiento. Hasta hace poco tiempo se creía que el feto se desarrollaba en un útero estéril. Sin embargo, cada vez hay más pruebas que indican que el feto se desarrolla en un entorno que no está totalmente libre de gérmenes. Se ha detectado la presencia de microbios en el cordón umbilical, en el líquido amniótico y en membranas fetales en embarazos aparentemente normales3. Tras el nacimiento, el bebé adquiere microorganismos del ambiente, comida y personas de su entorno3.
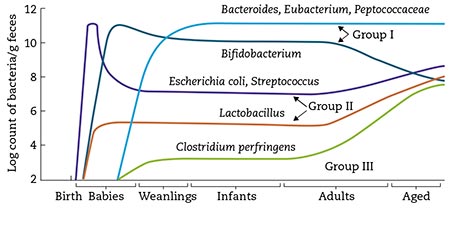
En situaciones de normalidad, el parto vaginal, propio de nuestra especie, condiciona la carga microbiana fisiológica en el recién nacido (RN). Esta se adquiere por contacto directo a través del canal del parto de los microorganismos genitourinarios y digestivos, presentes en el periné de la madre. Tras el parto, la alimentación natural, a través de la leche materna, determina el desarrollo normal de esta microbiota recién inoculada. El primer día después del nacimiento, en la mayoría de las heces de los recién nacidos se observan E. coli, Enterococcus, Lactobacillus, Clostridium y Staphylococcus, con una presencia de bacterias que alcanza los 1011 por gramo. En los lactantes amamantados, los Bifidobacterium suelen empezar a aparecer alrededor del tercer día, y los grupos bacterianos que aparecían anteriormente comienzan a disminuir. En torno al cuarto o séptimo día tras el nacimiento comienzan a predominar los Bifidobacterium y alrededor del séptimo día la microbiota intestinal se vuelve más estable. Con el destete, la microbiota intestinal va siendo cada vez más similar a la de un adulto: se observa un incremento del recuento de Bacteroides, Eubacterium, Streptococcus anaerobios y, a menudo, Clostridium, así como una menor presencia de Bifidobacterium. También se observan cambios en la composición microbiológica normal intestinal en la etapa de adulto mayor, principalmente una disminución de Bifidobacterium y predominancia de anaerobios. Se cree que este fenómeno es el resultado del efecto que tiene el envejecimiento de la función fisiológica del huésped sobre la microbiota intestinal5 (Fig. 2).
Figura 1 – Microbiota en el tracto gastrointestinal.
Figura 2 – Cambios en la microbiota fecal con el aumento de la edad. (Tomada de: Mitsouka T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 2014; 33: 99-116).
Es necesario considerar que diversos factores pueden influir en la composición de la microbiota intestinal. En un primer momento, la microbiota vaginal e intestinal de la madre puede afectar a la carga microbiológica inicial del feto, por lo que el tipo de parto (vaginal o mediante cesárea) determina fuertemente la inicial composición de la microbiota del bebé. También influye el tipo de alimentación (amamantamiento o lactancia artificial), los tratamientos terapéuticos (antibioterapia…), el nivel de higiene, la exposición al medio ambiente natural (países ricos o pobres) y los antecedentes genéticos3. A la vez que la madre transmite el componente microbiológico al RN, en la lactancia transmite el alimento a través de los galactooligosacáridos (prebiótico) y las defensas para esa microbiota inicial (anticuerpos específicos tipo IgA, inmunidad innata…). Algunos RN separados de la madre desarrollan más alergias. La distorsión en este estándar de normalidad microbiológica puede desempeñar un papel en la patogenia de algunas enfermedades inmuno-inflamatorias en la edad adulta.
En función del lugar y nivel digestivo en el que se asienta la microbiota, las especies cambian a la par que cambian las características en las que habitan: pH, enzimas, espacio…
Así ya hemos comentado que en la boca la microbiota es biodiversa y no siempre saprófita, pues algunas bacterias, como los estreptococos, generan ácidos que provocan caries, y ciertas levaduras provocan aftas en inmunodeprimidos.
En el esófago no existe colonización permanente, ya que es un conducto colapsado por la musculatura: es solo vía de tránsito y arrastra a los microorganismos que se ingieren.
En estómago existen fundamentalmente lactobacilos, ya que la acidez es una barrera natural para muchos gérmenes que acaban aquí su existencia y ya no pueden progresar, lo que evita infecciones en los tractos inferiores. La concentración de lactobacilos es baja y se desconoce el papel que pueden tener. El 40 % de la población alberga Helicobacter pylori, que se asocia a la producción de gastritis, úlcera péptica e incluso algunos tipos de cáncer.
En el intestino delgado, en el duodeno, el componente microbiológico es escaso por la persistencia de la acidez y por los jugos biliares y pancreáticos, con alto contenido enzimático. En el yeyuno se incrementa la microbiota a partir de lactobacilos fundamentalmente; en el íleon aumenta el número de especies y ya refleja la enorme biodiversidad que aparece en colon.
Es en el intestino grueso en donde la microbiota alcanza su máximo exponente. Destacan las bacterias, pero también hay áreas de hongos (levaduras) y protozoos. Se calcula que hay más de 500 especies distintas, lo que da una idea de su madurez, estabilidad y la escasa influencia del exterior (homeostasis intestinal). De entre las bacterias mayoritarias destacan Firmicutes (faecalibacterium y Rosaburia) y bacteroidetes (bacteroides y Prevotella), que suponen hasta un 35 % del total. Les siguen actinobacterias (10 %, Bifidobacterium). La inmensa mayoría son anaerobias estrictas, obtienen su energía de la fermentación y son muy sensibles al oxígeno6.
Las principales funciones de la microbiota intestinal son:
- Funciones de nutrición y metabolismo: la actividad bioquímica de las bacterias permite recuperar energía en forma de ácidos grasos de cadena corta a través de la fermentación de sustratos no digeribles y moco endógeno, producir vitaminas (vitamina K) y mejorar la absorción de iones2 (Ca, Mg, Fe…).
- Funciones de protección: se trata de un efecto barrera que se debe a la capacidad de ciertas bacterias de segregar sustancias antimicrobianas, como las bacteriocinas, que inhiben la proliferación de otras bacterias, y también a la competición entre bacterias por nutrientes o espacios ecológicos2.
- Funciones tróficas: las bacterias intestinales pueden controlar la proliferación y diferenciación de las células epiteliales, además de desempeñar un esencial papel en el desarrollo del sistema inmune2.
Tal vez la función más interesante sea la metabólica. La microbiota aporta un gran número de genes que codifican proteínas y enzimas que proporcionan recursos que no están en el genoma humano. Se ha considerado a la microbiota un auténtico órgano metabólico similar al hígado. La principal función es la fermentación de hidratos de carbono que tiene, de por sí, enormes beneficios en otras funciones, como la absorción de iones y la generación de ácidos grasos de cadena corta (ácido butírico, principal fuente de energía del epitelio intestinal; ácido acético y propiónico, que intervienen en el metabolismo hepático de la glucosa y reducen la glucosa postprandial y la respuesta insulínica, lo que previene la insulinorresistencia y la diabetes mellitus tipo 2).
Toda esta actividad beneficiosa se desarrolla cuando la composición de la microbiota es normal o fisiológica. Es situación recibe el nombre de “eubiosis” y se define como el equilibrio del ecosistema microbiano intestinal. Se caracteriza por una presencia mayoritaria de especies potencialmente beneficiosas, pertenecientes principalmente a Firmicutes y Bacteroidetes, mientras que las especies potencialmente patógenas, como la perteneciente a Proteobacteria, están presentes en un bajo porcentaje7. En caso de “disbiosis” (desequilibrio del ecosistema), las especies beneficiosas ya no controlan a las perjudiciales que toman el control7. Entre los factores que pueden alterar el equilibrio de la microbiota intestinal se incluyen el estilo de vida, la dieta, la toma de antibióticos y otros patógenos7.
Continuamente estamos expuestos a factores que pueden influir en la microbiota intestinal; no obstante, tiene una gran facilidad de adaptación frente a un agente perturbador o una situación adversa y es capaz de lograr una posterior recuperación del estado inicial cuando cesa la perturbación. El nivel de estos cambios viene definido no solo por la naturaleza, la fuerza y la duración de la perturbación, sino también por la composición y estabilidad de cada microbiota, lo que significa asumir que es única para cada persona8.
La disbiosis intestinal se ha relacionado con la presencia de varias patologías, como la enfermedad inflamatoria intestinal, la celiaquía, la obesidad y ciertos trastornos metabólicos, entre otras3.
La translocación bacteriana es la capacidad de algunas bacterias de salir de su ecosistema; aún viables, por vía linfática o hemática invaden otros territorios, como ganglios mesentéricos, hígado o bazo, y pueden ocasionar sepsis, fallo multiorgánico y muerte4.
Otras alteraciones de la eubiosis intestinal, como la diarrea provocada por consumo de antibióticos, puede desestabilizar el equilibrio entre especies y favorecer el sobrecrecimiento de algunas como Clostridium, lo que puede ocasionar colitis pseudomembranosa4.
En los últimos años se está investigando la acción inmunitaria de la microbiota intestinal. La morbilidad infecciosa está disminuyendo en países desarrollados, pero está surgiendo la patología alérgica, inmunitaria e inflamatoria intestinal. Aunque existe un componente genético, es evidente que se une a un efecto ambiental claro. Cambios en la microbiota autóctona pueden ser responsables de estos cambios tan rápidos4.
Así mismo, la relación entre microbiota bacteriana y enfermedad oncológica gastrointestinal está de moda. La relación entre dieta y cáncer ya era evidente, pero el estudio de la microbiota la convierte en elemento ambiental claramente relacionado, tanto por procancerígena (generación de residuos de la dieta) como por inhibitoria (reducción de otras sustancias enzimáticas, como el papel desempeñado por las bifidobacterias).
Epílogo
En definitiva, mucho es el conocimiento que nos llega en estos últimos años de la microbiota bacteriana y mucho es el conocimiento que falta por llegar; sin duda, abrirá nuevas puertas a la investigación tanto diagnóstica como terapéutica en este campo.
Este aprendizaje de las diferentes microbiotas humanas y de su carga genómica, procedente de la multitud de publicaciones aparecidas, es el que nos permite investigar sobre cepas saprófitas que, ingeridas o trasplantadas, pueden equilibrar, mejorar y solucionar problemas provocados por la disbiosis en estos ecosistemas y apuntan el posible origen de muchas patologías. El papel terapéutico de los probióticos está en auge y debemos entender sus beneficios para la salud. En el próximo número iniciaremos un apasionante viaje por los probióticos, prebióticos y simbióticos. Un arsenal terapéutico que está en sus cimientos, pero que ya cuenta con un cuerpo de conocimiento abundante.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Passos C, Morales-Filho J. Intestinal microbiota in digestive diseases. Arq Gastroenterol. 2017; 54: 255-62.
- Guarner F. Papel de la flora intestinal en la salud y en la enfermedad. Nutr Hosp. 2007; 22(supl 2): 14-19.
- Gagliardi A, Totino V, Cacciotti F, Iebba V, Neroni B, Bonfiglio G, et al. Rebuilding the gut microbiota ecosystem. Int J Environ Res Public Health. 2018; 15: 1679.
- Guarner F, Malagelada JR. La flora bacteriana del tracto digestivo. Gastroenterol Hepatol. 2003; 26(supl 1): 1-5.
- Mitsouka T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 2014; 33: 99-116.
- Suárez Juan E. Microbiota autóctona, prebióticos y prebióticos. Nutr Hosp. 2015; 31(supl 1): 3-9.
- Iebba V, Totino V, Gagliardi A, Santangelo F, Cacciotti F, Trancassini M, et al. Eubiosis and dysbiosis: the two sides of the microbiota. New Microbiol. 2016; 39: 1-12.
- Alarcón T. Procedimientos en Microbiología Clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. SEIMC 2016.