Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 5 de marzo de 2023
Aceptado el 26 de junio de 2023
On-line el 27 de julio de 2023
Palabras clave:
Ecografía
Cirrosis hepática
Hipertensión porta
Esteatosis
*Autor para correspondencia
Correo electrónico:
foo.keith@gmail.com
(K.A. Foo Gil).
Keywords:
Ultrasound
Liver cirrhosis
Portal hypertension
Steatosis
Keith Albert Foo Gila, José Carlos Sánchez Sánchezb, Jackeline Lucía Carrera Sieiroc, Martín Marchese Rattid, Ramón Manuel Devesa Muñize, José Manuel Solla Caminoe, Aquilino Vázquez Fernándezf
aCentro de Salud Laza. Ourense. bDirector de Área Integrada de Gestión de Diagnóstico por Imagen. Hospital de Poniente. El Ejido (Almería). cServicio de Anestesia, Reanimación y Dolor. Complejo Hospitalario Universitario de Ourense. dServicio de Urgencias y Emergencias. Hospital Helicópteros Sanitarios. Marbella (Málaga). eCentro de Salud de Allariz (Ourense).fCentro de Salud Outomuro-Cartelle (Ourense).
Resumen
La ecografía hepática se considera por su inocuidad, bajo coste, accesibilidad y rendimiento diagnóstico, la técnica de imagen de primera línea en la valoración inicial de los pacientes con sospecha o evidencia de enfermedad hepática o en el seguimiento de las enfermedades hepáticas difusas y sus complicaciones.
En esta revisión se realiza una identificación de los principales hallazgos ecográficos y característicos de las alteraciones difusas hepáticas, entre ellas, la esteatosis hepática, la cirrosis hepática y la hipertensión portal.
La ecografía hepática actualmente tiene una alta sensibilidad y especificidad, y es una herramienta muy útil en la atención primaria.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Ultrasound of diffuse liver lesions in primary care
Abstract
Because of its safety, low cost, accessibility, and diagnostic yield, liver ultrasound is considered the first-line imaging technique in the initial assessment of patients with suspected or evidence of liver disease and/or in the follow-up of diffuse liver diseases and its complications.
In this review, an identification of the main echographic and characteristic findings of diffuse liver alterations will be made, including hepatic steatosis, liver cirrhosis and portal hypertension.
Liver ultrasound currently has high sensitivity and specificity, being a very useful tool in primary care.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
La ecografía hepática se considera por su inocuidad, bajo coste, accesibilidad y rendimiento diagnóstico, la técnica de imagen de primera línea en la valoración inicial de los pacientes con sospecha o evidencia de enfermedad hepática o en el seguimiento de las enfermedades hepáticas difusas y sus complicaciones.
El hígado en la ecografía es de ecogenicidad homogénea, de grado fino y característicamente isoecoico o hiperecoico con respecto a la corteza renal, hipoecoico respecto al parénquima pancreático y ligeramente hipoecoico respecto al bazo. Cuenta también con estructuras anecoicas que corresponden a los vasos y ecoicas que corresponden a los ligamentos y cisuras1.
Es un órgano diana de enfermedades locales y sistémicas. En la actividad diaria de los facultativos (médico de atención primaria, internista, gastroenterólogo y médicos de Urgencias) son motivo de consulta frecuente el dolor abdominal, la dispepsia e incluso clínica inespecífica pero altamente sugestiva de neoplasias, como astenia, fiebre, pérdida de peso y distensión abdominal. La ecografía constituye una herramienta idónea en el diagnóstico y seguimiento de lesiones difusas y focales en el parénquima hepático que puedan asociarse a dichas manifestaciones.
En la esteatosis hepática (lesión difusa) la ecografía ha demostrado una alta sensibilidad (88,4 %; IC95 %: 79,8-88,9) y especificidad (93 %; IC95 %: 87,2-97), sobre todo en los estadios moderado y grave, en los que encontramos un aspecto hiperecoico con escasa visualización de los vasos y atenuación posterior del sonido.
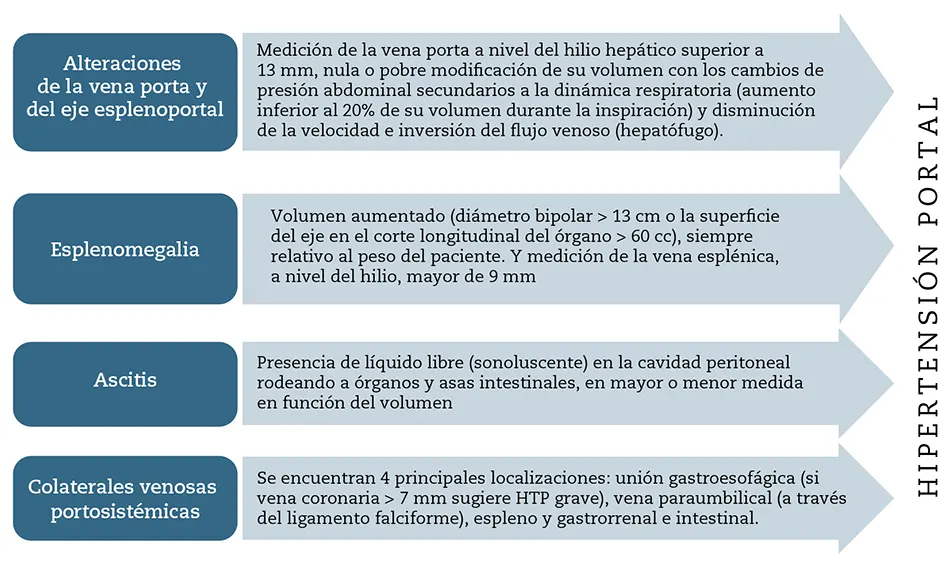
En el patrón ecográfico de cirrosis hepática (CH) la ecografía tiene una sensibilidad del 94,2 % y una especificidad del 88,6 %, con un valor predictivo positivo del 92,4 % y un valor predictivo negativo del 92 %. Por signos ecográficos, la valoración de la superficie hepática nodular, que se hace más evidente en la interfase del hígado con la vesícula biliar y en la zona del riñón derecho, tiene una sensibilidad variable dependiendo de los estudios existentes, con una sensibilidad media del 75 % (12-91 %) y especificidad media del 88 % (80-95 %). En la valoración de los cambios de ecogenicidad, en la CH se observa un parénquima heteroecoico, con predominio de grano grueso originado por la fibrosis; su sensibilidad es de solo 52 % (38-65 %) y la especificidad del 92 % (89-95 %). La hipertrofia del lóbulo caudado tiene una especificidad muy elevada (96 %), pero una sensibilidad de solo el 63 % (se consideran patológicas medidas superiores a 35 mm de anteroposterior o más de 50 mm craneocaudal). Cuando a los signos descritos anteriormente se le añaden signos de hipertensión portal (HTP), el diagnóstico de CH se hace más fidedigno. Entre los signos directos se encuentra la dilatación de la porta (> 13 mm), de la vena esplénica (> 12 mm) y de la vena mesentérica (> 11 mm); tienen una sensibilidad cercana al 100 %, pero una especificidad del 58 %. La presencia de una vena porta normal no excluye la HTP. La variabilidad menor del 10 % en el calibre de las venas esplénica y mesentérica con los movimientos de inspiración y espiración tiene una elevada especificidad (97 %) y una baja sensibilidad (65 %); la presencia de colaterales venosas portosistémicas está considerada como el signo más específico de HTP, con especificidad del 100 % pero sensibilidad del 65 %. Otros signos indirectos de HTP son esplenomegalia, ascitis, derrame pleural y engrosamiento de la pared vesicular2.
Alteraciones hepática difusas
Son afectaciones del parénquima hepático que pueden ser extensas. Hay varios tipos de patrones característicos que pueden ayudar a su valoración.
Hígado graso o esteatosis hepáticas
“Hígado graso” o “esteatosis hepática” son términos equivalentes de un mismo problema: la excesiva acumulación de lípidos en los hepatocitos, que causa un daño significativo al hígado, o bien provoca un metabolismo acelerado.
Se asocia a múltiples causas y patologías: obesidad, diabetes, alcoholismo, hiperlipidemia, tratamiento esteroideo, malnutrición, síndrome de Reye, tuberculosis, colitis ulcerosa y quimioterapia3,4.
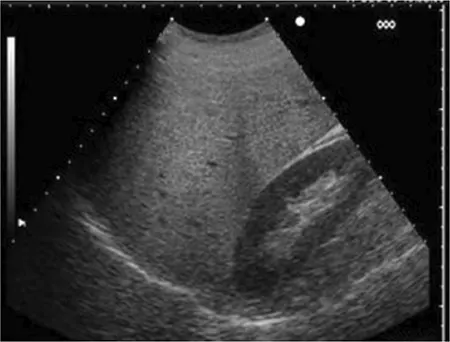
Ecográficamente, se observa un hígado hiperecoico si se compara con la corteza renal derecha. La ecogenicidad se atenúa en las zonas posteriores más alejadas del foco emisor de ultrasonidos, debido a los fenómenos de reflexión. Estos le dan un aspecto brillante en los campos más superficiales y oscuro en los posteriores.
Pueden clasificarse en grados según el tipo de afectación hepática (figuras 1, 2 y 3)5,6.
En ocasiones, la infiltración grasa puede producirse también de forma focal y aparentar una neoplasia. Se encuentran áreas de ecogenicidad aumentada sobre un fondo de hígado normal, o bien áreas de hígado indemne en el seno de una infiltración grasa extensa, que pueden dar una imagen de hígado parcheado. Se observa con mayor frecuencia alrededor de la porta en el segmento IV, en la fosa vesicular y a lo largo del borde hepático. No provoca efecto masa sobre los vasos hepáticos y suele tener unos márgenes bien definidos y geográficos. En pocos días puede cambiar su aspecto o resolverse7.
Hepatitis
Tanto en las hepatitis agudas como en las crónicas, la imagen ecográfica variará paralelamente a los cambios histológicos. El parénquima hepático puede tener una ecogenicidad difusamente disminuida en correspondencia con un aumento del volumen de los hepatocitos, con la proliferación de células de Kupffer y con la infiltración de las áreas portales por los linfocitos y los monocitos. Las tríadas portales se podrán apreciar con mayor brillo. A su vez, puede observarse hepatomegalia y un engrosamiento de la pared de la vesícula biliar sin manifestación clínica de colecistitis. El mayor valor de la ecografía en las hepatitis agudas es la posibilidad de excluir otras causas de dolor abdominal o de ictericia, dar información sobre la evolución del proceso y detectar pequeñas cantidades de ascitis de forma precoz8.
Figura 1 – Grados de esteatosis hepática.
Figura 2 – Esteatosis hepática grado 1. Hiperecogenicidad difusa del parénquima hepático que se hace evidente al compararlo con la ecogenicidad de la corteza renal derecha.
Figura 3 – Esteatosis hepática grado 2. Aumento moderado de la ecogenicidad del parénquima, ligero empeoramiento de la visión de los vasos intrahepáticos de menor calibre y del diafragma.
Cirrosis
Es un proceso difuso caracterizado por la proliferación de fibrosis y la conversión de la arquitectura hepática normal en una estructura anormalmente nodular.
Tres son los mecanismos patológicos principales que producen la cirrosis: la necrosis celular, la fibrosis y la regeneración en forma de nódulos desestructurados. Los signos ecográficos de la cirrosis son los que se describen en las figuras 4, 5 y 69.
Figura 4 – Características ecográficas evolutivas de la cirrosis hepática.
Figura 5 – Bordes de romos, nodulares o micronodulares. El parénquima hepático puede presentarse heterogéneo, de aspecto nodular o con múltiples tractos fibrosos.
Figura 6 – Imagen anecoica en espacio de Morrison y/o perihepática que representa líquido libre intraabdominal.
Hipertensión portal
Se define como el aumento anormal de la presión arterial de la vena porta, debido al incremento de la resistencia al paso del flujo sanguíneo a través del hígado o a un aumento del volumen aportado desde el área esplácnica al sistema portal.
El 75 % del aporte sanguíneo que recibe el hígado le llega a través de la vena porta, mientras que el 25 % restante lo recibe desde la arteria hepática, procedente del tronco celíaco, que a su vez nace en la aorta abdominal. El incremento de la resistencia al paso del flujo portal provocará un enlentecimiento de la circulación, una reducción del aporte metabólico y un aumento de la presión, lo que retrógradamente provocará la fuga de ese exceso de volumen y desarrollará la circulación colateral. Las vías colaterales que se dilatarán serán frecuentemente10,11:
- Los plexos periesofágicos en su camino hacia la vena ácigos.
- La vena umbilical, alojada en el ligamento redondo, que se recanalizará y conectará la porta izquierda con las venas epigástricas superficiales de la pared anterior del abdomen y el ombligo.
- Los plexos de la vena hemorroidal superior.
- Los plexos retroduodenales
- Los plexos retroperitoneales mesentericolumbares.
En la gran mayoría de las ocasiones, la hipertensión portal está causada por cirrosis hepáticas, producidas a su vez por hepatopatías crónicas que durante largos periodos evolutivos de la enfermedad han manifestado signos clínicos y ecográficos poco evidentes y alteraciones bioquímicas irrelevantes.12
Según el tipo de obstrucción que origina la hipertensión portal, se clasifica de la siguiente manera:
Prehepática
- Compresión mecánica del hilio hepático por ganglios o metástasis.
- Aumento del flujo, debido a una fístula arteriovenosa.
- Obstrucción trombótica en el hilio hepático.
- Hepática
- Procesos cirróticos debidos a hepatopatías crónicas víricas, que constituirán el 90 % de los casos de hipertensión portal.
- Hepatopatías tóxicas (alcohólica, secundarias a metrotexato, polivinilo…).
- Alteraciones congénitas (enfermedad de Wilson).
- Déficit de alfa-1-antitripsina.
- Parasitarias (esquistosomiasis).
- Cirrosis biliar primaria.
- Trombosis tumorales (carcinoma hepatocelular).
Posthepática
- Obstrucción de las venas suprahepáticas de origen congénito.
- Fibrosis por endoflebitis.
- Trombosis en la enfermedad de Budd-Chiari.
Según su ubicación
- Presinusoidal: no se produce insuficiencia hepática, la reserva hepática está intacta y la encefalopatía tiene una presentación tardía.
- Sinusoidal: se corresponde con la intrahepática.
Figura 7 – Características ecográficas de la hipertensión portal.
Enfermedad por depósito de glucógeno: glucogenosis
Es un trastorno genético por déficit de la enzima glucosa-6-fosfatasa. Se manifiesta desde el nacimiento con hepatomegalia, nefromegalia y convulsiones por hipoglucemia, al depositarse grandes cantidades de glucógeno en los hepatocitos y en los túbulos renales, debido al déficit enzimático13.
Ecográficamente, es indistinguible de una esteatosis. Se asocia con la aparición de adenomas e hiperplasia nodular focal. Los adenomas hepáticos se ven como masas sólidas, bien definidas, de ecogenicidad variable, aunque con frecuencia isoecoicos con el parénquima adyacente. Pueden llegar a sufrir una transformación maligna que se reconoce por su rápido crecimiento14,15.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, et al. The diagnosis and management of non-alcoholic fatty liver disease:practice guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012; 55: 2005-23.
- Gerstenmaier JF, Gibson RN. Ultrasound in chronic liver disease. Insights Imaging 2014; 5: 441-55.
- Borges VF, Diniz AL, Cotrim HP, Rocha HL, Andrade NB. Sonographic hepatorenal ratio: a noninvasive method to diagnose nonalcoholic steatosis. J Clin Ultrasound. 2013; 41: 18-25.
- Hernaez R, Lazo M, Bonekamp S, Kamel I, Brancati FL, Guallar E, et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: A meta-analysis. Hepatology. 2012; 54: 1082-90.
- Chamadol N, Somsap K, Laopaiboon V, Sukeepaisarnjaroen W. Sonographic findings of hepatocellular carcinoma detected in ultrasound surveillance of cirrhotic patients. J Med Assoc Thai. 2013; 96: 829-38.
- Martín A, Castellano G. Seguimiento ecográfico de los pacientes con hepatopatía crónica. Revista EcoDigest. 2016; 8: 1-12.
- Siegelman ES, Rosen MA. Imaging of hepatic steatosis. Semin Liver Dis. 2001; 21: 71-80.
- Macías M, Rendón P. Valoración ecográfica del estadio de la hepatopatía crónica. Revista EcoDigest. 2006; 8e: 1-12.
- Gomez R, Artaza T, Legaz M, Muñoz C, Tordera F, Carrobles J. The uselfuness of ultrasound techniques in the diagnosis of cirrhosis: Multiple parameter evaluation. Ultrasound Int. 1996; 2: 122-30.
- Gaiani S, Piscaglia F, Celli N, Donati G, Bolondi L. Ultrasonido Doppler en la hipertensión portal. Eco Digest. 2000; 2: 150-60.
- Eddowes PJ, Sasso M, Allison M, Tsochatzis E, Anstee QM, Sheridan D, et al. Accuracy of FibroScan controlled attenuation parameter and liver stiffness measurement in assessing steatosis and fibrosis in patients with nonalcoholic fatty liver disease. Gastroenterology. 2019; 156: 1717-30.
- Mathiesen UL, Franzén LE, Aselius H, Resjö M, Jacobsson L, Foberg U, et al. Increased liver echogenicity at ultrasound examination reflects degree of steatosis but not of fibrosis in asymptomatic patients with mild/moderate abnormalities of liver transaminases. Dig Liver Dis. 2002; 34: 516-22.
- Ferraioli G, Maiocchi L, Raciti MV, Tinelli C, De Silvestri A, Nichetti M, et al; on behalf of the Liver Steatosis Study Group. Detection of liver steatosis with a novel ultrasound-based technique: a pilot study using MRI-PDFF as the gold standard. Clin Transl Gastroenterol. 2019; 10: e00081.
- Dioguardi Burgio M, Imbault M, Ronot M, Faccinetto A, Van Beers BE, Rautou PE, et al. Ultrasonic Adaptive Sound Speed Estimation for the Diagnosis and Quantification of Hepatic Steatosis: A Pilot Study. Ultraschall Med. 2019; 40: 722-33.
- Wong VW, Petta S, Hiriart JB, Cammà C, Wong GL, Marra F, et al. Validity criteria for the diagnosis of fatty liver by M probe-based controlled attenuation parameter. J Hepatol. 2017; 67: 577-84.