Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 24 de noviembre de 2021
Aceptado el 31 de octubre de 2023
On-line el 1 de diciembre de 2023
Palabras clave:
SARS-CoV-2
Tratamiento farmacológico
Evidencias
*Autor para correspondencia
Correo electrónico:
elpiyo127@hotmail.com
(E. García Ramón).
Keywords:
SARS-CoV-2
Pharmacological treatment
Evidences
Emérito Peramato Martína, Elpidio García Ramónb,*, Yolanda Granja Garranzc, María José Refart Corrala, Nerea García Granjad, Raquel Saborido Coiradase
aCentro de Salud Benavente Norte. Zamora. bGerencia de Atención Primaria Valladolid Oeste. Valladolid. cCentro de Salud Plaza del Ejército. Valladolid. dCentro de Salud Circunvalación. Valladolid. eOficina de Farmacia. La Unión de Campos (Valladolid).
Resumen
Introducción. El SARS-CoV-2, responsable de la denominada COVID-19 (Coronavirus disease-19), fue detectado inicialmente en China en diciembre de 2019. Se diseminó por todo el mundo y fue declarada como pandemia por la OMS el 11 de marzo de 2020. Se trata de una enfermedad infecciosa respiratoria; si se agrava puede precisar de complejos cuidados y soportes intensivos en el hospital, incluida la ventilación mecánica (VM).
Objetivos. El objetivo de esta revisión es proporcionar al médico de familia una visión integral, racional y comparativa de los fármacos hasta ahora utilizados en el tratamiento de la enfermedad o probados en ensayos clínicos, se haya demostrado o no la eficacia de su uso.
Material y métodos. En el presente artículo realizamos una revisión de la información disponible en las bases de datos consultadas: Pubmed, Medline plus, EMBASE o Scopus, Cochrane Library o el Índice Médico Español (IME), entre otras, sobre los tratamientos útiles y usados o ensayados en la fase inflamatoria hasta el 20 de noviembre de 2021.
Resultados. Remdesivir tiene aún más incertidumbres usado en fases donde ya ha progresado la enfermedad, con requerimientos de oxígeno de alto flujo o VM. Dexametasona ha demostrado mejorar la supervivencia en el paciente grave hospitalizado con necesidad de oxigenoterapia. Existen datos de utilidad en pacientes graves con tocilizumab, sarilumab y baricitinib. No hay datos todavía suficientes con roxulitinib, anakinra y siltuximab.
Conclusiones. Se han logrado avances importantes en el tratamiento de la enfermedad, tanto en la fase inicial de replicación como en esta fase inflamatoria pulmonar y sistémica, en que los corticoides y los inhibidores de la interleucinas tienen su papel más relevante.
Los anticoagulantes y la oxigenoterapia han sido determinantes en el soporte y el control de aparición de complicaciones.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
The yesterday and the today of pharmacological treatment of COVID-19 based on the experience and the evidence: a systematic review
Abstract
Introduction. The SARS-CoV-2, responsible for the called COVID-19 (Coronavirus disease-19) was initially detected in China in December 2019, spreading throughout the world and being declared a pandemic by WHO on March 11, 2020. It is a respiratory infectious disease; if it worsens, may require complex care and intensive support in the hospital, including mechanical ventilation (MV).
Objectives. The objective of this review is to provide the family doctor with a comprehensive, rational and comparative vision of the drugs used up to now in the treatment of the disease or tested in clinical trials, demonstrating or not the evidence of their use.
Material and methods. In this article we review the information available in the databases consulted: Pubmed, Medline plus, EMBASE or Scopus, Cochrane Library or the Spanish Medical Index (IME), among others, on the useful and used treatments or tested in the inflammatory phase and until November 20, 2021.
Results. Remdesivir has even more uncertainties used in phases where the disease has already progressed, with high flow oxygen requirements and/or MV. Dexamethasone has been shown to improve survival in critically ill hospitalized patients in need of oxygen therapy. There is evidence of usefulness in serious patients of tocilizumab, sarilumab and baricitinib. There is still insufficient evidence with roxulitinib, anakinra and siltuximab.
Conclusions. Important advances have been made in the treatment of the disease, both in the initial replication phase and in this pulmonary and systemic inflammatory phase where corticosteroids and interleukin inhibitors play their most important role. Anticoagulants and oxygen therapy have been decisive in the support and the appearance of complications.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
La infección producida por el SARS-CoV-2, agente responsable de la denominada COVID-19 (Coronavirus disease-19), fue detectada inicialmente en China en diciembre del 2019. Se diseminó por todo el mundo y fue declarada como pandemia por la OMS el 11 de marzo de 2020. Se trata de una enfermedad infecciosa respiratoria; si se agrava puede precisar de complejos cuidados y soportes intensivos en el hospital, incluida la ventilación mecánica (VM).
En un titánico esfuerzo para combatirla, la comunidad científica ha probado multitud de fármacos, utilizados ya previamente en otras enfermedades, ante la falta de un tratamiento suficientemente respaldado científicamente. Esto ha traído como consecuencia modificaciones muy rápidas en los protocolos, a veces difíciles de seguir, y ha creado confusión e incertidumbre acerca de su uso.
Material y métodos
En el presente artículo realizamos una revisión de la información disponible en las bases de datos consultadas: Pubmed, Medline plus, EMBASE o Scopus, Cochrane Library o el Índice Médico Español (IME), entre otras, sobre los fármacos usados en la fase II de la enfermedad o inflamatoria en el pacientes hospitalizados y en ensayos clínicos y hasta el día 20 de noviembre del 2021. Hemos intentado sintetizar al máximo las mejores experiencias para definir la eficacia o no de los diversos tratamientos administrados o ensayados en la fase de inflamación con el paciente ya hospitalizado (antiinflamatorios e inmunomoduladores) y en el tratamiento y profilaxis de las complicaciones (antibióticos, antitrombóticos y oxigenoterapia).
En un trabajo anterior expusimos los fármacos utilizados en la primera fase de la enfermedad o replicativa. El tratamiento de la COVID-19 sigue siendo a día de hoy el talón de aquiles de la ciencia.
Resultados
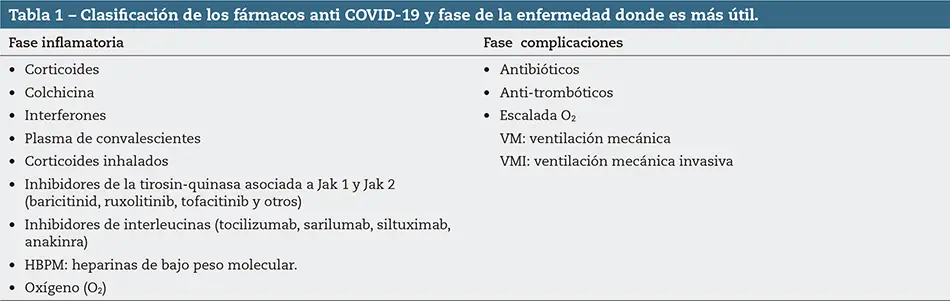
En la tabla 1 hacemos una clasificación de los fármacos que vamos a evaluar y las fases de inflamación y complicaciones de la enfermedad (figura 1).
Antiinflamatorios e inmunorreguladores para pacientes hospitalizados
Corticoides
Como ya es bien conocido en la COVID-19 hay un marcado incremento de los parámetros inflamatorios, que en algunos pacientes desembocan en la llamada “tormenta de citoquinas” o “síndrome de activación macrofágica”, que evoluciona hacia un síndrome de distrés respiratorio agudo (SDRA); este se relaciona con un mal pronóstico. Con la finalidad de frenar esa actividad hiperinflamatoria, se comenzaron a utilizar los corticoides (dexametasona 6 mg VO o IV una vez al día durante 10 días, o si no se dispone de ella se puede se puede emplear metilprednisolona 32 mg/día, o prednisona 40 mg/día). En embarazadas o lactantes, se puede utilizar prednisona (40 mg VO) o hidrocortisona (80 mg IV dos veces al día).
En el Ensayo RECOVERY la dexametasona ha sido el único fármaco que ha demostrado reducir la mortalidad a los 28 días en pacientes hospitalizados con VM y que reciben oxigenoterapia, cuando se inicia el tratamiento a partir de los 7 días desde el comienzo de los síntomas, sin que se observe beneficio en los pacientes que no precisaron oxígeno ni soporte ventilatorio. Luego, quede claro que la Sociedad Americana de enfermedades infecciosas recomienda el uso de dexametasona en pacientes hospitalizados con saturación por debajo de 94 % que necesitan oxigenoterapia, VM o bien oxigenación por membrana extracorpórea (ECMO); nunca se recomienda en pacientes que no precisan oxigenoterapia. Por el momento, la utilización de corticoides en pacientes ambulatorios que no precisen oxigenoterapia no está indicada, a pesar de ser un fármaco accesible y de utilización frecuente en atención primaria.
Existe controversia en su uso precoz junto a otros antiinflamatorios e inmunomoduladores, como la colchicina, y junto al tratamiento antitrombótico con heparinas de bajo peso molecular (HBPM) o anticoagulantes orales directos del factor Xa, cuando sería efectiva para prevenir la trombo-inflamación en pacientes con COVID-19 (triples terapias tempranas, TTT)4.
Figura 1 – Evolución de la COVID-19 y sus tres vías de ataque.
Colchicina
Es un fármaco de uso corriente para tratar la inflamación y el dolor en la gota. Puede ayudar a mejorar las complicaciones de la COVID-19, pero no existe una experiencia anecdótica mínima, así como datos consistentes en los ensayos clínicos llevados a cabo hasta el momento.
En el ensayo RECOVERY no se asoció con reducciones en la mortalidad a 28 días, ni con la duración de la estancia o el riesgo de progresar a VM o muerte.
Los primeros resultados del ensayo COLCORONA demostraron que el uso de colchicina se asoció a reducciones en el riesgo de muerte u hospitalización en comparación con placebo; sin embargo, los propios autores consideraran estos hallazgos como generadores de hipótesis, dadas las bajas tasas de inscripción y episodios5.
Interferones
Nos remitimos a lo comentado en el apartado de fármacos antivirales: no hay experiencia para recomendarlos.
Plasma de convalecientes
En Estados Unidos la FDA ha autorizado esta terapia para uso de emergencia en pacientes hospitalizados. La escasa experiencia científica que existe y que proviene de estudios observacionales y pequeños ensayos clínicos, apunta a que podría ser más efectiva si se administra al inicio de la evolución de la enfermedad en pacientes hospitalizados con COVID-19 grave que requieren oxígeno complementario.
En el ensayo Clínico PLACID, realizado en pacientes hospitalizados con COVID-19 moderada, no se ha evidenciado reducción de la mortalidad ni de la progresión a enfermedad grave; únicamente se vio que mejoraba la resolución de la dificultad respiratoria y la fatiga al acelerar la negativización del ARN del SARS-CoV-26.
Corticoides inhalados
Actualmente no hay experiencia acerca de su utilidad2.
Inhibidores de la tirosina quinasa asociada a JAK-1 y JAK-2
- Baricitinib (Olumiant). Modula la respuesta inmune regulando la señal hiperactiva a través de los transductores de señal-quinasa Janus y activadores de la transcripción (JAK-STAT).
Además de la atención estándar (incluida la dexametasona), el tratamiento con baricitinib consiguió un perfil de seguridad similar al de la atención estándar sola y se asoció a una reducción de la mortalidad en adultos hospitalizados por COVID-197.
Asociado a remdesivir, fue superior a remdesivir solo para reducir el tiempo de recuperación y acelerar la mejoría del estado clínico; se detectaron menos efectos adversos graves8.
Las dosis fueron de 4 mg/día VO durante 7-14 días (2 mg/día en pacientes mayores de 75 años o con infecciones crónicas o recurrentes). - Ruxolitinib. Es otro inhibidor selectivo de la JAK 1 y JAK 2.
Aún no existen ensayos clínicos publicados que respalden su eficacia o su seguridad en pacientes con COVID-19.
El ensayo RUXCOVID encontró que el ruxolitinib, junto con la terapia estándar, no mostró una reducción significativa en las complicaciones graves de COVID-19, incluida la muerte o la insuficiencia respiratoria que requirió VM o ingreso en cuidados intensivos4.
Las dosis eran de 5 mg dos veces al día durante 14 días. - Tofacitinib. Es un inhibidor selectivo de la JAK 1 y JAK 3 administrado VO con selectividad funcional para JAK 2. También modula la acción de interferones y la interleucina-6.
En los pacientes hospitalizados con neumonía COVID-19 su uso condujo a un menor riesgo de muerte o insuficiencia respiratoria hasta el día 28 que el placebo9. - Acalabrutinib (inhibidor de la tirosina quinasa de Bruton) o imatinib. En estudio en el ensayo SOLIDARIDAD, no han demostrado eficacia en los ensayos clínicos o hasta ahora los resultados son más bien escasos en este sentido4.
Inhibidores de las interleucinas
- Tocilizumab. Es un anticuerpo monoclonal frente al receptor de la IL-6, autorizado para el tratamiento de la artritis reumatoide y el síndrome de liberación de citosinas.
Ha sido incluido en ensayos clínicos como el COVACTA10 y el EMPACTA cuando los marcadores inflamatorios están marcadamente elevados (Dímero D, ferritina, PCR) y las citoquinas proinflamatorias altas (IL-6 > 40).
Fue una de las intervenciones de “uso compasivo” más extendidas en España y el resto del mundo. En la actualidad la Agencia Española de Medicamentos y Productos Sanitarios, a falta de concluir los estudios, recomienda su uso en fases de la enfermedad en la que los pacientes, que aún no están con VM o ECMO, empeoran a pesar del uso de corticoides, o en los que no se puedan utilizar con la finalidad de frenar la cascada inflamatoria.
Otros dos Ensayos controlados aleatorizados (REMAP-CAP y RECOVERY)11,12 han demostrado resultados muy positivos con el uso de tocilizumab. Los efectos secundarios descritos son: nasofaringitis, cefalea, hipertensión arterial y aumento de GPT. Reacciones adversas graves son: infecciones graves, complicaciones de diverticulitis y reacciones de hipersensibilidad. No se debe emplear si los valores de GPT son 5 veces el LSN o neutrófilos por debajo de 500 c/mm, plaquetas inferiores a 50.000, sepsis de origen diferente a la COVID-19, comorbilidades con mal pronóstico, diverticulitis complicada con perforación intestinal, o infección cutánea en curso. La dosis utilizada es de 600 mg en pacientes de al menos 75 kg de peso, o dosis única en caso contrario. Si tras 24 horas no mejoran los criterios gasométricos se puede administrar una segunda dosis. - Sarilumab (Kevzara). Es un anticuerpo monoclonal que inhibe la IL-6 (su receptor) vital en la respuesta inmunitaria al SARS-CoV-2.
La dosis empleada es de 200-400 mg IV en una única infusión. - Siltuximab. Es un anticuerpo monoclonal frente a las formas solubles de la IL-6 (uso compasivo).
La dosis empleada es de 11 mg/kg; si la PCR no baja se puede dar una segunda dosis a las 12 horas, incluso una tercera a las 24 horas de la primera. - Anakinra (Kineret). Es un antagonista del receptor de la IL-1.
Se ha empleado en uso compasivo a dosis de 400 mg/día (4 dosis IV de 100 mg cada 6 horas), durante un máximo de 15 días13.
Tratamientos empleados en las complicaciones de la COVID-19
Antibióticos
No están recomendados de forma rutinaria; solamente cuando se sospecha sobreinfección bacteriana, lo que supone únicamente un 5 % de los casos.
En el medio hospitalario se emplea el antibiótico indicado a cada microorganismo y según el patrón de resistencias de cada centro hospitalario.
Si existe sobreinfección en el ámbito extrahospitalario, se utiliza el tratamiento estándar de las neumonías adquiridas en la comunidad, generalmente amoxicilina/clavulánico (875/125 mg cada 8 horas) o levofloxacino (500 mg cada 12 horas el primer día y luego cada 24 horas durante 4 días más).
Si el cuadro es grave a la amoxicilina clavulánico se le añade azitromicina (500 mg/24 horas durante 3 días) o ceftriaxona (1 g cada 24 horas IM durante 5 días) más azitromicina (500 mg cada 24 horas durante 3 días VO).
Alternativamente se puede emplear levofloxacino (500 mg a las dosis ya comentadas) más ceftrixona (1 g cada 24 horas durante 5 días).
Si se opta por la vía parenteral, se emplea:
- Amoxicilina-clavulánico: 1 g/200 mg reconstruidos en 20 ml de agua para preparaciones inyectables, por vía IV directa lenta, para pasar en 3-5 minutos, o diluida en 100 ml de suero fisiológico, durante 30-40 minutos; nunca en suero glucosado.
- Azitromicina: vial de 500 mg cada 3 horas diluido en 4,8 ml de agua para preparaciones inyectables, diluidos en 250 ml de suero fisiológico o glucosado al 5 %, para pasar en una hora o en 500 ml en tres horas.
- Levofloxacino: disolución de 500 mg en 100 ml; 500 mg cada doce horas durante el primer día y luego 500 mg cada 24 horas durante 4 días más.
- Ceftriaxona sódica: 1 g cada 24 horas; vial de 1 g diluido en una ampolla de 10 ml de agua para preparaciones inyectables; vía IV directa para pasar en 2-4 minutos, o perfusión en 50-100 ml de suero fisiológico o suero glucosado al 5 % para pasar en 30 minutos2.
Profilaxis y tratamiento antitrombóticos
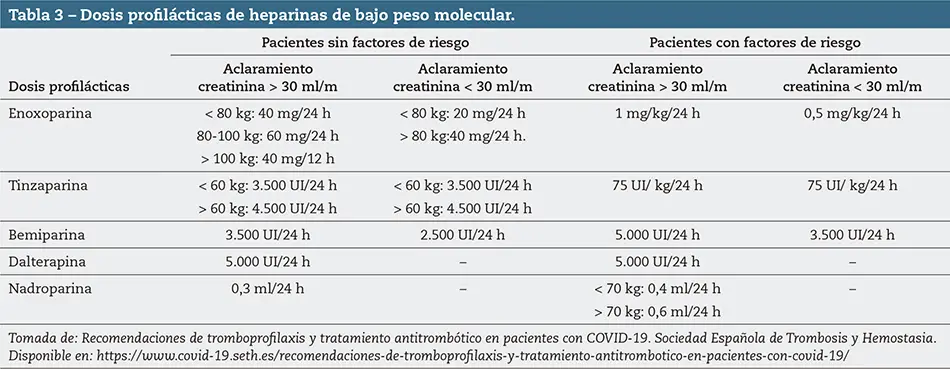
La Sociedad Española de Trombosis y hemostasia (SETH) recomienda realizar profilaxis antitrombótica precozmente con HBPM subcutánea en todos los pacientes hospitalizados, siempre que no existan contraindicaciones.
Para determinar las dosis profilácticas se deben considerar los factores de riesgo individuales de padecer complicaciones tromboembólicas (tablas 2 y 3). Se mantienen hasta el alta hospitalaria.
Si en el momento del alta persisten los factores de riesgo o existe restricción de movilidad o necesidad de permanecer en cama, se mantiene la profilaxis durante un mínimo de una semana o hasta recuperar un adecuado grado de movilidad.
Los pacientes asintomáticos o con sintomatología leve por lo general no precisan profilaxis con HBPM. En los que presentan sintomatología moderada o neumonía y no requieren ingreso hospitalario, se hace una valoración individual según los factores de riesgo, la situación clínica y los antecedentes individuales y familiares de episodios trombóticos; de existir dichos criterios se pauta la HBPM a dosis profilácticas (tabla 3).
En todos los pacientes se hacen las siguientes recomendaciones generales:
- Fomentar la deambulación (“caminar salva vidas”).
- Evitar permanecer de pie o sentado prolongadamente y evitar cruzar las piernas.
- Cambiar de posición cada 30-60 minutos y realizar ejercicios con las extremidades inferiores (movimientos de flexo extensión y movimientos circulares de los pies).
- Evitar la deshidratación.
En los pacientes anticoagulados por otras causas con anticoagulantes orales directos o con derivados de la vitamina K y que requieren tratamiento específico anti COVID-19, se recomienda sustituirlos por HBPM si no existe contraindicación; si no se requiere ingreso ni tratamiento para la COVID-19 se pueden mantener.
El tratamiento antiagregante no contraindica el uso de HBPM cuando es requerida.
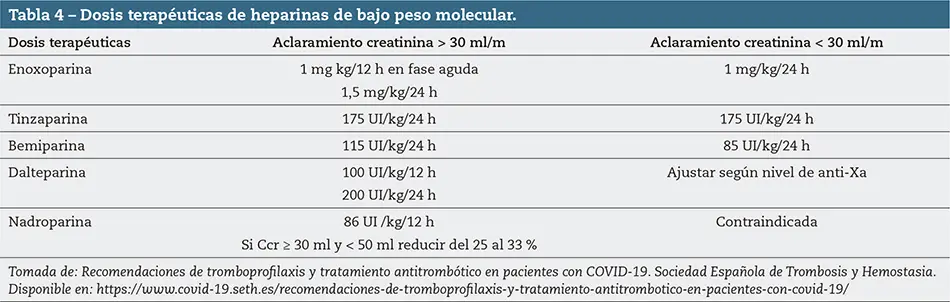
En los pacientes con enfermedad tromboembólica establecida o con trombosis venosa profunda se pauta HBPM SC a dosis terapéuticas (tabla 4). Tras el alta se mantiene el anticoagulante un mínimo de 3 a 6 meses.
En mujeres en tratamiento con anticonceptivos hormonales combinados se recomienda suspenderlos, salvo recomendación en contra por ginecología.
Por otra parte, la mujer embarazada, por su mayor riesgo de enfermedad tromboembólica, también se beneficia del tratamiento profiláctico tanto durante la gestación como en el puerperio. Si tiene enfermedad asintomática o leve se pautan dosis profilácticas de HBPM dos semanas; si la clínica es moderada o es necesario el encamamiento: HBPM a dosis profilácticas durante dos semanas y hasta 7 días tras la resolución del cuadro; si precisa ingreso: HBPM a dosis profilácticas durante ingreso. En el momento del alta se pauta profilaxis durante un mes. En el tercer trimestre se valora prolongar hasta el parto y hasta seis semanas postparto. En el puerperio, en caso de enfermedad leve o asintomática: HBPM a dosis profilácticas durante dos semanas; si se añade otro factor de riesgo, se prolonga hasta seis semanas; con clínica moderada o encamamiento, HBPM dos semanas y hasta 7 días tras la resolución del cuadro e inicio de movilización; si tiene que ingresar: HBPM a dosis profilácticas durante seis semanas14.
Oxigenoterapia
El tratamiento es escalonado según la gravedad (figura 2):
- De bajo flujo: menos de 40 L por minuto de gas, mediante cánulas nasales, mascarilla simple o mascarilla con reservorio.
- De alto flujo: mascarilla Ventimask; las gafas nasales proporcionan un volumen mayor de 40 L por minuto.
- Ventilación no invasiva: CPAP/BIPAP.
- Ventilación mecánica invasiva: tubo endotraqueal o traqueotomía.
- ECMO: oxigenador extracorpóreo de membrana, en situaciones de compromiso circulatorio y respiratorio2,15,16.
Otros fármacos que se están probando y con poca o ninguna experiencia
Vitamina D, vitamina C, famotidina, fluvoxamina, azitromicina, doxiciclina, infliximab, adalimumab, otilimab, abatacep y cenicriviroc.
Figura 2 – Estrategia terapéutica de escalamiento, apoyos integradores y manejo de la insuficiencia respiratoria aguda (Tomado de: Scala R, Heunks L. Eur Respir Rev. 2018; 27: 180008).
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Peramato Martín E. Coronavirus. Manejo COVID-19. La batalla al coronavirus Jaque, ¿pero será mate?. Editorial Letras de Autor; 2020.
- Peramato Martín E. Coronavirus. Un año de Pandemia. Manejo COVID-19 actualización. Seguimos en la batalla, más cerca del mate. Ediciones Monte Casino; 2021.
- Díaz E. Tratamiento farmacológico de la COVID-19: revisión narrativa de los Grupos de trabajo de Enfermedades Infecciosas y sepsis (GTEIS) y del Grupo de Trabajo de Transfusiones Hemoderivados (GTTH). Med Intensiva. 2021; 45: 104-21.
- Recovery Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL. Dexamethasone in hospitalized patiens with Covid-19. N Engl J Med. 2021; 384(8): 693-704. doi: 10.1056/NEJMoa2021436.
- Tardif JC, Bouaddallaoui N, Allier P, Gaudet D, Pillinger B, et al. Colchicine for community-treated patients with COVID-19 (COLCORONA): a phase III, randomized, double-Blinded, adaptive, placebo-copntrolled, multicentre trial. Lancet Respir Med. 2021; 9(8); 924-32. doi:10.1016/S2213-2600(21)00222-8.
- Agarwal A, Mukherjee A, Kumar G, Chatterjee P, Bhatnagar T, Malhotra P; Trial Collaborators. Convalescent plasma in the management of moderate COVID-19 in adults in India: open label phase II multicentre randomized controlled trial (PLACID Trial). BMJ. 2020; 371; m3933. doi: 10.11.36/bmj.m3939.
- Marconi VC, Ramanan AV, de Bono S, Kartman CE, Krishnan V, Liao R, et al. Efficacy and safety of baricitinib for the treatmen op hospitalized adults with COVID-19 (COV-BARRIER); a randomised double-blind, parallet-group, placebo controlled, phase 3 trial. Lancet Respir Med. 2021; 9(12): 1407-18. doi: 10.1016/S2213-2600(21)00331-3.
- Kali AC, Patterson TF, Mehta AK, Tomashesk KM, Woife CR, Ghazaryan V, et al. Baricitinib plus Remdesivir for Hospitalized Adults with COVID-19. N Engl Med. 2021; 384(9): 795-807. doi: 10.1056/NEJMoa2031994.
- Guimarães PO, Quirk D, Furtado RH, Maia LM, Saraiva JF, Antunes MO, et al. Tofacitinib in patients hospitalized with COVID-19 pneumonia. N Engl J Med. 2021; 385: 406-15. doi: 10.1056/NEJMoa2101643.
- Furlow B. COVACTA trial raises question about tocilizumab benefit in COVID-19. Lancet Rheumatol. 2020; 2(10): e592. doi: 10.1016/S2665-9913(20)30303-1.
- Gordon A, Mouncey P, Al-Beihd F, Rowan K, Nichol AD, Arabi YM, et al; The REMAP-CAP investigators. Interleukin-6 receptor antagonist in critically iii patients with COVID-19-Preliminary report. medRxiv. doi:10.1101/2021.01.07.21249390.
- Horby P, Pessoa-Amorim G, Peto L, Brighling CE, Sarkar R, Thomas K, et al; RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): preliminary results of a randomized, controlled open label, plataform trail. Lancet. 2021; 397(10285): 1637-45.
- Nadal Llover M, Cols Jiménez M. Estado actual de los tratamiento COVID-19. FMC. 2021; 28(1): 40-56. doi: 10.1016/j.fmc2020. 10.005.
- Recomendaciones de tromboprofilaxis y tratamiento antitrombótico en pacientes con COVID-19. Sociedad Española de Trombosis y hemostasia (on line) (Actualizada a 21 abril 2020). Disponible en: https://www.covid-19.seth.es/recomendaciones-de-tromboprofilaxis-y-tratamiento-antitrombotico-en-pacientes-con-covid-19/
- Cinesi Gómez C, Piñuelas Rodríguez O, Luján Tomé M, Egea Santaolalla C, Masa Jimenez JF, García Fernández J, et al. Recomendaciones de consenso respecto al soporte no invasivo en el paciente adulto con insuficiencia respiratoria aguda secundaria a infección por SARS-CoV-2. Arch Bronconeumol. 2020; 56(Suppl 2): 11-8. doi: 10.1016/j.medin.2020.03.005.
- Estrategia terapéutica respiratoria secundaria a COVID-19. Adaptación para el Servicio Murciano de Salud. Actualizada a 26/03/2020.