Artículo Original
Información del artículo
Historia del artículo:
Recibido el 12 de septiembre de 2019
Aceptado el 20 de diciembre de 2019
On-line el 24 de marzo de 2020
Palabras clave:
Vitamina D
25-hidroxivitamina D
Calcidiol
Electroquimioluminiscencia
*Autor para correspondencia
Correo electrónico:
jlmartinc@sescam.jccm.es
(J.L. Martín Calderón).
Keywords:
Vitamine D
25-hydroxyvitamin D
Calcidiol
Electrochemiluminescence
José Luis Martín Calderóna,*, Ana Cecilia Marín Guerrerob
aServicio de Análisis Clínicos; bUnidad de Apoyo a la Investigación. Hospital General Nuestra Señora del Prado.
Talavera de la Reina (Toledo).
Resumen
Objetivo. Evaluar el estatus de vitamina D en nuestra área, a través de los niveles séricos de 25-hidroxivitamina D (25OHD) en una muestra de individuos sanos.
Material y método. Se seleccionaron 145 individuos sanos entre los donantes de sangre de nuestro centro, a los que se extrajo sangre en tubo sin anticoagulante. El suero se obtuvo por centrifugación a 1.000 G durante 10 minutos. Se midió el 25OHD por un ensayo quimioluminsicente de unión competitiva a proteína. Se evaluó la normalidad de la variable 25OHD (ng/ml) mediante el test de Kolmogorov-Smirnov. Se estratificaron las concentraciones en cuatro categorías: 1) < 10; 2) 10-19,9; 3) 20-30; 4) > 30. Se compararon los datos de 25OHD por sexos y por los siguientes grupos de edad (años): 18-34, 35-54 y 55-65, mediante la aplicación del test c2.
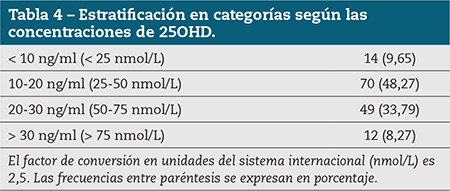
Resultado. La concentración media de 25OHD obtenida en la muestra fue de 19,21 (DS 7,23). La distribución resultó ser normal (p= 0,2). Se obtuvieron 14 individuos (9,65 %) con una concentración de 25OHD inferior a 10, mientras que 70 (48,27 %) estuvieron en el intervalo 10-20 y 49 (33,79 %) entre 20 y 30. Solo 12 individuos (8,27 %) mostraron niveles por encima de 30. No se hallaron diferencias significativas en los niveles de vitamina D entre sexos (p= 0,133) ni entre los grupos de edad considerados (p= 0,77).
Conclusiones. Se halló en nuestra muestra una elevada prevalencia de estado deficitario en vitamina D (considerando niveles inferiores a 20 ng/ml), en concordancia con otras series publicadas.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
AEvaluation of the vitamin D status in a population of the center of Spain by means of measuring the serum levels of 25-hydroyvitamin D
Abstract
Aim. Assessing the vitamin D status in our area, measuring 25-hidroxyvitamin D 25OHD sera levels in a healthy individual’s sample.
Material and methods. We chose 145 healthy individuals among the blood donors in our hospital, which blood was drawn on a dry container getting sera by centrifugation at 1.000 G for 10 minutes. We measured 25OHD using a chemiluminescent competitive protein binding assay. The Kolmogorov-Smirnov test was applied in order to demonstrate the normality of distribution for 25OHD (ng/ml). Concentrations were stratified in four categories: 1) < 10; 2) 10-19,9; 3) 20-30; 4) > 30. Concentrations data were compared by sex and the following age groups (y): 18-34, 35-54 and 55-65, applying the c2 test.
Results. The 25OHD mean concentration was 19,21. Distribution resulted normal (p= 0,2). Fourteen individuals (9,65%) showed a 25OHD concentration below 10, seventy (48,27%) within the 10-20 interval, while forty-nine (33,79%) were between 20 and 30 and 12 (8,27%) had concentrations upper 30. We didn’t find statistical significant differences between sexes (p= 0,33) neither age groups (p= 0,77).
Conclusions. We found a high prevalence of vitamin D deficiency (considered as lower than 20 ng/ml) in our sample in agreement with other published observations.
© 2019 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
La vitamina D (calciferol) es una sustancia que no se ajusta a la definición clásica de vitamina, ya que no se obtiene exclusivamente de la dieta, sino fundamentalmente de la síntesis cutánea por exposición a la radiación solar; es más propio considerarla una hormona por sus acciones biológicas y de control homeostático1. Las dos formas principales de vitamina D son el ergocalciferol (vitamina D2) y el colecalciferol (vitamina D3).
La vitamina D3 se sintetiza en los estratos profundos de la epidermis a partir de la fotoconversión del 7-hidroxicolesterol (provitamina D) proveniente del hígado por acción de la radiación ultravioleta (longitudes de onda de 290-315 nm), aunque una pequeña fracción puede obtenerse también de la dieta (pescados grasos como salmón o atún y yema de huevo).
La vitamina D2 se obtiene de la dieta en pequeñas cantidades por consumo de ciertos hongos expuestos al sol, que la sintetizan a partir del ergosterol1-4.
Tanto la vitamina D2 como la D3 circulan en la sangre unidas a una proteína, la VDBP (vitamin D binding protein) relacionada estructuralmente con la albúmina, la cual liga el 95-99 % de la vitamina D circulante; el resto es transportado por albúmina y lipoproteínas2.
Para convertirse en la forma biológicamente activa, la vitamina D (D2 y D3) tiene que metabolizarse mediante dos pasos de hidroxilación, el primero de los cuales tiene lugar en el hígado mediante la 25-hidroxilasa para producir 25-hidroxivitamina D o calcidiol (25OHD) y posteriormente en las células de los túbulos proximales del riñón mediante la 1-α-hidroxilasa para dar lugar a la 1,25-hidroxivitamina D o calcitriol (1,25(OH)2D), la forma biológicamente activa, que se une al receptor3,5. El mejor indicador del estatus de vitamina D en el torrente circulatorio es la 25OHD, ya que es el metabolito más abundante en circulación y además presenta una semivida de aproximadamente 3-4 semanas, frente a las 4-6 horas del 1,25(OH)2D, por lo que es el biomarcador cuya medición recomiendan las guías para evaluar la deficiencia3. Sin embargo, la sustancia biológicamente activa, el 1,25(OH)2D no refleja las reservas de vitamina D, por lo que se desaconseja su medición para evaluar el estatus de vitamina D2.
La vitamina D tiene múltiples acciones biológicas, que ejerce a través de la unión del 1,25(OH)2D a receptores citosólicos específicos, los VDR, que se unen en el núcleo con secuencias específicas de DNA conocidas como elementos de respuesta a la vitamina D (VDRE). Las acciones mejor conocidas, llamadas ahora acciones clásicas de la vitamina D, son las relacionadas con el mantenimiento de las concentraciones plasmáticas de calcio y fósforo, que facilitan la absorción intestinal y la reabsorción tubular renal de estos minerales1,6. Sin embargo, en los últimos años se ha podido comprobar que tanto el VDR como la enzima 1-α-hidroxilasa se expresan en tejidos no óseos como cerebro, intestino, próstata, mama y sistema inmunitario1,7, lo que hace que su déficit no solo se haya relacionado con enfermedades óseas, sino también con otros procesos patológicos como enfermedades autoinmunes, cáncer, enfermedades cardiovasculares y neuropsiquiátricas, entre otras8.
No hay un consenso unánime para definir los niveles óptimos de 25OHD en el suero. Durante años se definió la deficiencia de vitamina D asociada a los niveles por debajo de los cuales hay riesgo de raquitismo u osteomalacia (< 8-10 ng/ml). Más recientemente se definió el nivel óptimo de 25OHD como el que no produce una secreción compensatoria de parathormona dada la relación inversa entre ambas1,9; este umbral es de 30 ng/ml (75 nmol/L). La deficiencia10 se define cuando los niveles se hallan por debajo de 20 ng/ml (50 nmol/L).Se acuñó el concepto de insuficiencia en vitamina D para describir a los individuos con concentraciones séricas de vitamina D mayores que los que definen deficiencia, pero menores que los niveles óptimos.
Se consideran niveles tóxicos1 los que se encuentran por encima de 150 ng/ml (374 nmol/L). En la actualidad persiste la controversia para definir el punto de corte que marque insuficiencia, deficiencia y niveles óptimos para 25OHD. El comité del Institute of Medicine (IOM) de Estados Unidos11 propone como óptimas concentraciones de 25OHD superiores a 20 ng/ml (50 nmol/L); define como insuficiencia de vitamina D los niveles de 10-19 ng/ml (25-49 nmol/L) y la deficiencia de vitamina D los valores inferiores a 10 ng/ml (25 nmol/L), nivel por debajo del cual hay riesgo de raquitismo y osteomalacia. Por otro lado el grupo de la Endocrine Society de Estados Unidos3,12 y la International Foundation of Osteoporosis (IOF) recomiendan un nivel mínimo de 30 ng/ml (75 nmol/L) para la suficiencia.
Existe una amplia variabilidad en el estatus de vitamina D entre diferentes poblaciones, debido principalmente al grado de exposición a la radiación ultravioleta del sol. Así, en las regiones al norte del paralelo 36 la deficiencia de vitamina D es un problema relativamente prevalente13. Tanto los individuos de raza negra3,14 como los que usan protector solar de factor superior a 303,13 presentan una reducción de la síntesis dérmica de vitamina D. Además es más frecuente el déficit de vitamina D en los individuos obesos (IMC > 30 kg/m2), debido a que se trata de una vitamina liposoluble que es secuestrada por el tejido adiposo15. También hay factores patológicos y farmacológicos que pueden favorecer la deficiencia de vitamina D, como el uso de fármacos que aumentan el catabolismo de 25OHD y 1,25(OH)2D16.
En el presente estudio nos proponemos realizar una evaluación del estatus de vitamina D en el Área de Talavera de la Reina, a través de la medición de los niveles séricos de 25OHD en una muestra representativa de individuos sanos. De esta forma nos aproximamos a conocer la incidencia de la deficiencia e insuficiencia de vitamina D en el área sanitaria.
Material y métodos
Pacientes
La muestra de referencia se extrajo entre la población de donantes sanos que acudieron al Banco de Sangre que atiende al área sanitaria durante los meses de abril y mayo de 2016. Todos los individuos dieron su consentimiento informado para participar en el estudio. La selección de la muestra se realizó entre los voluntarios que cumplimentaron una encuesta de salud (Tabla 1). Se excluyeron los individuos que cumplían alguno de los criterios fijados por los autores que se consignan en la tabla 2. La edad de los pacientes estuvo comprendida entre 18 y 65 años.
Los participantes en el estudio fueron sometidos a una extracción de sangre en tubos sin anticoagulante; se aplicó el torniquete durante un tiempo inferior a 2 minutos para evitar la hemólisis y se obtuvo el suero tras 20 minutos en reposo para favorecer la retracción del coágulo, por centrifugación a 1.000 G durante 10 minutos. La presencia de hemólisis, lipemia o ictericia se definió como criterio de rechazo de las muestras. Una vez separadas, las muestras de suero se congelaron a -80ºC para su análisis posterior.
Metodología químico-analítica
Las concentraciones de 25OHD se midieron mediante un ensayo competitivo de unión a proteína con marcaje electroquimioluminiscente en el analizador E170 (Roche Diagnostics®, Manheim, Alemania). La 25OHD presente en la muestra es liberada de la VDP (proteína de transporte) y compite por la unión a una proteína fijadora de vitamina D (marcada con un quelato de rutenio) con un análogo de la 25OHD marcado con biotina. Al añadirse partículas magnéticas recubiertas de estreptavidina, estas se unen a la 25OHD biotinilada debido a la alta afinidad estreptavidina-biotina, lo que permite que el complejo se fije a la fase sólida y sea trasladado a la célula de medida por el magnetismo de las partículas. La aplicación de una diferencia de potencial en esta célula da lugar a la emisión de una radiación luminiscente por el rutenio, que es medida por un fotomultiplicador17.
Análisis estadístico
Se realizó un estudio descriptivo de la muestra. Los datos se representan en un histograma de frecuencias. La normalidad de la distribución se comprobó mediante el test de Kolmogorov-Smirnov. Los datos se agruparon en intervalos según las concentración de 25OHD usando los criterios del IOM11: 1) deficiencia grave (< 10 ng/ml); 2) deficiencia moderada (10-19,9 ng/ml); 3) 20-29,9 suficiencia; 4) al menos 30 ng/ml (estado óptimo).
Se compararon los datos obtenidos en la concentración de 25OHD por sexos y por los siguientes grupos de edad: 18-34 años, 35-54 años y 55-65 años.
Para la comparación de las concentraciones de 25OHD por sexos y grupos etarios se trató la variable concentración como dicotómica considerando dos categorías (deficiencia de vitamina D, para una concentración inferior a 20 ng/ml y suficiencia para una concentración superior a este nivel).
Se aplicó el test de c2 de Pearson para conocer la significación estadística. Se consideraron diferencias estadísticamente significativas para p< 0,05. El análisis estadístico se realizó con el software IBM SPSS versión 24.
Resultados
La muestra de estudio está formada por 145 voluntarios sanos de los cuales 92 (63,4 %) son hombres y 53 (36,6 %) mujeres. Por grupos etarios se contabilizaron 40 individuos (27,59 %) en el intervalo de 18-34 años, 79 (54,48 %) entre 35 y 54 años y 26 (17,93 %) entre 55 y 65 años. Las características descriptivas de la muestra se recogen en la tabla 3.
Cuando se estratificó la muestra según los rangos de concentración de 25OHD se obtuvieron frecuencias para cada rango, según se resume en la tabla 4.
En la figura 1 se representa el histograma de frecuencias que refleja la distribución de los niveles de 25OHD en la muestra estudiada, que sigue una distribución normal (p= 0,2 en el test de Kolmogorov-Smirnov).
Para evaluar si existen diferencias significativas entre la concentración de 25OHD y sexo o edad, la variable se categorizó como > 20 ng/ml (suficiencia) o inferior a 19,99 (insuficiencia). Según este criterio obtenemos que 84 individuos (57,9 %) se encuentran en estado de déficit o insuficiencia en vitamina D, mientras que 61 (42,1 %) se hallan en estado de suficiencia, sin que existan diferencias entre los niveles de 25OHD y el sexo y sexos (c2= 2,25, p= 0,133), o la edad (c2= 0,5, p= 0,77).
Figura 1 – Distribución de frecuencias en la muestra de estudio..
Comentarios
En los últimos años la determinación la vitamina D ha recibido una atención creciente de la comunidad científica, como demuestra el alto número de trabajos publicados, debido principalmente a su implicación en múltiples funciones y enfermedades más allá de las mejor conocidas, del metabolismo fosfocálcico y la salud ósea1-3. A ello ha contribuido el desarrollo de métodos automáticos, capaces de procesar gran número de muestras, para la medida del biomarcador de referencia en la evaluación del estatus de esta vitamina, el 25OHD5,18. Por el mismo motivo el número de peticiones solicitadas a los laboratorios clínicos para esta determinación ha crecido de modo exponencial. Sin embargo, las guías clínicas no recomiendan un cribado universal en la población; su monitorización debe limitarse a determinadas situaciones en las que hay riesgo de deficiencia en vitamina D3,19.
Los datos obtenidos en nuestro estudio confirman que la deficiencia de vitamina D es un problema muy prevalente incluso en países soleados como el nuestro. En efecto, si usamos los criterios de la IOM11 encontramos que en nuestra muestra el 57,9 % de los individuos se hallan en estado no óptimo de vitamina D (insuficiencia o deficiencia). Usando el criterio más estricto de la Endocrine Society12 solo el 7,6 % se halla en estado óptimo de vitamina D. Estos datos van en la misma dirección de los obtenidos en otros estudios más amplios. El estudio NHANES (National Health and Nutrition Examination Survey), que se llevó a cabo en Estados Unidos entre 1994 y 2004, concluyó que usando el punto de corte de 20 ng/ml se encontró más de un 30 % de individuos en estado de deficiencia o insuficiencia; en cambio, usando el más restrictivo umbral de 30 ng/ml, el 70 % de los individuos se hallaban en esta situación20. Los datos obtenidos en el mismo estudio los años 2005 y 2006 fueron aun peores: un 41,6 % de participantes con niveles de 25OHD inferiores a 20 ng/ml21.
Hay datos que indican que la prevalencia global de estados insuficientes y deficitarios de vitamina D se halla en aumento. Según el citado NHANES, la concentración media de 25OHD descendió de 30 a 24 ng/ml entre 1988 y 2004, y de 24 a 19,9 ng/ml entre 2004 y 200620. En la actualidad se estima que solamente el 20-25 % de la población mundial tiene niveles plasmáticos superiores a 30 ng/ml, y 25-30 % inferiores a 20 ng/ml22. Este aumento creciente de la prevalencia de estados deficitarios de vitamina D puede deberse a factores como el aumento de la obesidad, el envejecimiento progresivo de la población, la disminución del consumo de lácteos, el uso de filtros solares con alto factor de protección o la contaminación atmosférica que puede ejercer de filtro de la radiación solar12,21.
En nuestro país hay algún estudio que indica que un tercio de la población (33,9 %) tiene concentraciones plasmáticas de 25OHD inferiores a 20 ng/ml; en verano, primavera e invierno son inferiores a 27 %, 34 % y 37 %, respectivamente; solo el 18 % tenía valores superiores a 30 ng/ml23.
Los sueros de los pacientes se obtuvieron durante los meses de abril y mayo, época en la que no se suelen hallar los niveles más adecuados de 25OHD. En futuros estudios se puede plantear medir los niveles de vitamina D en diferentes estaciones; cabe esperar menor prevalencia de deficiencia de vitamina D durante los meses de verano y principio de otoño.
Conclusiones
Los niveles de 25OHD obtenidos en nuestro estudio son ligeramente mayores que los de otros países de nuestro entorno, aunque apuntan hacia la misma línea de estos, lo que confirma la alta prevalencia de los estados deficitarios de esta vitamina en los países occidentales.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Holick MF. Vitamin D deficiency. N Eng J Med. 2007; 357: 266-81.
- Herrmann M, Farrel CJ, Pusceddu I, Fabregat-Cabello N, Cavalier E. Assessment of vitamin D status – a changing landscape. Clin Chem Lab Med. 2017; 55: 3-26.
- Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Evaluation, treatment and prevention of vitamin D deficiency: An endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96: 1911-30.
- Ross AC, Taylor CL, Yakline A, del Valle HB. Dietary references intakes for calcium and vitamin D. Washington (DC): National Academies Press; 2011.
- Su Z, Narla S N, Zhu Y. 25-hydroxyvitamin D: Analysis and Clinical application. Clin Chim Acta. 2014; 433: 200-5.
- Mundy GR, Guise TA. Hormonal control of calcium homeostasis. Clin Chem. 1999; 45: 1347-52.
- Dusso AS, Brown AI, Slatopolsky E. Vitamin D. Am J Physiol Renal Physiol. 2005; 289: F8-28.
- Hosseinnezhad A, Holick MF. Vitamin D for health: a global perspective. Mayo Clin Proc. 2013; 88: 720-55.
- Malabanan A, Veronikis IE, Holick MF. Redefining vitamin D insufficiency. Lancet. 1998; 351: 805-6.
- Dawson Hughes B, Heaney RP, Holick MF, Lips P, Meunier PJ, Vieth R. Estimates of optimal vitamin D status. Osteoporos Int. 2005; 16: 713-6.
- Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute Medicine: what clinicians need to know? J Clin Endocrinol Metab. 2011; 96: 53-8.
- Holick MF, Binkley MC, Bischof-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Controversy in Clinical Endocrinology Guidelines for preventing and treating vitamin D deficiency and insuffiency. J Clin Endocrinol Metab. 2012; 97: 1153-8.
- Binkley N, Ramamurthy R, Krueger D. Low vitamin D status: definition, prevalence, consequences and correction. Endocrinol Metab Clin N Am. 2010; 39: 287-301.
- Hintzpete B, Scheidt-Nave C, Müller MJ, Schenk I, Mensik GB. Higher prevalence of vitamin D deficiency is associated with immigration background among children and adolescents in Germany. J Nutr. 2008; 138: 1482-90.
- Wortsman J, Maruska LY, Che TC, Lu Z, Holick MF. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr. 2000; 72: 690-3.
- Zhou C, Assen M, Tay JC, Wakins PB, Blumberg B, Schutz EG, et al. Steroid and xenobiotic receptor and vitamin D receptor mediated crosstalk mediates CYP2A expression and drug-induced osteomalacia. J Clin Invest. 2006; 116: 1703-12.
- Leino A, Turpeinen U, Koskinen P. Automated measurement of 25-OH vitamin D3 on the Roche Modular E170 analyzer. Clin Chem. 2008; 54: 2059-62.
- Cavalier E, Lukas P, Bekaert A C, Carlisi A, Le Golf C, Delayane P, et al. Analytical and clinical validation of the new Abbot Architect 25(OH)D assay: fit for purpose? Clin Chem Lab Med. 2017; 55: 378-84.
- Manson JE, Brannon PM, Rosen CJ, Taylor CL. Vitamin D deficiency. Is there really a pandemic. N Eng J Med. 2016; 37: 1817-22.
- Guinde AA, Liu MC, Camargo CA. Demographic differences and trends of vitamin D insufficiency in the US population, 1988-2004. Arch Int Med. 2009; 169: 626-32.
- Forrest KY, Studlreher WL. Prevalence and correlates of vitamin D deficiency in US adults. Nutr Res. 2011: 31-48.
- Van Schoor NM, Lips P, Worldwide vitamin D status. Best Pract Res Clin Endocrinol Metab. 2011; 25: 67-80
- González-Molero I, Morcillo S, Valdés S, Pérez-Valero V, Botas P, Delgado E, et al. Vitamin D deficiency in Spain. A population-based cohort study. Eur J Clin Nutr. 2011; 65: 321-8.