Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 22 de abril de 2021
Aceptado el 22 de abril de 2021
On-line el 6 de mayo de 2021
Palabras clave:
SARS-CoV-2
COVID-19 persistente
Alteración inmunológica Investigación
*Autor para correspondencia
Correo electrónico:
investigacionlongcovidacts@gmail.com
(S. Guerrero).
Keywords:
SARS-CoV-2
Persistent COVID-19
Immunological alteration
Research
Sílvia Guerrero Caballeroa,*, Sonia Bilbao Fernándezb
aDoctora en Bioquímica y Biología molecular. Coordinadora del Grupo de Investigación Long COVID ACTS. bVeterinaria. Coordinadora General del Proyecto Marco-19.
Resumen
Actualmente, existen importantes lagunas de conocimiento con respecto a la COVID-19, resultado de la infección por el virus SARS-CoV-2, debido a que ha transcurrido un periodo muy corto de tiempo desde su aparición.
Esta infección vírica ha presentado un abanico amplio de manifestaciones clínicas cuya gravedad ha variado mucho entre pacientes: personas que han requerido hospitalización, enfermos graves con consecuencias mortales, sujetos con síntomas de larga duración y otros asintomáticos.
Desde el grupo de investigación de Long COVID ACTS (pacientes con síntomas persistentes de la COVID-19) nos hemos centrado en el desarrollo de una hipótesis científica para que no se descarten (e incluso se potencien) proyectos de investigación basados en la persistencia del virus SARS-CoV-2 como causa etiológica de la sintomatología en los pacientes que presentan una clínica de COVID persistente/Long COVID (CP/LC).
© 2021 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Persistence of the SARS-CoV-2 virus as etiological cause of long-term symptoms in persistent COVID-19 patients
Abstract
At present, there are significant gaps in knowledge regarding the COVID-19, result of infection due to SARS-CoV-2 virus, since a very short period of time has passed since its appearance.
This viral infection has presented with a wide range of clinical manifestations whose severity has varied greatly among the patients: persons who have required hospitalization, very ill patients with fatal consequences, subjects with long-term symptoms and others who are asymptomatic.
From the research group of Long COVID ACTS (patients with persistent symptoms of COVID-19) we have focused on the development of a scientific hypothesis in order to not rule out (and even strengthen) research projects based on the persistence of the SARS-CoV-2 virus as etiological cause of the symptoms in patients who present Persistent/Long COVID clinical symptoms (CP/LC).
© 2021 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
La presentación clínica del paciente CP/LC no resulta compatible con las secuelas. Aunque no existe un patrón fijo en todos los pacientes, a menudo la sintomatología cursa con brotes en los que se pueden agudizar los síntomas e, incluso, pueden aparecer nuevas manifestaciones clínicas.
Estas nuevas apariciones de sintomatología en un alto número de casos suelen coincidir con cambios hormonales. Está descrito que dichos cambios producen cambios en la homeostasis del sistema inmunitario1. En la encuesta que se realizó a través de un formulario que se diseñó mediante un trabajo conjunto de la plataforma Long COVID y de los médicos de familia de la Sociedad Española de Médicos Generales y de Familia (SEMG), entre el 13 de julio y el 14 de octubre de 2020 (n= 2120), el 79 % de los participantes con clínica CP/LC fueron mujeres, con una media de edad de 43,3 años. Cabe también destacar que el 80 % de los pacientes diagnosticados de enfermedades autoinmunes son mujeres2.
La persistencia/reactivación periódica del virus puede ser el origen del estado inmunocomprometido que ha causado que en muchos pacientes con CP/LC se hayan reactivado otras infecciones víricas latentes: Epstein-Barr, citomegalovirus y herpes zóster, entre otros.
Un alto porcentaje de la subpoblación de pacientes que sufren CP/LC había manifestado previamente una respuesta inmunitaria alterada frente a diferentes estímulos externos, con una alta presencia de enfermedades autoinmunes, alergia y asma. De ello se infiere la peculiaridad de la respuesta del sistema inmunitario de esta subpoblación frente a determinados estímulos.
Confirmando el punto anterior, los pacientes con sintomatología CP/LC han presentado, en su mayoría, serología negativa o titulación muy baja de anticuerpos frente al virus SARS-CoV-2 (encuesta de la Plataforma, n= 218).
IgM (respuesta de fase aguda, temprana)
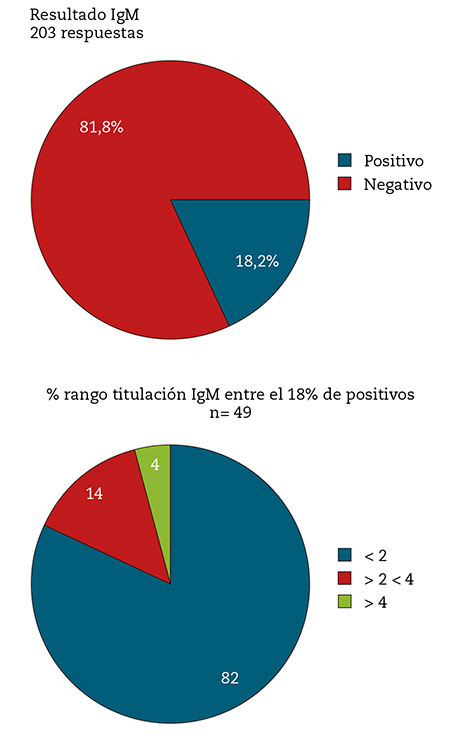
La mayoría de los pacientes con sintomatología CP/LC que participaron en la encuesta (82 %) no presentó niveles de IgM contra SARS-CoV-2 o presentaron niveles muy bajos (el 82 % de los positivos que disponen de titulación presenta valores por debajo de 2).
Se detectó un grupo minoritario diferente (2 % de los positivos que disponen de titulación), caracterizado por producir un grado extremadamente alto del anticuerpo IgM (Fig. 1).
IgG (respuesta de memoria, tardía)
La mayoría de los pacientes con sintomatología CP/LC que participaron en la encuesta (59 %) no presentó niveles de IgG contra el virus o presentaron niveles muy bajos (el 40 % de los positivos que disponen de titulación presenta valores por debajo de 2).
Los resultados varían ligeramente respecto de los de la IgM: aumenta el número de pacientes con CP/LC que generan anticuerpos de memoria y también el nivel respecto de los que los generan en la fase aguda. Se detectó un grupo minoritario diferente (5 % de los positivos que disponen de titulación), caracterizado por producir un grado extremadamente alto del anticuerpo IgG (Fig. 2).
IgA (respuesta de las mucosas)
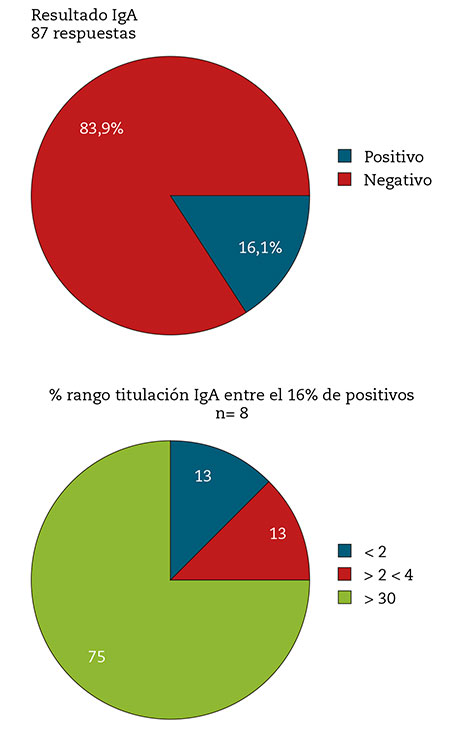
Se ha determinado con mucha menos frecuencia la generación de IgA en pacientes con CP/LC que han participado en la encuesta. El 84 % de a los que se la realizaron no presentó niveles de IgA contra el virus.
Los resultados se asemejan a los obtenidos en la generación de IgM; sin embargo, a diferencia de la IgM, entre los positivos que disponen de titulación de IgA se detectó un grupo mayoritario que presentaba valores muy elevados (75 % por encima de 30) (Fig. 3).
Figura 1 – Resultado de detección de IgM anti SARS-CoV-2 entre los encuestados pertenecientes a las plataformas de enfermos CP/LC en España (n= 203).
Figura 2 – Resultado de detección de IgG anti SARS-CoV-2 entre los encuestados pertenecientes a las plataformas de enfermos CP/LC en España (n= 209).
Figura 3 – Resultado de detección de IgA anti SARS-CoV-2 entre los encuestados pertenecientes a las plataformas de enfermos CP/LC en España (n= 87).
Ausencia de respuesta humoral
Solo un 10 % de los pacientes infectados por SARS-CoV-2 no presentan respuesta humoral contra el virus. Estos porcentajes pasan a ser mayoritarios en la población CP/LC.
La respuesta humoral anómala en estos pacientes puede indicar una respuesta de linfocitos T CD4+ ineficiente. Se ha descrito que la respuesta de células T CD4+ a la proteína espicular del SARS-CoV-2 en pacientes convalecientes fue potente y se correlacionó con la titulación de anti-SARS-CoV-2 para IgG e IgA3. La respuesta de células T CD4+ a SARS-CoV-2 es más prominente que la de las T CD8+3-5 y se ha asociado al control primario de la infección5. Consecuentemente, se encuentran menos células circulantes T CD8+ específicas de SARS-CoV-2 que células T CD4+3-5. La respuesta coordinada de células específicas CD4+ T, CD8+ T y anticuerpos es protectora, pero la respuesta descoordinada de los mismos frecuentemente falla en el control de la infección5.
CP/LC y síndrome de fatiga crónica
No todas las manifestaciones clínicas presentadas por los pacientes con CP/LC pueden asociarse al síndrome de sensibilización central/fatiga crónica, con el que muchos especialistas están empezando a relacionar los síntomas persistentes de SARS-CoV-2 (know-how de pacientes de la Plataforma diagnosticados previamente a la infección por SARS-CoV-2 con síndrome de fatiga crónica –SFC–).
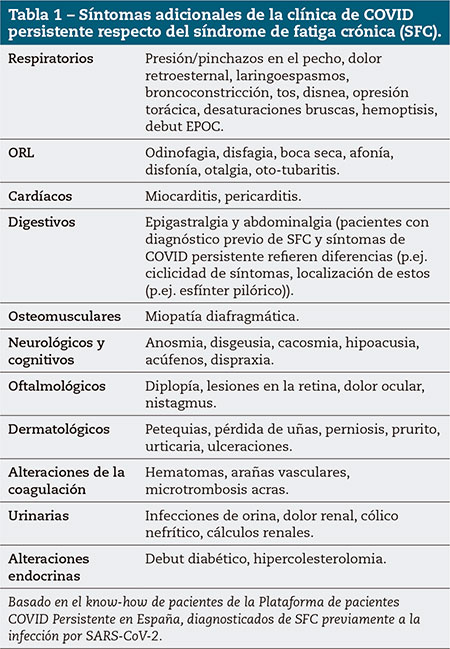
Pese a que los síntomas del SFC son múltiples y variados, en general, el abanico de síntomas de CP/LC es más extenso. En concreto, en pacientes con CP/LC se pueden añadir los síntomas de la tabla 1 a la relación de los de SFC.
En el SFC también se ha planteado la persistencia vírica como una de las posibles causas etiológicas6. Varios virus (Epstein-Barr, citomegalovirus…) que tienen afinidad por tejidos nerviosos pueden permanecer latentes en ellos. Si bien la latencia parece ocurrir en un tejido concreto, puede que la reactivación se propague a células gliales satélite, a través de las vías aferentes del nervio vago, lo que puede provocar una respuesta inmunitaria adaptativa exagerada, patológica, defectuosa y multiorgánica por vía de citoquinas proinflamatorias y otros mediadores neuroexcitantes. Actualmente, se está estudiando la conexión entre virus, nervio vago, tronco encefálico y neuroinflamación a través de nuevas técnicas de neuroimagen6.
La inflamación crónica producida por la persistencia vírica puede responder a las semejanzas entre las patologías CP/LC y SFC. Las diferencias pueden venir dadas por la clínica provocada por la propia patogenia del virus, ya que son virus distintos.
Antecedentes de virus que no se insertan en el ADN y presentan en ciertas subpoblaciones cronificación o persistencia
Virus de la hepatitis C
La hepatitis C aguda es una infección de corta duración. Los síntomas pueden durar hasta 6 meses. El sistema inmunitario puede eliminar la infección en la fase aguda solo en un pequeño subgrupo de pacientes. La mayoría pasa a la forma crónica de la infección por la ineficiencia en la eliminación del virus que presenta también manifestaciones extrahepáticas7.
Virus de la poliomielitis
Muchas personas que padecieron poliomielitis en la infancia experimentan con el paso de los años debilidad muscular sobrevenida, nueva atrofia muscular, fatiga y dolores musculares o articulares, así como intolerancia al frío. Esto es lo que se conoce como síndrome postpolio (SPP). Una de las hipótesis explicativas se basa en la persistencia de fragmentos de virus. El hallazgo de restos de virus en el líquido cefalorraquídeo de pacientes con SPP parece apoya esta teoría, pero son necesarios más estudios al respecto8.
Virus del Ébola
El síndrome post-Ébola está formado por un grupo de síntomas físicos y psicológicos que afecta a los supervivientes de la infección por este virus. Los síntomas más comunes reportados pertenecen al sistema neurológico (dolor de cabeza, cansancio, insomnio) y musculoesquelético (dolor de articulaciones, de pecho, general)9. El virus fue hallado en muestras de fluido seminal hasta 6 meses después de la infección inicial10.
Coronavirus felino
El coronavirus felino (FCoV) se transmite por vía fecal-oral e infecta de manera persistente principalmente a los enterocitos del colon. Se elimina de forma intermitente en las heces según el estado inmunológico. El paciente puede curarse o desarrollar un proceso subclínico que lo convierte en portador asintomático.
La enfermedad puede reaparecer como consecuencia de factores como la inmunosupresión provocada por virus, estrés, fármacos o edad avanzada.
Existe la posibilidad de reinfección por parte de este u otro animal a partir de sus heces, por lo que el virus es endémico.
Se ha identificado el colon como el lugar principal de persistencia de FCoV y fuente probable de diseminación recurrente, pero también se ha demostrado que el virus persiste en varios otros órganos, principalmente en macrófagos tisulares. Estos podrían representar fuentes adicionales de viremia recurrente11.
Debido a mutaciones in vivo o a la circulación de cepas (virulentas o no) entre gatos, la peritonitis infecciosa felina (PIF) se desarrolla cuando el FCoV adquiere la capacidad de penetrar en monocitos; posteriormente se propaga por la viremia asociada a los monocitos, persiste en el interior de macrófagos tisulares y evade la respuesta inmune. La patogenia de PIF y la progresión de la enfermedad está determinada por las interacciones del virus con el sistema inmunológico del gato, que dan lugar a una presentación de PIF seca (predominio de la respuesta celular) o a una efusiva (predominio de la respuesta humoral)12.
No obstante, años de estudios en gatos infectados con FCoV demuestran que aumentar el conocimiento sobre la biología del virus y sus interacciones con el huésped puede mejorar las posibilidades de contener y finalmente combatir la infección. Además, la información obtenida hasta ahora sobre los aspectos de la infección por FCoV compartida con el SARS-CoV-2 puede servir como base para un rápido desarrollo de estrategias de prevención o terapéuticas para la COVID-19, así como para estudios sobre la posible interacción entre FCoV y SARS-CoV-2, que pueden ocurrir debido a la estrecha relación entre personas y gatos13.
El SARS-CoV-2: un virus sistémico
El SARS-CoV-2 afecta/infecta de forma sistémica. En las autopsias de 27 pacientes se ha encontrado en múltiples órganos: pulmones, faringe, corazón, hígado, cerebro y riñones. Los niveles más elevados se han hallado en riñones, hígado, corazón, cerebro y sangre14; su vía de diseminación pueden ser los nervios periféricos15.
Persistencia en la mucosa olfatoria
Se ha demostrado persistencia viral de hasta 196 días más allá de la fase aguda en el sistema olfatorio16.
Se recogieron muestras de mucosa olfatoria con una técnica no invasiva usada en estudios de neurodegeneración e infecciosos. Todos los pacientes y ninguno de los controles tuvieron niveles detectables de RNA por RT-PCA del SARS-CoV-2 en las muestras citológicas analizadas de 110 a 196 días tras la infección. Todos presentaban pérdida persistente de olfato, gusto u otros déficits neurológicos en el momento de la prueba. En ninguno de ellos se obtuvieron niveles detectables de RNA de SARS-CoV-2 en muestras nasofaríngeas tomadas para el diagnóstico rutinario a través de RT-PCR16.
Persistencia en el intestino
Se analizó a 87 participantes con infección confirmada por RT–PCR de SARS-CoV-2 o por seroconversión durante un promedio de 191 días (6,2 meses; rango de 165 a 223 días) después del inicio de la clínica17. En esta cohorte los síntomas de la fase aguda duraron una media de 12 días (rango de 0 a 44 días) y el 11 % fueron hospitalizados. De acuerdo con otros reportes, el 44 %38 de los participantes reportaron persistencia de síntomas a largo plazo atribuibles a la COVID-19. Los 87 participantes dieron resultado negativo para SARS-CoV-2 en la visita de seguimiento a los 6 meses de la infección primigenia en una prueba estándar de PCR en la saliva.
Con el objetivo de determinar si se localizaba persistencia de antígeno viral en el intestino, se obtuvieron biopsias del tracto gastrointestinal alto y bajo de 14 de los individuos, una media de 4 meses (rango de 2,8 a 5,7 meses) después del diagnóstico inicial de COVID-19. Se realizó inmunotinción de las biopsias para determinar si se detectaba proteína viral, usando como control biopsias de individuos con fecha anterior a la pandemia (n= 10). Se detectó ACE2 y proteína N de SARS-CoV-2 en enterocitos intestinales de 5 de los 14 pacientes (36 %). La RT-PCR de muestra tomada con hisopo nasofaríngeo fue negativa en los 14 individuos en el momento de realizar la biopsia. Cuando se detectó, la inmunotinción resultó esporádica, parcheada, exclusiva del epitelio intestinal y no asociada a infiltrados inflamatorios. Sin embargo, en 3 de las biopsias se produjeron ampliaciones que por secuencia se verificaron como de SARS-CoV-2. Dos de estas biopsias fueron probadas para RNA viral por hibridación in situ; se detectó en las dos y en ninguno de los controles. La variabilidad del muestreo en el proceso endoscópico probablemente contribuye a la concordancia incompleta entre la detección de RNA viral y la proteína.
La respuesta de células B de memoria evolucionó durante los primeros seis meses tras la infección por SARS-CoV-2, con acumulación de mutaciones somáticas en las inmunoglobulinas y producción de anticuerpos con capacidad neutralizante más amplia y potente. La evolución persistente de los anticuerpos ocurre en los centros germinales y requiere que las células B sean expuestas de forma persistente al antígeno viral, atrapado en forma de inmunocomplejos en las células foliculares dendríticas. La observación de mRNA de SARS-CoV-2 y la expresión de proteína en el epitelio del intestino delgado en algunos individuos meses después de la infección primigenia concuerda con la evolución continua de las inmunoglobulinas17.
Persistencia en el pulmón, el bazo y la sangre
Un paciente de 45 años con síndrome grave antifosfolípido fue diagnosticado con una RT-PCR de muestra tomada con hisopo nasofaríngeo. Del día 6 al 68 hizo cuarentena en casa, pero durante este tiempo fue hospitalizado dos veces por dolor abdominal y una más por fatiga y disnea.
El día 39, el cycle threshold (Ct) en la RT-PCR para SARS-CoV-se incrementó a 37,8, lo que sugería resolución de la infección. El día 72 (después de otro ingreso por hipoxemia) el valor Ct disminuyó a 27,6 en RT-PCR de muestra tomada con hisopo nasofaríngeo, lo que sugería una recurrencia de la infección. Una prueba posterior de RT-PCR resultó negativa.
El día 143, en otra prueba de RT-PCR el valor Ct resultó 15,6, lo que indicaba una tercera recurrencia.
El día 150 se le efectuó intubación endotraqueal por hipoxemia. El día 151 se obtuvo un valor de Ct de 15,8, además de infección por Aspergillus fumigatus.
El día 154 el paciente murió por shock y fallo respiratorio. Se le realizó determinación de carga viral en muestras respiratorias (nasofaríngea y esputo) y plasma. Se encontraron 8,9 log10 copias por ml. Los estudios de biopsias hallaron un nivel más elevado de RNA de SARS-CoV-2 en los pulmones y el bazo. El análisis filogenético de la evolución viral fue coherente con la persistencia en el tiempo de la infección.
Este caso resalta la posibilidad de persistencia de la infección en pacientes inmunocomprometidos18.
Conclusiones
En la actualidad han surgido diferentes teorías para intentar explicar el origen de la sintomatología de CP/LC, entre ellas una alteración inmunológica persistente en el tiempo que puede derivar hacia procesos autoinmunitarios y persistencia viral. A partir del conocimiento generado por el feedback de los propios pacientes adheridos a la plataforma y las distintas experiencias científicas expuestas, el grupo de investigación Long COVID ACTS defiende que la hipótesis más factible es la combinación de ambas.
Parece que la persistencia vírica provoca que perdure una alteración inmunológica en el tiempo que deriva en inflamación crónica en el subgrupo de pacientes con síntomas duraderos.
Puede que en el subgrupo de pacientes con clínica CP/LC no se consiga eliminar por completo el SARS-CoV-2 tras la fase de infección aguda debido a que presenta una respuesta inmunológica alterada. El virus puede permanecer latente en algún reservorio (tejido o célula del sistema inmunitario) y reactivarse periódicamente al producirse cambios en la homeostasis del sistema inmunitario, lo que causa brotes de sintomatología, pero no hace que el virus sea detectable en las vías altas.
Por último, hay que destacar que algunos facultativos han prescrito individualmente tratamiento con antirretrovirales en pacientes CP/LC e incluso existe un ensayo clínico en curso cuya aproximación terapéutica considera que el virus sigue presente en pacientes con clínica CP/LC [CytoDyn Files Protocol with U.S. FDA for Phase 2 Clinical Trial for COVID-19 Patients with Long-Hauler Symptoms: CytoDyn Inc. (CYDY)].
En el entorno HIV/SIDA leronlimab actúa como un inhibidor de la entrada vírica; enmascara CCR5 y así protege a las células T sanas de la infección vírica al bloquear la entrada del subtipo predominante HIV.
Consideramos indispensable incrementar los esfuerzos en esta línea de investigación para intentar localizar el virus en la sangre o en otros tejidos en pacientes con CP/LC y comenzar ensayos clínicos controlados con antirretrovirales efectivos para SARS-CoV-2 en pacientes con clínica CP/LC. Dada la gran incapacidad que produce la enfermedad y que no existe tratamiento alternativo, el posible riesgo puede compensarse claramente con el posible beneficio.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Bouman A, Heineman, Faas MM. Sex hormones and the immune response in humans. Hum Reprod Update. 2005; 11: 411-23.
- Yuen GJ. Autoimmunity in women: an eXamination of eXisting models. Clin Immunol. 2020; 210: 108270.
- Grifoni A, Weiskopf D, Ramirez SI, Smith DM, Crotty S, Sette A. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals. Cell. 2020; 181: 1489-501.
- Sekine T, Perez-Potti A, Rivera-Ballesteros O, Ljunggren HJ, Aleman S, Buggert M. Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. Cell. 2020; 183: 158-68.
- Moderbacher CR, Ramirez SI, Dan JM, Smith DM, Sette A, Crotty S. Antigen-specific adaptive immunity to SARS-CoV-2 in acute COVID-19 and associations with age and disease severity. Cell. 2020; 183: 996-1012.
- Van Elzakker MB. Chronic fatigue syndrome from vagus nerve infection: a psycho neuro inmunological hypothesis. Med Hypotheses. 2013; 81: 414-23.
- Flores-Chávez A, Carrion JA, Forns X, Ramos-Casals M. Extrahepatic manifestations associated with chronic hepatitis C virus infection. Rev Esp Sanid Penit. 2017; 19: 87-97.
- Kumru H, Portell E. Síndrome Postpolio. FMC 2015; 22: 132-7.
- Wilson HW, Amo-Addae M, Kenu E, Ilesanmi OS, Ameme DK, Sackey SO. Post-Ebola syndrome among Ebola virus disease survivors in Montserrado County, Liberia 2016. Biomed Res Int. 2018; 2018: 1909410
- Brainard J, Pond K, Hooper L, Edmunds K, Hunter P. Presence and persistence of Ebola or Marburg virus in patients and survivors: A rapid systematic review. PLoS Negl Trop Di. 2016; 10: e0004475.
- Kipar A, Meli ML, Baptiste KE, Bowker LJ, Lutz H. Sites of feline coronavirus persistence in healthy cats. J Gen Virol. 2010; 91: 1698-707.
- Palmero M, Carballés V. Peritonitis infecciosa felina. Enfermedades infecciosas felinas. Servet. 2010.
- Paltrinieri S, Giordano A, Stranieri A, Lauzi S. Feline infectious peritonitis (FIP) and coronavirus disease 19 (COVID-19): Are they similar? Transbound Emerg Dis. 2020 [En prensa]. doi: 10.1111/tbed.13856
- Puelles VG, Lütgehetmann M, Lindenmeyer MY, Sperhake JP, Wong MN, Allweiss L, et al. Multiorgan and renal tropism of SARS-CoV-2. N Engl J Med. 2020; 383: 590-2.
- Fenrich M, Mrdenovic S, Balog M, Tomic S, Zjalic M, Roncevic A, et al. SARS-CoV-2 dissemination through peripheral nerves explains multiple organ injury. Front Cell Neurosci. 2020; 14: 229.
- Dias de Melo G, Lazarini F, Levallois S, Hautefort C, Michel V, Larrous F, et al. COVID-19-associated olfactory dysfunction reveals SARS-CoV-2 neuroinvasion and persistence in the olfactory system. Biorxiv. 2020 [En prensa]. doi.org/10.1101/2020.11.18.388819
- Gaebler C, Wang Z, Lorenzi JCC, Muecksch F, Finkin S, Tokuyama M, et al. Evolution of antibody immunity to SARS-CoV-2. Nature. 2021; 591: 639-44.
- Choi B, Choudhary MC, Regan J, Sparks JA, Padra RF, Qiu X, et al. Persistence and evolution of SARS-CoV-2 in an immunocompromised host. Correspondence. New Eng J Med. 2020; 383: 2291-3.