Artículo Original
Información del artículo
Historia del artículo:
Recibido el 21 de julio de 2021
Aceptado el 26 de octubre de 2022
On-line el 18 de noviembre de 2022
Palabras clave:
Dolor crónico intenso
Práctica clínica
Atención primaria
Opioides
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero).
Keywords:
Severe chronic pain
Clinical practice
Primary Care
Opioids
Antonio Alcántara-Monteroa,*, Julio Alberto Freire-Pérezb, Eva Trillo-Calvoc, Ana María Mur-Pérezd, Pedro Juan Ibor-Vidale, Juana Sánchez-Jiménezf
aCentro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres (Cáceres). bCentro de Salud Acea de Ama. Culleredo (La Coruña). cCentro de Salud Campo de Belchite. Belchite (Zaragoza). dCentro de Salud de Peralta (Navarra). eCentro de Salud Guillem de Castro. Valencia. fCentro de Salud Daroca. Madrid.
Resumen
Objetivos. Programa de actualización científica dirigido a médicos de atención primaria (MAP) para la mejora del tratamiento del dolor crónico intenso, a partir de la identificación de controversias en la práctica clínica habitual de atención primaria en España.
Métodos. Estudio transversal descriptivo mediante un cuestionario online de práctica clínica (31 preguntas, 5 bloques: valoración diagnóstica, inicio tratamiento, seguimiento, derivación y poblaciones especiales), enviado a un panel de MAP con al menos 10 años de experiencia en dolor crónico intenso. De los resultados se extrajeron controversias que se discutieron con los panelistas a partir de la experiencia disponible.
Resultados. Participaron 62 MAP (edad 50,1±9 años, 58,2 % hombres). Valoración diagnóstica. El 88,7 % del panel reportó medir la funcionalidad o calidad de vida del paciente con dolor crónico intenso y el 58 % identificar el tipo de dolor. Inicio del tratamiento. El principal factor condicionante para la elección del tratamiento analgésico es el mecanismo fisiopatológico. Se prioriza el uso del ascensor terapéutico en pacientes con dolor muy intenso; no obstante, un 54,8 % del panel no inicia habitualmente tratamiento con opioides potentes. Seguimiento. La mayoría del panel realiza rotación de opioides. Derivación. La Unidad del Dolor es la referencia para la derivación de estos pacientes (87,1 %). Se reportan limitaciones logísticas en algunas zonas. Poblaciones especiales. Tapentadol es el opioide más utilizado en EPOC (74,2 %), insuficiencia hepática (61,3 %) y renal (56,5 %), y en pacientes polimedicados (82,3 %).
Conclusiones. Las controversias existentes en la práctica habitual del dolor crónico intenso de los MAP en España ponen de manifiesto la necesidad de formación continuada.
© 2022 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Detecting and solving controversies in the management of intense chronic pain in the primary care clinical practice in Spain: DOLOVERSIAS Program
Abstract
Aim. Scientific update for Spanish Primary Care Physicians (PCPs) to help improve the treatment of severe chronic pain, according to existing controversies identified in their routine clinical practice.
Methods. A descriptive cross-sectional study was performed through an online questionnaire (31 questions, 5 blocks: diagnostic, treatment initiation, follow-up, referral and special populations), which was sent to a panel of Spanish PCPs with ≥ 10 years of experience in severe chronic pain. The results unveiled existing controversies for which relevant bibliography was selected and presented in local meetings with the same PCPs that responded the questionnaire.
Results. 62 PCPs participated (age 50.1 ± 9 years, 58.2% men). Diagnostic. 88.7% of the panel reported measuring the functionality and/or quality of life of patients with severe chronic pain and 58% identifying the type of pain. Treatment initiation. The main conditioning factor for the analgesic treatment choice is the pathophysiological mechanism, using an “analgesic lift” strategy in patients with very intense pain; however, 54.8% of the panel does not usually start treatment with strong opioids. Follow-up. Most of the panel performs opioid rotation. Referral. Most patients are referred to Pain Management Units (87.1%), despite local variations. Special populations. Tapentadol is the opioid most widely used in COPD (74.2%), liver and kidney failure (61.3% and 56.5%, respectively) and polypharmacy (82.3%). Conclusions. The existing controversies in the routine clinical practice of chronic pain of PCPs in Spain highlight the need for continued training in this.
© 2022 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
El dolor crónico, definido como el que perdura más de 3 meses, tiene una prevalencia en España del 17 % y representa un importante problema de salud pública con gran impacto en la calidad de vida de los pacientes, tanto a nivel social como laboral1.
En su origen, el dolor crónico suele tener un componente mixto (nociceptivo y neuropático). Adicionalmente, suele presentar elementos de sensibilización central, causada por alteraciones fisiológicas de la transmisión del dolor o de las vías descendentes moduladoras del dolor2.
Establecer cuál es el mecanismo dominante de dolor, junto con su intensidad, permite la clasificación del paciente e individualizar los objetivos terapéuticos3, los cuales van encaminados a mantener el dolor en un nivel aceptable2. En el caso concreto del dolor intenso, definido por una puntuación mayor de 7 en la escala visual analógica (EVA), la Organización Mundial de la Salud (OMS) recomienda el uso de opioides potentes para su tratamiento4.
En general, los opioides son fármacos de uso complejo, por la necesidad de titulación, el cuestionamiento de su efectividad a largo plazo y, sobre todo, por su perfil de seguridad y el riesgo de intolerancia, dependencia o abuso5.
Los médicos de atención primaria (MAP) son a menudo los primeros en diagnosticar y tratar las enfermedades que causan dolor, tanto agudo como crónico6, lo que supone un reto teniendo en cuenta la gran presión asistencial y la diversidad de patologías que atienden en su práctica clínica diaria. En este sentido, el proyecto Pain Proposal, dirigido a identificar las carencias actuales en el abordaje del dolor crónico en Europa, mostró que la mayoría de médicos involucrados cree que una mejora de su formación permitiría un manejo más eficaz del dolor de sus pacientes7.
Así pues, se implementó un programa de actualización científica dirigido a MAP sobre el abordaje de pacientes con dolor crónico intenso, a partir de la identificación de controversias existentes en la práctica clínica habitual y su posterior contraste con la experiencia disponible (Programa DOLOVERSIAS).
Métodos
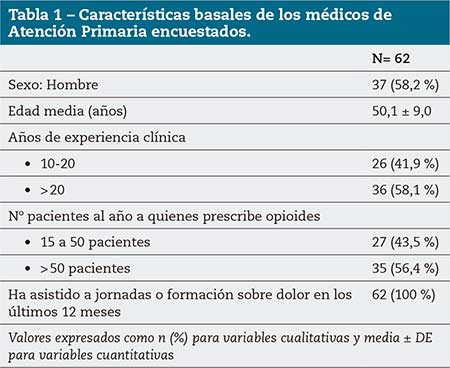
En una primera fase se realizó un estudio transversal descriptivo de la práctica clínica habitual del dolor crónico intenso en atención primaria (AP) en España. Para ello, un comité científico formado por 6 MAP elaboró un cuestionario online de práctica clínica con 31 preguntas de respuesta múltiple, divididas en 5 bloques temáticos: valoración diagnóstica, inicio del tratamiento, seguimiento, derivación y poblaciones especiales. Dicho cuestionario fue enviado a un panel de 62 MAP.
El comité científico constaba de representantes de los grupos de trabajo de dolor de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN) y de la Sociedad Española de Médicos Generales y de Familia (SEMG). Los MAP del panel, con representación territorial, debían tener al menos 10 años de experiencia clínica en dolor crónico intenso, emplear de forma habitual opioides en su práctica clínica (al menos 15 pacientes/año) y haber asistido a jornadas/formación sobre dolor en los últimos 12 meses.
Los resultados del cuestionario fueron descritos por frecuencias (porcentajes de respuesta ± desviación estándar).
En la segunda fase del programa, y a partir de los resultados obtenidos, el comité científico identificó una serie de controversias (actitudes no esperadas o divergentes con respecto a las guías terapéuticas o la realidad clínica en España) y elaboró una presentación con las principales experiencias relacionadas con cada controversia. Este documento fue utilizado para presentar los resultados y discutir las controversias identificadas junto con la bibliografía de apoyo en 7 reuniones locales (en formato videollamada), lideradas por un miembro del comité y con la participación de los mismos MAP que respondieron el cuestionario en la primera fase.
Figura 1 – Comunidad Autónoma de procedencia de los MAP participantes en el programa.
Resultados del cuestionario de práctica clínica
Los principales resultados obtenidos en cada bloque temático, que permitieron identificar posibles controversias, se detallan a continuación:
Valoración diagnóstica
El 69,3 % de los participantes consideró como dolor crónico un dolor que dura más de 3 meses, de forma continua o intermitente, más de 5 días a la semana. El 77,4 % lo consideró intenso cuando la puntuación en la EVA es mayor de 7. El 88,7 % del panel reportó medir la funcionalidad o calidad de vida del paciente con dolor crónico intenso y el 58,1 % identificar el tipo de dolor por clínica y cuestionarios.
Inicio del tratamiento
Los objetivos terapéuticos del 98,4 % de los panelistas incluyen reducir el dolor y mejorar la funcionalidad y la calidad de vida del paciente. El mismo porcentaje evalúa las expectativas de tratamiento con sus pacientes. No hubo una opinión mayoritaria sobre qué se considera una buena respuesta al tratamiento, ni sobre el factor en el que basar la estrategia terapéutica. Un 54,8 % reportó no iniciar habitualmente tratamiento con opioides potentes. En relación con las dosis iniciales de opioides potentes, un 48,4 % del panel utiliza dosis bajas de inicio retardado. Un 25,9 % del panel reportó realizar consentimiento informado (CI) verbal con sus pacientes y reflejarlo en la historia clínica antes de iniciar el tratamiento con opioides potentes.
Seguimiento
Un 85,5 % del panel realiza rotación de opioides, si bien un 33 % no usa tablas de equianalgesia o similares (aplicaciones).
Derivación
La Unidad del Dolor es la referencia mayoritaria para la derivación de pacientes con dolor crónico intenso (87,1 %), aunque se reportaron ciertas limitaciones logísticas para tal derivación en algunas zonas.
Poblaciones especiales
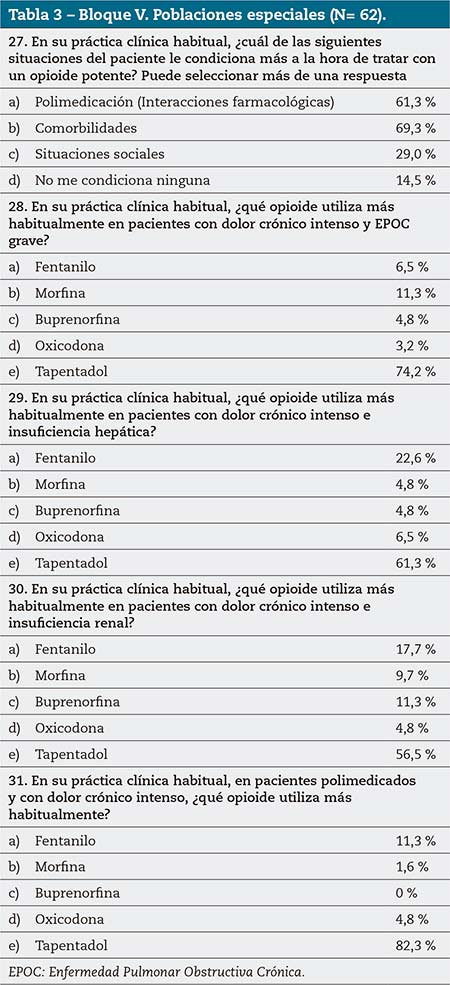
La polimedicación (61,3 %) y las comorbilidades (69,3 %) son las situaciones que más condicionan la prescripción de un opioide. El tapentadol es el opioide que más se utiliza en AP para el tratamiento del dolor crónico intenso en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) (74,2 %), insuficiencia hepática (61,3 %), insuficiencia renal (56,5 %) o polimedicados (82,3 %).
Comentario
El cuestionario del programa DOLOVERSIAS permitió describir la práctica clínica habitual del abordaje del dolor crónico intenso por parte de un panel de MAP con experiencia. A partir de los resultados, el comité científico identificó varias controversias (actitudes no esperadas o divergentes frente a las guías o la realidad clínica en España) que se discutieron con todos los panelistas en reuniones locales. Dichas controversias, junto con la evidencia relacionada disponible y la experiencia de los clínicos participantes en el programa, se comentan a continuación.
Valoración diagnóstica
En el cuestionario de práctica clínica un 88,7 % del panel reportó medir la funcionalidad o calidad de vida del paciente con dolor crónico intenso; no obstante, los datos del estudio RADAR, en el que se evaluaron diferentes aspectos de la atención del paciente con dolor crónico articular en España, indican que el 82,4 % de los MAP no utiliza escalas para valorar la afectación en la calidad de vida del paciente8. Esta divergencia se debe a que los MAP, en su práctica diaria, utilizan sus propias escalas de valoración, preguntando al paciente por la repercusión del dolor en su calidad de vida y funcionalidad de manera informal (“¿Ha ido a hacer la compra?”, “¿ha salido a pasear?”), pero sin utilizar cuestionarios reglados por falta de tiempo, principalmente.
Es importante el uso de cuestionarios de calidad de vida y funcionalidad, ya que permiten valorar de forma cuantitativa y objetiva una entidad compleja y cualitativa como es el dolor. Este hecho facilita la posterior evaluar de la evolución de los pacientes y su respuesta al tratamiento. Es necesario remarcar que no solo debe valorarse la funcionalidad, sino también el estado anímico del paciente, ya que el impacto del dolor crónico intenso en la calidad de vida se asocia con depresión. Entre los cuestionarios de calidad de vida hay varios que se usan frecuentemente (algunos han sido validados en español), tales como el cuestionario de salud de 36 ítems (SF-36) y su versión corta, de 12 ítems (SF-12) y el WOMAC (diseñado por las universidades de Western Ontario y McMaster)9; este último es específico para la osteoartrosis de cadera y de rodilla. En general, por su agilidad, se recomienda el uso del actual SF-12.
Por otro lado, solo el 58,1 % de los MAP utilizan cuestionarios (además de la clínica) para identificar el tipo de dolor en sus pacientes. Este porcentaje se considera bajo, teniendo en cuenta que estos cuestionarios son habitualmente necesarios para diferenciar entre dolor neuropático o nociceptivo. Los panelistas no suelen utilizar escalas validadas, sino que preguntan al paciente por su percepción del dolor y la realización de actividades diarias; de nuevo la falta de tiempo es el principal motivo. Entre los cuestionarios que se puede utilizar para identificar el dolor neuropático están el DN4 o el ID-Pain10. Además, se puede realizar la identificación de dolor de sensibilización central mediante la historia clínica y el examen físico, a partir de la presencia de signos como hiperalgesia, alodinia, patrón impredecible o alta discapacidad funcional, entre otros11.
Es destacable que la gran mayoría del panel (83,9 %) solicita pruebas complementarias en pacientes con dolor crónico intenso. En general, las pruebas deben solicitarse cuando se sospecha que el dolor no está bien estudiado o para su correcta filiación (descartar metástasis), cuando cambian las características del dolor o cuando las pruebas se realizaron hace tiempo. Algunos panelistas reportaron además solicitar pruebas complementarias cuando el paciente requiere derivación a otro nivel asistencial. En cualquier caso, los resultados del cuestionario muestran que la mayoría de los MAP no esperan al resultado de las pruebas para iniciar el tratamiento analgésico.
Inicio del tratamiento
Existe una gran diversidad de criterios a la hora de considerar lo que es una buena respuesta al tratamiento. En general, los panelistas están de acuerdo en que es importante alcanzar un porcentaje de reducción del dolor que cumpla las expectativas del paciente, previamente pactadas a partir de criterios realistas y objetivos.
En cuanto al porcentaje de reducción del dolor a alcanzar, el documento de consenso de la SEMG, Sociedad Española de Medicina de Familia y Comunitaria (semFYC) y SEMERGEN, sobre el dolor crónico no oncológico (DCNO) en AP, establece que uno de los objetivos a alcanzar en el plan terapéutico integral (PTI) de este tipo de pacientes es reducir la intensidad del dolor desde el inicio en un 30 % según la escala visual numérica (EVN) (figura 2)6. Del mismo modo, las guías canadienses para el uso efectivo y seguro de opioides para DCNO también indican que, a la hora de medir la efectividad de un fármaco, una reducción al menos 30 % de la intensidad del dolor en relación con el basal se considera clínicamente significativo12. En cualquier caso, la valoración de la reducción del dolor con el tratamiento debe basarse en criterios objetivos, lo que nuevamente pone de manifiesto la importancia de utilizar escalas validadas. Adicionalmente, los MAP también consideran una buena respuesta al tratamiento cuando existe mejoría en la funcionalidad o calidad de vida del paciente.
Figura 2 – Objetivos a alcanzar en el PTI del paciente con dolor crónico no oncológico.
Por otro lado, los factores que influyen en la elección del tratamiento analgésico son heterogéneos. En general, se tienen en cuenta la intensidad del dolor, los tratamientos previos, las circunstancias personales y antecedentes del paciente, y las comorbilidades. No obstante, cada vez cobra más relevancia basar el tratamiento en el mecanismo fisiopatológico causante del dolor. En esta línea, y teniendo en cuenta que existen fármacos que actúan periféricamente (sobre los procesos de la inflamación y los nociceptores) y otros que actúan sobre neurotransmisores en las vías ascendentes y descendentes del sistema somato-sensorial (antidepresivos, antiepilépticos, opioides), el consenso SEMG-semFYC-SEMERGEN recomienda el tratamiento multimodal relacionado con el mecanismo etiopatogénico del dolor y proporcional a su intensidad e impacto en el paciente6. En este sentido, los opioides atípicos, también llamados multigésicos (por sus mecanismos de acción duales o múltiples) son fundamentales para tratar eficazmente el dolor crónico, generalmente de tipo mixto13. De hecho, durante las reuniones locales, los panelistas estuvieron de acuerdo en que es óptimo disponer de fármacos que actúen sobre el dolor de origen nociceptivo y neuropático a la vez (como tapentadol, por ejemplo, por su doble mecanismo de acción basado en el agonismo μ opioide y la inhibición de la recaptación de la noradrenalina)14 para proporcionar analgesia multimodal, ya que la mayor parte del dolor es de naturaleza multifactorial13,15. Además, tapentadol ha demostrado un mejor perfil de tolerabilidad que el de los opioides clásicos14,16-18.
En cuanto a la estrategia terapéutica, en general, los panelistas opinan que en pacientes con dolor muy intenso se debe utilizar el ascensor analgésico en vez de la escalera, en línea con lo que establece el documento de consenso SEMG-semFYC-SEMERGEN. En dicho documento, se reconoce la utilidad clínica que supuso la creación de la escalera analgésica, pero actualmente se considera más adecuado que, en los pacientes que precisen una escalada terapéutica más rápida por las características de su dolor, se emplee el ascensor terapéutico6.
En cuanto al uso de opioides potentes (típicos o de acción multimodal) para el tratamiento del dolor crónico intenso, solo el 45,1 % de los panelistas los utiliza, lo que refleja un infratratamiento de estos pacientes en la práctica clínica. Este hecho ya se identificó en el proyecto Pain Proposal, en el que se estimó que el 17 % de la población española sufría de dolor crónico (definido como dolor durante 6 meses); de ellos, un 29 % consideraba que no recibía un tratamiento adecuado19. En Europa, el porcentaje de afectados con dolor crónico era del 19 %; de estos, un 34 % presentaba dolor crónico intenso y estaba tratado con opioides potentes solo el 5 %1. Este infratratamiento puede deberse, en parte, a la falta de experiencia en el empleo de este tipo de fármacos por parte de un gran número de MAP. Adicionalmente, las reticencias de algunos pacientes pueden limitar también su uso en la práctica clínica. Por otro lado, aunque en oncología el ascensor terapéutico está muy implementado, en otras patologías todavía no es así, y muchos MAP siguen iniciando el tratamiento de estos pacientes con fármacos no opioides del primer escalón [antiinflamatorios no esteroideos (AINE) o metamizol], o con asociaciones analgésicas a dosis fijas, como paracetamol con tramadol o codeína. No obstante, es necesario tomar conciencia de que el correcto tratamiento del dolor es un derecho del paciente20; para ello, se recomienda seguir las indicaciones vigentes de la OMS sobre el tratamiento del dolor crónico con intensidad superior a 7 en la EVA, y utilizar opioides mayores6.
En los pacientes con dolor crónico intenso, a quienes se prescriben opioides por primera vez, el 75 % del panel lo hace con dosis bajas (48 % de inicio retardado; 27 % de inicio rápido) y van aumentándolas progresivamente al tiempo que monitorizan la tolerabilidad. Esta práctica sigue las recomendaciones de las diversas guías de tratamiento del DCNO21,22, que indican que la terapia a largo plazo con opioides debe comenzarse con dosis bajas e ir aumentándolas lentamente hasta que se alcance un nivel adecuado de analgesia, o hasta que los efectos adversos aconsejen una reducción de la dosis o un cambio en el tratamiento. Entre las formulaciones de liberación inmediata, se requiere un mínimo de 7 días para el incremento de dosis (fentanilo según formulación)22; entre las formulaciones de liberación prolongada, como la morfina y oxicodona, se recomienda esperar 14 días (aunque el mínimo es 2 días), mientras que el tapentadol se puede incrementar a los 3 días y el fentanilo a los 622 (tabla 2).
Los panelistas estuvieron de acuerdo en que antes de iniciar un tratamiento con un opioide potente es necesario dar toda la información relacionada con el tratamiento a los pacientes de la forma más clara posible. Además, un cuarto del panel realiza un consentimiento verbal informado y lo refleja en la historia clínica. En este sentido, la guía de consenso de 2017 de la Sociedad Científica Española de Estudios sobre el Alcohol, el Alcoholismo y las otras Toxicomanías (Socidrogalcohol) proporciona un modelo de consentimiento informado que se puede usar para la indicación de analgésicos opioides en el tratamiento del DCNO y otro para opioides potentes y de acción ultrarrápida fuera de las indicaciones autorizadas en su ficha técnica21.
Seguimiento
Una vez que el dolor está controlado, un tercio de los panelistas no tiene claro cuándo poder reducir o retirar los opioides. Durante las reuniones locales se remarcó la importancia de realizar esta reducción/retirada de forma individualizada tras un tiempo de control del dolor, según la funcionalidad y calidad de vida del paciente, para poder disminuir los efectos adversos del mantenimiento del tratamiento a largo plazo (hiperalgesia, neurotoxicidad o desarrollo de adicción)21.
Ante la dicotomía de si retirar o rotar un opioide cuando éste no es eficaz, los panelistas parecen decantarse en general por la rotación para valorar si un mecanismo de acción distinto puede ser eficaz, ya que no existe tolerancia cruzada entre opioides. Para ello, un 66 % del panel utiliza tablas de equianalgesia o aplicaciones en dispositivos electrónicos, en línea con las recomendaciones vigentes23,24. Utilizan menos la rotación progresiva y paulatina porque es más compleja para el paciente. Al hacer la rotación, se tiende a reducir un 25-30 % la dosis de opioide; se puede disminuir la dosis calculada un 25-50 %23,24. Otra posibilidad es la rotación o modificación de la dosis de coadyuvantes. El documento de consenso para la atención al paciente con DCNO en AP6 proporciona en su anexo XIV una tabla de rotación de opioides fácil de utilizar. La rotación de opioides se puede utilizar también en caso de efectos adversos que no se autolimitan con la tolerancia6.
Derivación
A pesar de que la gran mayoría (87 %) de los panelistas tienen a la Unidad de Dolor como el especialista de referencia para la derivación de los pacientes con dolor crónico intenso, en el cuestionario y, especialmente en las reuniones locales, se reportaron ciertas limitaciones de acceso a dichas unidades. Las limitaciones varían mucho entre comunidades autónomas, e incluso entre provincias. En general, si se tiene acceso a la Unidad de Dolor o, en su defecto, a rehabilitación, los pacientes no se derivan a otra especialidad; no obstante, muchas veces los pacientes tienen que ser remitidos a otros especialistas (traumatología o medicina interna), porque el protocolo establecido así lo exige o porque la espera para ser atendido en la Unidad de Dolor es muy larga. En este sentido, deberían potenciarse las consultas virtuales entre la AP y la Unidad de Dolor para evaluar si el paciente requiere derivación o si, con el apoyo del especialista, se puede tratar desde AP.
Poblaciones especiales
Los panelistas reportaron usar mayoritariamente tapentadol en pacientes con dolor crónico intenso y EPOC (74,2 %), insuficiencia hepática (61 %), insuficiencia renal (56 %) o polimedicados (82 %) (tabla 3). Estos porcentajes elevados de uso de tapentadol pueden deberse al perfil experto de los MAP participantes en el programa (al menos 10 años de experiencia, prescriptores de opioides a al menos 15 pacientes/año, formados en dolor en los últimos 12 meses) según lo expuesto en la tabla 1.
Llama la atención el elevado uso de tapentadol en pacientes con EPOC, ya que con los agonistas μ-opioides la principal preocupación es la depresión respiratoria, por lo que deben utilizarse con precaución en caso de insuficiencia respiratoria25. En una revisión de los datos de seguridad post-comercialización de tapentadol, se observó que había pocos efectos adversos de depresión respiratoria; no obstante, estos se presentaban sobre todo en pacientes con factores de riesgo de depresión respiratoria, incluyendo la EPOC26. De hecho, el documento de consenso SEMG-semFYC-SEMERGEN recomienda el tramadol en pacientes con enfermedades respiratorias por su menor potencial de depresión respiratoria6.
Con respecto a la enfermedad hepática y renal, el tapentadol no requiere ajuste de dosis en caso de insuficiencia hepática leve (sí en moderada) o de insuficiencia renal leve o moderada (aunque no se recomienda en caso de insuficiencia hepática o renal grave)27.
En cuanto a los pacientes polimedicados, los opioides que se metabolizan principalmente por la vía del citocromo (CYP) pueden desencadenar interacciones medicamentosas28; sin embargo, el tapentadol se metaboliza principalmente mediante la uridina difosfato-glucuroniltransferasa (UGT)28, por lo que no está sujeto a interacciones con otros fármacos inductores o bloqueadores de la vía del CYP (antidepresivos, antiepilépticos, y fármacos cardiovasculares)29. En general, excepto con otros fármacos que se metabolicen mediante UGT, no presenta problemas de interacciones y destaca su nula interacción con AINE30. Además, la unión del tapentadol con las proteínas plasmáticas es baja (20 %), por lo que es difícil que produzca interacción por desplazamiento de otros fármacos de estas proteínas29.
Conclusión
Las controversias detectadas en el programa DOLOVERSIAS ponen de manifiesto que existen ciertas áreas de mejora en relación con el manejo del dolor crónico intenso en la práctica clínica de la AP, incluso entre MAP con experiencia en el manejo del dolor. El programa ha permitido discutir dichas controversias y contrastarlas con la experiencia disponible.
Se espera que la difusión de los hallazgos del programa ya sea a través de la presente publicación, como a través de las múltiples reuniones locales adicionales lideradas por MAP del panel, contribuya, en la medida de lo posible, a optimizar y homogeneizar el abordaje de estos pacientes.
Agradecimientos
Los autores agradecen especialmente a los participantes a las reuniones locales del Programa DOLOVERSIAS: Álvarez Cabo, JM (Centro de Salud de Perchera-Pumarín, Perchera, Gijón); Astigarraga Lizundia, JI (Centro de Salud de Irún Viejo, Irún, Guipúzcoa); Bañuelos Echarri, M (Centro de Salud de El Couto, El Couto, Ourense); Barral Castro, M (Centro de Salud Casa del Mar, A Coruña); Bastida Calvo, JC (Centro de Salud de Marín, Marín, Pontevedra); Benedito García, EA (Centro de Salud de Requena, Requena, Valencia); Blázquez Puerta, A (Centro de Salud Albarizas, Marbella, Málaga); Bravo Lara, EI (Centro de Atención Primaria de Vila-Seca, Vila-Seca, Tarragona); Brunet Costa, J (Centro de Atención Primaria Sant Llátzer, Terrassa, Barcelona); Cano Jiménez, A (Centro de Salud Doctor Mendiguchía Carriche, Leganés, Madrid); Caso Peláez, J (Centro de Salud de Alpedrete, Alpedrete, Madrid); Cucalón Arenal, JM (Centro de Salud de Fuentes de Ebro, Fuentes de Ebro, Zaragoza); Cumplido Pérez, A (Centro de Salud de Talavera La Real, Talavera La Real, Badajoz); De La Concepción Ruiz, M (Centro de Salud La Plata, Sevilla); Díez Cagigal, RA (Hospital Comarcal de Laredo, Laredo, Cantabria); Dragos Velicu, M (Centro de Salud de Onda, Onda, Castellón); Echemendía Cabadilla, Y (Centro de Salud de Viladecans, Viladecans, Barcelona); Escribano, D (Centro de Salud Oliver, Zaragoza); Fandiño Pena, MP (Centro de Salud La Doblada, Vigo, Pontevedra); Ferrer García-Borrás, JM (Centro de Salud Almendrales, Madrid); Ferreruela Muñoz, E (Centro de Salud de Mislata, Mislata, Valencia); Florido Ávila, JJ (Centro de Salud San Miguel, Torremolinos, Málaga); Gago Nolasco, B (Centro de Salud Cono Sur, Las Palmas de Gran Canaria); García Martínez, N (Centro de Salud Puerta Nueva, Zamora); Garrido Calvo, A (Centro de Salud de Aldeanueva de Ebro, Aldeanueva de Ebro, La Rioja); Gomis Ferraz, JF (Centro de Salud Juan Llorens, Valencia); González García, E (Hospital Universitario Río Hortega, Valladolid); González García-Mayor, ME (Centro de Salud Pintor Colmeiro, Vigo, Pontevedra); González Rodríguez, M (Centro de Salud Landako, Durango, Vizcaya); Herrero Roa, J (Centro de Salud Los Comuneros, Burgos); Izquierdo Gómez-Arevalillo, L (Centro de Salud de Navahermosa, Navahermosa, Toledo); López Luque, M (Centro Salud Sector Sur, Córdoba); López Ramiro, M (Hospital de Alta Resolución Chare de Loja, Loja, Granada); Malo Mayor, E (Centro de Salud Valleaguado, Coslada, Madrid); Márquez Araníbar, JA (Centro de Salud Tejina, San Cristóbal de La Laguna, Tenerife); Martín Arcilla, M (Centro de Salud Trápaga, Trapagarán, Bizkaia); Martínez Larios, B (Centro de Salud Ejido Norte, El Ejido, Almería); Martínez Reig, S (Centro de Salud Las Lomas, Alicante); Martínez Vivas, MJ (Centro de Salud Totana Norte, Totana, Murcia); Mejías Estévez, MJ (Centro de Salud Ronda Histórica, Sevilla); Miguel Llordes, E (Centro de Atención Primaria de Guissona, Guissona, Lleida); Molina Carrasco, MC (Centro de Salud de Las Torres de Cotillas, Las Torres de Cotillas, Murcia); Monescillo Rodríguez, MA (Centro de Salud de Malagón, Malagón, Ciudad Real); Monillor Córcoles, SE (Centro de Salud La Bassa, Alcoy, Alicante); Morte Pérez, A (Centro de Salud Teruel Ensanche, Teruel); Niño Azcárate, C (Centro de Salud Los Cristianos, Tenerife); Ordóñez Sánchez, X (Centro de Atención Primaria Apenins/Montigala, Badalona, Barcelona); Pastor López, A (Centro de Salud de Crevillente, Crevillente, Alicante); Pérez Laorden, A (Centro de Salud de Benavides de Órbigo, Benavides de Órbigo, León); Prieto Muñiz, V (Centro de Salud Sotrondio, San Martín del Rey Aurelio, Asturias); Prieto Romo, JI (Centro de Salud de Navalmoral de La Mata, Navalmoral de La Mata, Cáceres); Ríos Sierra, JA (Centro de Salud Aquitania, Madrid); Rodríguez Rodríguez, E (Centro de Salud Jerez Centro, Jerez de la Frontera, Cádiz); Roque Galván, P (Centro de Salud Guanarteme, Las Palmas de Gran Canaria); Sabater Melchor, JM (Centro de Salud de La Vilavella, La Vilavella, Castellón); Salido de Andrés, E (Centro de Salud de Alcalá del Río, Alcalá del Río, Sevilla); Segovia Martínez, A (Centro de Salud Arrayanes, Linares, Jaén); Sorrius Sitges, P (Centro de Salud de Campillo de Altobuey, Campillo de Altobuey, Cuenca); Tena Santana, G (Centro de Salud de Almonte, Almonte, Huelva); Trillo Castro, A (Centro de Salud de Vimianzo, Vimianzo, A Coruña); Verd Rodríguez, M (Hospital Son Espases, Palma de Mallorca); Vicente Torrecilla, JL (Centro de Salud de Montijo, Montijo, Badajoz).
Los autores agradecen a Almudena Pardo y a Anna Nualart de VMLY&Rx los servicios editoriales y de redacción médica.
Conflicto de intereses
Antonio Alcántara Montero y Julio Alberto Freire Pérez han recibido financiación como discentes en actividades de formación y han participado como docentes en actividades divulgativas sobre dolor promocionadas por Esteve Pharmaceuticals S.A. y Grünenthal Pharma S.A.
Eva Trillo Calvo ha recibido financiación como discente en actividades de formación y ha participado como docente en actividades divulgativas sobre dolor promocionadas por Esteve Pharmaceuticals S.A., Pfizer, Inc. y Laboratorios Menarini S.A.
Ana María Mur Pérez ha recibido financiación como discente en actividades de formación y ha participado como docente en actividades divulgativas promocionadas por Esteve Pharmaceuticals S.A., Pfizer y Grünenthal Pharma S.A.
Pedro Juan Ibor Vidal no reporta conflicto de intereses.
Juana Sánchez Jiménez ha recibido financiación en actividades de formación y ha participado como docente en actividades divulgativas sobre dolor promocionadas por Esteve Pharmaceuticals S.A., Grünenthal Pharma S.A. y Laboratorios Menarini S.A.
Consideraciones éticas
Este artículo se basa en la práctica clínica reportada por médicos de familia mediante un cuestionario online y no presenta datos de ningún estudio con participantes humanos o animales realizado por ninguno de los autores. El cuestionario enviado a los médicos de familia para reportar su práctica clínica habitual no necesitó someterse a ninguna aprobación ética, ya que no recopiló datos de pacientes.
Financiación
Esteve Pharmaceuticals S.A. ha proporcionado apoyo logístico, incluyendo los cargos por procesamiento del artículo a la revista y los servicios de redacción médica.
Bibliografía
- Breivik H, Collett B, Ventafridda V, Cohen R, Gallacher D. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain. 2006; 10(4): 287-333.
- Crofford LJ. Chronic pain: Where the body meets the brain. Trans Am Clin Climatol Assoc. 2015; 126: 167-83.
- Wijma AJ, van Wilgen CP, Meeus M, Nijs J. Clinical biopsychosocial physiotherapy assessment of patients with chronic pain: The first step in pain neuroscience education. Physiother Theory Pract. 2016; 32(5): 368-84.
- WHO’s cancer pain ladder for adults: World Health Organization (WHO); 2020 [updated 2020. Disponible en: https://www.who.int/cancer/palliative/painladder/en/.
- Noble M, Treadwell JR, Tregear SJ, Coates VH, Wiffen PJ, Akafomo C, et al. Long-term opioid management for chronic noncancer pain. Cochrane Database Syst Rev. 2010; 2010(1): CD006605.
- Sanchez-Jimenez J, Tejedor-Varillas A, Carrascal-Garrido R, García-García CR, Gómez-García S, González-Sánchez M, et al. La atención al paciente con dolor crónico no oncológico (DCNO) en Atención Primaria (AP). Documento de consenso.2016 [citado 27 Octubre 2020]. Disponible en: https://www.semfyc.es/wp-content/uploads/2016/06/DOCUMENTO-CONSENSO-DOLOR-17-04-A pdf
- Pain Proposal. Federación Europea de la Asociación Internacional del Estudio del Dolor (EFIC) y Federación Europea de Asociaciones Neurológicas (EFNA); 2016.
- Santolaya Sardinero F, García Fernandez CI. Valoración de las características de la ruta de atención del paciente con dolor crónico articular en España (estudio RADAR ). Med Gen Fam. 2019; 8(4): 151-60.
- Nieto Pol E. Patient evaluation and outcome measures. Aten Primaria. 2014; 46 Suppl 1: 32-8.
- Haanpää M, Attal N, Backonja M, Baron R, Bennett M, Bouhassira D, et al. NeuPSIG guidelines on neuropathic pain assessment. Pain. 2011; 152(1): 14-27.
- Akinci A, Al Shaker M, Chang MH, Cheung CW, Danilov A, José Dueñas H, et al. Predictive factors and clinical biomarkers for treatment in patients with chronic pain caused by osteoarthritis with a central sensitisation component. Int J Clin Pract. 2016; 70(1): 31-44.
- Canadian guideline for safe and effective use of opioids for chronic non-cancer pain. Cluster 2: Conducting an opioid trial. Recommendation 09. Michael G. DeGroote National Pain Centre. McMaster University.; 2017 [citado 27 Octubre 2020]; Disponible en: http://nationalpaincentre.mcmaster.ca/opioid/cgop_b02_r09.html
- Alcántara Montero A, Goicoechea García C. Designing safer opioids: atypical or «multigesic» opioids? Semergen. 2020; 46(5): 293-6.
- Ahlbeck K. Opioids: a two-faced Janus. Curr Med Res Opin. 2011; 27(2): 439-48.
- Alcántara Montero A, Balsalobre Góngora S, Narganes Pineda DM, Blanco Polanco B. Analgesia multimodal y sinergia farmacológica en el manejo del dolor. Semergen. 2020; 46(4): 284-85.
- Sanchez-del-Aguila MJ, Schenk M, Kern K-U, Drost T, Steigerwald I. Practical considerations for the use of tapentadol prolonged release for the management of severe chronic pain. Clin Ther. 2014; 37(1): 94-113.
- Raffa RB, Buschmann H, Christoph T, Eichenbaum G, Englberger W, Flores CM, et al. Mechanistic and functional differentiation of tapentadol and tramadol. Expert Opin Pharmacother. 2012; 13(10): 1437-49.
- Merker M, Dinges G, Koch TPK, Morin AM. Undesired side effects of tapentadol in comparison to oxycodone. Schmerz. 2012; 26: 16-26.
- Torralba A, Miquel A, Darba J. Situación actual del dolor crónico en España: iniciativa “Pain Proposal”. Rev Soc Esp Dolor. 2014; 21(1): 16-22.
- Brennan F, Lohman D, Gwyther L. Access to pain management as a human right. Am J Public Health 2019; 109(1): 61-5.
- Guía de consenso para el buen uso de analgésicos opioides. Gestión de riesgos y beneficios. Valencia: Sociedad Científica Española de Estudios sobre el Alcohol, el Alcoholismo y las otras Toxicomanías (Socidrogalcohol); 2017.
- Guía de atención a los pacientes con dolor crónico no oncológico utilizando analgésicos opioides 2018 [citado 3 Noviembre 2020]. Disponible en: https://semg.es/images/documentos/2018/guia_atencion_pacientes_dolor_no.oncoloagico pdf
- Fine PG, Portenoy RK. Establishing “Best Practices” for opioid rotation: Conclusions of an expert panel. J Pain Symptom Manage. 2009; 38(3): 418-25.
- González-Barboteo J, Trelis-Navarro J, Tuca-Rodríguez A, Gómez-Batiste X. Rotación de opioides: Una alternativa en el tratamiento del dolor refractario en pacientes con cancer. Med Clin (Barc). 2010; 135(13): 617-22.
- Torres Morera LM. Tapentadol retard en el dolor crónico intenso. Rev Soc Esp Dolor. 2011; 18(5): 283-90.
- Stollenwerk A, Sohns M, Heisig F, Elling C, von Zabern D. Review of post-marketing safety data on tapentadol, a centrally acting analgesic. Adv Ther. 2018; 35(1): 12-30.
- Informe de Evaluación Terapéutica. Tapentadol. Pamplona: Comité de Evaluación de Nuevos Medicamentos de Navarra; 2011. Disponible en: https://www.navarra.es/NR/rdonlyres/335D27BD-5DF4-481F-A8BA-8ED8B800C131/229578/FET_2012_6_I pdf
- DePriest AZ, Puet BL, Holt AC, Roberts A, Cone EJ. Metabolism and Disposition of Prescription Opioids: A Review. Forensic Sci Rev. 2015; 27(2): 115-45.
- Kneip C, Terlinden R, Beier H, Chen G. Investigations into the drug-drug interaction potential of tapentadol in human liver microsomes and fresh human hepatocytes. Drug Metab Lett. 2008; 2(1): 67-75.
- Smit JW OC, Rengelshausen J, Terlinden R, Ravenstijn PG, Wang SS, Upmalis D, et al. Effects of acetaminophen, naproxen, and acetylsalicylic acid on tapentadol pharmacokinetics: results of two randomized, open-label, crossover, drug-drug interaction studies. Pharmacotherapy. 2010; 30(1): 25-34.
- Guía de atención a los pacientes con dolor crónico no oncológico utilizando analgésicos opioides. Barcelona: Agencia de Calidad y Evaluaciones Sanitarias de Cataluña. Departamento de Salud. Generalidad de Cataluña; 2018.