Clínica Cotidiana
Información del artículo
Historia del artículo:
Recibido el 2 de julio de 2021
Aceptado el 30 de junio de 2022
On-line el 27 de julio de 2023
Palabras clave:
Vasculitis cutánea
Metotrexato
Artritis reumatoide
Síndrome de sjögren
*Autor para correspondencia
Correo electrónico:
mmdsantaolalla@gmail.com
(M. Martín de Santa-Olalla y Llanes).
Keywords:
Cutaneous vasculitis
Methotrexate
Rheumatoid arthritis
Sjögren’s syndrome
María Martín de Santa Olalla y Llanesa,*, Marta Utrera Busquetsb, Silvia Salinas Morenoc, María Antonia Padial Vílchezd, Rosa María Díaz Díaza
aSección de Dermatología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes (Madrid). bServicio de Dermatología. Hospital General la Mancha-Centro. Alcázar de San Juan (Ciudad Real). cSección de Anatomía Patológica. Hospital Universitario Infanta Sofía.
San Sebastián de los Reyes (Madrid). dSección de Alergología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes (Madrid).
Resumen
Los fármacos pueden producir vasculitis cutánea. Se sabe que el metotrexato (MTX) puede causar toxicidad cutánea; por otro lado, es prescrito con frecuencia para el tratamiento de las vasculitis.
Presentamos un caso de vasculitis cutánea paradójica inducida por MTX, utilizado para el tratamiento de la artritis reumatoide.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Methotrexate-induced cutaneous vasculitis
Abstract
Drugs can produce cutaneous vasculitis. Methotrexate (MTX) is known to cause skin toxicity; on the other hand, it is frequently prescribed for the treatment of vasculitis.
We present a case of paradoxical cutaneous vasculitis induced by MTX, used for the treatment of rheumatoid arthritis.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Mujer de 63 años de edad, diagnosticada de artritis reumatoide seropositiva, con síndrome de Sjögren asociado, por lo que recibe tratamiento con prednisona (5 mg al día) y metotrexato (MTX) (15 mg/semana).
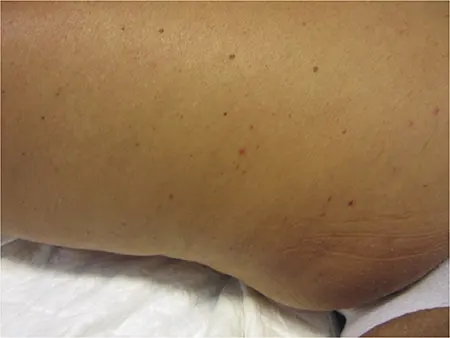
Consulta por presentar brotes de pápulas purpúricas asintomáticas (figura 1), que aparecen a las 48 horas de la toma de MTX y desaparecen al cabo de 48-72 horas.
Es remitida al Servicio de Alergología de nuestro centro para provocación oral con MTX. A las 24 h de la toma de 1,25 mg de MTX aparecen las mismas lesiones cutáneas referidas por la paciente (figura 1).
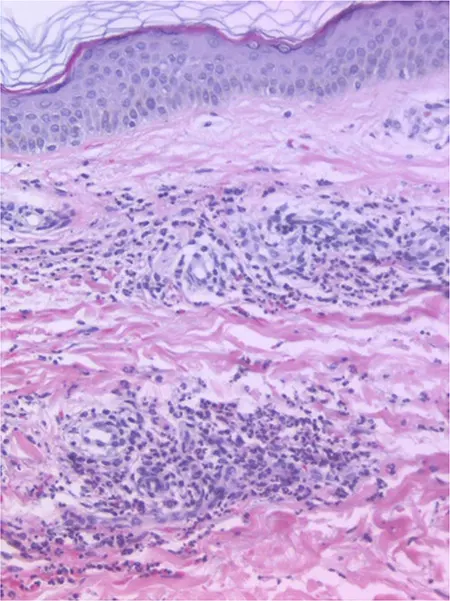
La biopsia de las mismas es compatible con vasculitis leucocitoclástica (figura 2).
Las pruebas complementarias solicitadas solo muestran velocidad de sedimentación globular, proteína C reactiva y factor reumatoide aumentados, y presencia de anticuerpos anitinucleares y anti-SSA positivos.
La radiografía de tórax es normal.
Tras la supresión del tratamiento con MTX, la paciente se encuentra libre de lesiones cutáneas.
Figura 1 – Púrpura palpable tras administración de metotrexato.
Figura 2 – Histología: datos de vasculitis leucocitoclástica (hematoxilina/eosin, ×400).
Comentario
Por una parte, es un hecho conocido que una de las causas de las vasculitis cutáneas son los medicamentos1. El MTX puede inducir distintos tipos de lesiones cutáneas, tales como fotosensibilidad, alopecia, urticaria, nodulosis, síndrome de Stevens Johnson o necrólisis epidérmica tóxica2.
Por otra parte, el MTX es uno de los tratamientos empleados para el control clínico de las vasculitis3. Sin embargo, se han publicado varios artículos en los que, de forma paradójica, el MTX era el único agente desencadenante de la vasculitis4-8, o bien formada parte del tratamiento recibido por el paciente9-10. El mecanismo patogénico por el que ocurre dicha manifestación es desconocido, aunque se postulan, como en el resto de las vasculitis, reacciones de hipersensibilidad tipos I-III.
La revisión bibliográfica muestra un total de 22 casos. La mayoría de los mismos estaban diagnosticados de una artritis reumatoide seropositiva, como en nuestra paciente. La duración del tratamiento con MTX antes de desarrollar la vasculitis fue variable (entre 1 semana y 6 meses). El desarrollo de la vasculitis fue independiente de la dosis de MTX recibida.
Las lesiones cutáneas aparecieron al cabo de 12-72 horas de la administración del fármaco. En la mayoría de los casos, la clínica fue exclusivamente cutánea, en forma de púrpura palpable, nódulos, eritema o úlceras necróticas localizadas en las extremidades inferiores.
Desgraciadamente, solo se realizó biopsia cutánea en ocho enfermos. Los hallazgos histológicos fueron compatibles con una vasculitis leucocitoclástica, como también vimos en nuestro caso.
Las lesiones cutáneas regresaron al suspender el fármaco, si bien, en algunos casos, fue necesario el tratamiento con corticoides sistémicos.
Como en nuestro caso, la reintroducción del fármaco como prueba de provocación dio lugar al desarrollo de las mismas lesiones por las que consultaba el paciente.
Conclusiones
Debemos tener en cuenta que el MTX puede ser un agente inductor de vasculitis cutáneas, que mejoraran rápidamente al suspender dicho fármaco.
Puntos clave
- No todas las úlceras cronificadas tienen un origen exclusivamente vascular: se debe pensar en enfermedades no tan frecuentes.
- El abordaje compartido médico de familia y enfermería es fundamental para replantearse nuevos diagnósticos diferenciales.
- Ha de atenderse al paciente de manera integral, sin olvidar la esfera emocional, que suele alterarse ante procesos tórpidos cutáneos.
- Una buena gestión de los plazos de derivación mejora la eficacia y reduce enormemente los costes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Pulido-Pérez A, Avilés-Izquierdo JA. Suárez Fernández R. Vasculitis cutáneas. Actas Dermosifiliogr. 2012; 103: 79-191.
- Puig L. Metotrexato: novedades terapéuticas. Actas Dermosifiliogr. 2014; 105: 583-9.
- Mukhtyar C, Guillevin L, Cid MC, Dasgupta B, de Groot K, Gross W, et al. EULAR recommendations for the management of primary small and medium vessel vasculitis. Ann Rheum Dis. 2009; 68: 310-7.
- Torner O, Ruber C, Olive A, Tena X. Methotrexate related cutaneous vasculitis. Clin Rheumatol. 1997; 16: 108-9.
- Simonart TH, Durez P, Margaux J, Van Geertruyden J, Goldschmidt D, Parent D. Cutaneous necrotizing vasculitis therapy for rheumatoid arthritis: a possible manifestation of methotrexate hypersensitivity. Clin Rheumatol. 1997; 16: 623-5.
- Segal R, Caspi D, Tishler M, Fishel B, Yaron M. Accelerated nodulosis and vasculitis during methotrexate therapy for rheumatoid arthritis. Arthritis Rheum. 1998; 31: 1182-5.
- Halevy S, Giryes H, Avinoach I, Livni E, Sukenik S. Leukocytoclastic vasculitis induced by low-dose methotrexate: in vitro evidence for an immunologic mechanism. J Eur Acad Dermatol Venereol. 1998; 10: 81-5.
- Moreno JC, Vélez A, Medina I, Valverde F, Fernández-Roldán JC, Ocaña MS, et al. Psoriasis, vasculitis and methotrexate. J Eur Acad Dermatol Venereol. 2003; 17: 466-8.
- Blanco R, Martínez-Taboada VM, González-Gay MA, Armona J, Fernández-Sueiro JL, González-Vela MC, et al. Acute febrile toxic reaction in patients with refractory rheumatoid arthritis who are receiving combined therapy with methotrexate and azathioprine. Arthritis Rheum. 1996; 39: 1016-20.
- Correia O, Ribas F, Azevedo R, Rodrigues H, Delgado L. Gangrene of the fingertips after bleomycin and methotrexate. Cutis. 2000; 66: 271-2.