Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 23 de marzo de 2022
Aceptado el 8 de diciembre de 2023
On-line el 26 de enero de 2023
Palabras clave:
Antiepiléticos
Dolor crónico
Dolor neuropático
Glutamato
Perampanel
Receptores AMPA
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero).
Keywords:
Antiepileptics
Chronic pain
Neuropathic pain
Glutamate
Perampanel
AMPA receptors
Antonio Alcántara Monteroa,*, Sandra Raquel Pacheco de Vasconcelosb, Carlos Goicoechea Garcíac, Patricia Minerva Hernández Alvaradod
aCentro de Salud Trujillo. Consultorios de Herguijuela-Conquista de la Sierra (Cáceres). bComplejo Hospitalario Universitario de Cáceres. Hospital San Pedro de Alcántara. Cáceres. cDepartamento de Ciencias Básicas de la Salud. Universidad Rey Juan Carlos. Madrid. dCentro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres (Cáceres).
Resumen
El dolor neuropático (DN) es un problema clínico importante e incapacitante. Su abordaje constituye un reto para los profesionales sanitarios. En algunas ocasiones se emplean fármacos fuera de indicación. La experiencia disponible hasta la fecha respalda que el bloqueo de los receptores AMPA (ácido alfa-amino-3-hidroxi-5-metil-4-isoxazolpropiónico) altera la sensibilidad al dolor en estudios con animales y se considera una posible diana terapéutica para controlar el dolor. Perampanel (PER) es un antagonista selectivo y no competitivo de los receptores AMPA indicado en la epilepsia.
Tras una búsqueda bibliográfica, en esta revisión exhaustiva y descriptiva se resume la bibliografía específica de PER en DN y dolor crónico.
PER ha demostrado en modelos preclínicos sus beneficios en el tratamiento del DN, así como acción antiinflamatoria. Sin embargo, se necesitan ensayos clínicos y mayor número de series de casos publicados en modelos de DN para dilucidar los beneficios de PER en estos pacientes.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Potential benefits of perampanel in the treatment of neuropathic pain
Abstract
Neuropathic pain (NP) is an important and disabling clinical problem, its management is a challenge for health professionals, sometimes using off-label drugs. The evidence available to date supports that blockade of AMPA (alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid) receptors alters sensitivity to pain in animal studies and is considered a potential therapeutic target to control the pain. Perampanel (PER) is a selective and non-competitive antagonist of AMPA receptors indicated in epilepsy.
After a bibliographic search, in this exhaustive and descriptive review the specific bibliography of PER in NP and chronic pain is summarized.
PER has shown in preclinical models its benefits in the treatment of NP, as well as its anti-inflammatory action. However, clinical trials and more series of published case reports on NP models are needed to elucidate the benefits of PER in these patients.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
El dolor neuropático (DN) se define como el que aparece como consecuencia directa de una lesión o enfermedad del sistema somatosensorial1. Su prevalencia en la población varía (6,9-10 %), según la herramienta utilizada para su diagnóstico2,3. Estos pacientes sufren frecuentemente depresión, tienen una pobre calidad de vida y una importante discapacidad y vulnerabilidad4.
Hace más de diez años que salieron al mercado los últimos fármacos con indicación en las guías internacionales de DN. Estas recomiendan iniciar con monoterapia y coinciden en señalar que los antidepresivos tricíclicos (en particular la amitriptilina), los inhibidores de la recaptación de serotonina y noradrenalina (IRSN) (especialmente la duloxetina) y los antiepilépticos (FAE) (la gabapentina y la pregabalina) constituyen fármacos de primera línea en el tratamiento del DN5,6.
Sin embargo, un considerable número de pacientes no alcanza un suficiente alivio del dolor o mejora de su calidad de vida con los fármacos disponibles7. El tratamiento del DN es efectivo en menos del 50 % de los pacientes; además está asociado a importantes efectos adversos (EA) de los fármacos5,6.
A pesar de que hay datos de que más del 45 % de los individuos que sufren DN toman dos o más fármacos para el dolor, en una revisión solo fue posible encontrar 21 estudios de alta calidad de diversas combinaciones de fármacos sistémicos y tópicos diferentes8.
Una publicación de 2012 trató de unificar la definición de dolor neuropático refractario (DNR) para los estudios epidemiológicos. El DNR es aquel en el que habrían fallado al menos cuatro fármacos con una duración de cada tratamiento de al menos tres meses, o hasta que los EA han impedido aumentar las dosis, y en los que se ha conseguido disminuir la intensidad del dolor menos del 30 %, o persiste en 5 o más en una escala de 0-10 puntos, o persiste una mala calidad de vida9.
En 2019 el Grupo de Especial Interés en DN de la Sociedad Italiana de Neurología elaboró un consenso sobre la definición de DN fármaco-resistente: “cuando el paciente no alcanza el 50 % de reducción del dolor o una mejoría de al menos 2 puntos en la escala Patient Global Impression of Change, tras haber usado todas las clases de fármacos indicados en primera, segunda y tercera línea en las guías internacionales más recientes y reconocidas, por lo menos un mes después de la titulación a la más alta dosis tolerable”10. Este consenso resulta útil para identificar a los pacientes susceptibles de tratamientos invasivos.
El DNR y fármaco-resistente obliga a ser creativos y audaces para intentar aliviar a estos pacientes. Hasta ahora no existe experiencia que permita un consenso que oriente en la utilización de tratamientos en DN fuera de indicación o con experiencia insuficiente. Desde esta perspectiva, el Grupo de Trabajo (GT) de DN de la Sociedad Española del Dolor (SED) diseñó una encuesta para conocer el abordaje del DN mediante fármacos, técnicas intervencionistas y tratamientos fuera de indicación en nuestro medio11.
En esta encuesta el 70 % de los encuestados trataban hasta a un 30 % de sus pacientes con DN con fármacos fuera de indicación. El 23,3 % utilizaba fármacos fuera de indicación en 40-60 % de los pacientes con DN y un 6,6 % utilizaba tratamientos fuera de indicación en 70-90 % de los pacientes. Ninguno de los respondedores los utilizaba en el 100 % de los pacientes. Dentro de los FAE, el más frecuentemente usado fuera de indicación fue la oxcarbazepina (OXC) (19 % lo usaba frecuentemente), seguido de la lacosamida (17 % lo usaba frecuentemente) y el acetato de eslicarbazepina (11 %). Otros anticonvulsivantes utilizados fuera de indicación fueron la zonisamida (ZNS) y el perampanel (PER). La mayoría de los encuestados refirieron que el uso de FAE fuera de indicación se basa en información de publicaciones (57,27 %), seguida de información de cursos y congresos en los casos de los utilizados con frecuencia (20 %) y de extrapolación de mecanismo de acción (25,25 %) en el caso de los que los utilizan ocasionalmente11.
En este contexto, existen publicaciones sobre los potenciales beneficios de algunos de estos FAE en DN12,13. Esta revisión exhaustiva y descriptiva tiene como objetivo resumir la bibliografía específica disponible de PER en DN y dolor crónico.
PER fue aprobado por la Agencia Europea del Medicamento (European Medicines Agency) en agosto de 2012 y en España comenzó a comercializarse en enero de 2014.
Desarrollo
Mecanismo de acción de perampanel
Entre los mecanismos implicados en la ictiogénesis y epileptogénesis, la neurotransmisión excitatoria cerebral mediada por receptores del glutamato es una de las más relevantes; a pesar de ello, hasta ahora no existían FAE que actuaran inhibiendo esta vía de una forma bien establecida. La transmisión glutamatérgica está controlada principalmente por 3 tipos de receptores ionotrópicos: los de N-metil-D-aspartato (NMDA), los de kainato y los del ácido alfa-amino-3-hidroxi-5-metil-4-isoxazolpropiónico (AMPA). Los receptores AMPA se encuentran principalmente en la membrana postsináptica de las sinapsis excitadoras del cerebro de los mamíferos14.
PER es el primer FAE que actúa mediante un antagonismo no competitivo altamente selectivo del receptor del AMPA (figura 1)15. Hay datos de que las asociaciones antiepilépticas más idóneas son las que combinan FAE con diferentes o múltiples mecanismos de acción, por lo que el singular mecanismo de acción de PER lo convierte en un FAE con posibilidad de sinergismo de eficacia con cualquier otro14,15.
PER está indicado para el tratamiento concomitante de las crisis de inicio parcial con o sin crisis generalizadas secundarias en pacientes con 4 años de edad y mayores; y de las crisis tonicoclónicas generalizadas primarias en pacientes con 7 años de edad y mayores con epilepsia idiopática generalizada16.
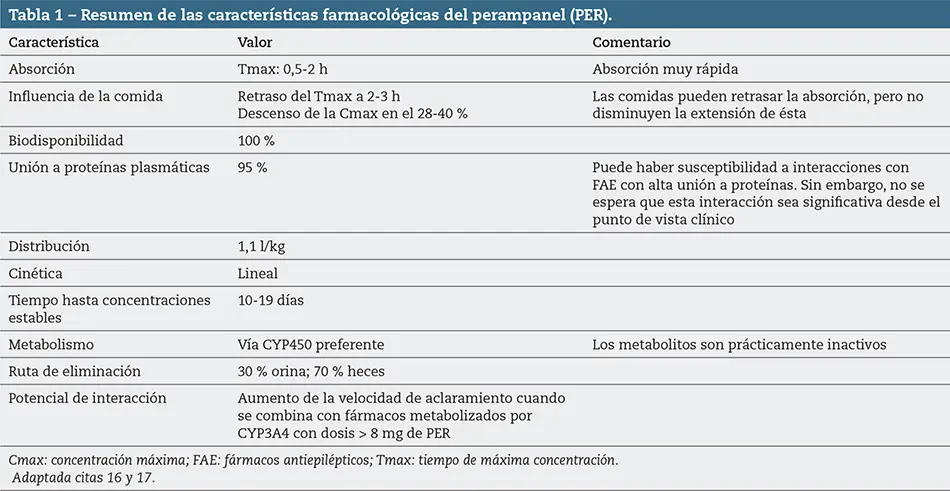
En adultos el tratamiento con PER se debe iniciar con una dosis de 2 mg/día. Se puede aumentar la dosis en incrementos de 2 mg (semanalmente o cada 2 semanas de acuerdo con las consideraciones relativas a la semivida descritas más abajo) hasta una dosis de mantenimiento de 4-8 mg/día, conforme a la respuesta clínica y la tolerabilidad. En función de la respuesta clínica y de la tolerabilidad de cada paciente a la dosis de 8 mg/día, se puede aumentar la dosis en incrementos de 2 mg/día hasta 12 mg/día. No es necesario ajustar la dosis en personas de edad avanzada (mayores de 65 años). Tampoco es necesario ajustar la dosis en los pacientes con insuficiencia renal leve. No se recomienda el uso en pacientes con insuficiencia renal moderada o grave o en pacientes que reciben hemodiálisis. El aumento de la dosis en pacientes con insuficiencia hepática leve (Child-Pugh A) a moderada (Child-Pugh B) se debe basar en la respuesta clínica y en la tolerabilidad. En los pacientes con insuficiencia hepática de leve a moderada se puede iniciar el tratamiento con una dosis de 2 mg. Se deberá aumentar la dosis de los pacientes en incrementos de 2 mg a intervalos de 2 semanas como mínimo en función de la tolerabilidad y la eficacia. La dosis máxima de PER en pacientes con insuficiencia hepática de leve a moderada es de 8 mg. No se recomienda el uso en pacientes con insuficiencia hepática grave16,17. En la tabla 1 se resumen las principales características farmacológicas de PER.
Figura 1 – Mecanismo de acción del perampanel sobre la transmisión glutamatérgica espinal (Imagen cortesía de Carlos Goicoechea García).
Perampanel en dolor neuropático y dolor crónico
Los trastornos del dolor, como el DN y el dolor inflamatorio persistente, son terapéuticamente difíciles de abordar. En estudios anteriores se ha demostrado la participación del receptor de glutamato en la modulación del dolor y, concretamente, en algunos se ha demostrado el papel protagónico del receptor AMPA18. PER actúa como inhibidor selectivo y no competitivo del receptor AMPA. Teniendo en cuenta estas premisas, realizamos una búsqueda bibliográfica hasta enero de 2022 en las bases de datos PubMed, Google académico, Web of Science, Scopus y Cochrane Central. Los términos de búsqueda utilizados fueron «perampanel and neuropathic pain» y «perampanel and pain». Se incluyeron estudios preclínicos y clínicos que evaluasen el efecto de PER en adultos con dolor crónico o DN, publicados en lengua inglesa, sin límite de fecha. Se identificaron 4 estudios preclínicos, un ensayo clínico realizado en pacientes con distonía cervical (DC) y un caso clínico en una paciente con síndrome de dolor regional complejo (SDRC) tipo 1.
Khangura et al. investigaron el efecto atenuador del dolor del PER en el DN inducido por una lesión por constricción crónica (LCC). La LCC se provocó atando cuatro ligaduras sueltas alrededor del nervio ciático. El dolor se evaluó constatando la hiperalgesia mecánica, la alodinia al frío y la hiperalgesia al calor en los días 7 y 14 después de la intervención quirúrgica. El día 14 del postoperatorio se administró PER (3 y 6 mg/kg por vía oral) 30 minutos antes de la prueba de evaluación del dolor. Las LCC dieron lugar a una aparición significativa de dolor y los síntomas máximos se observaron el día 14. PER atenuó significativamente la hiperalgesia mecánica, la alodinia al frío y la hiperalgesia al calor inducidas por LCC, en distintos intervalos de tiempo (30, 60, 90 y 120 minutos) y se observó un efecto más sustancial con la dosis de 6 mg/kg. A las ratas sometidas a LCC se les administró naloxona antes del tratamiento con PER para explorar el posible papel de los opioides en los efectos antinociceptivos del PER. La naloxona redujo significativamente los efectos atenuantes del dolor del PER, lo cual indica que el sistema opioide tiene un papel decisivo en el efecto antinociceptivo del PER. Los autores concluyen que PER tiene potencial de atenuación del dolor en el DN inducido por LCC, lo que quizás se deba a que está parcialmente mediado por el sistema opioide19.
Hara et al. investigaron si el PER intratecal atenuaba el DN y el dolor inflamatorio. Se indujo una LCC en el nervio ciático en ratas macho Sprague-Dawley. Se evaluaron los efectos del PER intratecal (10, 30 o 100 µg) sobre la hiperalgesia mecánica y al frío mediante la prueba electrónica de von Frey y la prueba de la placa fría, respectivamente. Se evaluó a las ratas normales en términos de nocicepción inflamatoria mediante la prueba de la formalina, y la función motora mediante la prueba del rotarod. En las ratas con LCC, el PER aplicado en la médula espinal inhibió la hiperalgesia mecánica y al frío de forma dependiente de la dosis. En las ratas normales, el PER suprimió notablemente las respuestas de fase temprana y de fase tardía en la prueba de la formalina, y afectó levemente al rendimiento motor durante un periodo breve con la dosis más elevada. Esos resultados indican que el PER ejerce acciones antinociceptivas sobre el DN e inflamatorio persistente en la médula espinal20.
De Caro el al. estudiaron los posibles efectos analgésicos y antiinflamatorios del PER en modelos de dolor agudo y crónico. Se administró PER por vía oral, bien de forma aguda (5 mg/kg) o bien de forma repetida (3 mg/kg/día, durante 4 días), y se evaluó la respuesta al dolor empleando modelos de sensibilidad nociceptiva, dolor visceral e inflamatorio, y alodinia e hiperalgesia mecánica inducidas por una LCC en el nervio ciático. PER redujo de forma significativa la percepción del dolor en todas las pruebas de comportamiento, así como la alodinia e hiperalgesia mecánica inducidas por LCC en un régimen agudo (5 mg/kg). Ese efecto se observó también tras el tratamiento reiterado con la dosis de 3 mg/kg/día. Los efectos antinociceptivos, antialodínicos y antihiperalgésicos del PER se atenuaban cuando se administraba el antagonista selectivo del receptor cannabinoide de tipo 1 (CB1) AM251 (1 mg/kg/ip) antes del tratamiento con PER. Además, los análisis ex vivo demostraron que el PER aumentaba significativamente la expresión del CB1 y reducía las citocinas inflamatorias (es decir, TNFalfa, IL-1beta e IL-6) en la médula espinal. Según los autores de este trabajo, estos resultados expanden los conocimientos sobre los efectos antinociceptivos y antialodínicos del PER y respaldan la participación del sistema canabinérgico en su mecanismo de acción21.
Tringalli et al. pusieron a prueba la hipótesis de que el PER puede modular la liberación del péptido relacionado con el gen de la calcitonina (CGRP, un neurotransmisor peptídico de gran importancia en la fisiopatología de la migraña) en un modelo animal in vitro que conllevaba la incubación estática de explantes troncoencefálicos de rata y la posterior medición del CGRP inmunorreactivo liberado en el medio de incubación. Se incubaron explantes troncoencefálicos agudos de rata en un medio simple o en un medio que contenía concentraciones graduadas de PER. La liberación al medio se evaluó mediante radioinmunoanálisis en condiciones de referencia o tras la estimulación por secretagogos como concentraciones elevadas de potasio, veratridina o capsaicina. Se encontraron los siguientes hallazgos:
- Bajo condiciones de referencia, PER, administrado en el rango de 0,01-100 µM, inhibía de forma dependiente de la concentración la liberación del CGRP en comparación con los controles; la reducción era estadísticamente significativa a partir de 10 µM.
- Tras 1 hora de incubación, todos los estímulos despolarizadores indujeron un aumento significativo y uniforme en la secreción del CGRP.
- Bajo estas condiciones, la liberación del CGRP estimulada por 56 mM de KCl se vio significativamente reducida por PER a partir de 0,1 µM, mientras que la secreción estimulada por la veratridina se vio significativamente reducida a partir de 1 µM.
- Por el contrario, el PER no tenía efecto alguno sobre la liberación del CGRP inducida por capsaicina hasta 100 µM.
Estos hallazgos preliminares in vitro indican que el PER puede controlar la transmisión del dolor bajo condiciones de activación del sistema trigeminal, en un modelo preclínico que imita la fisiopatología de la migraña humana22.
En humanos solo encontramos dos trabajos clínicos:
- En primer lugar, Fox et al. realizaron un estudio multicéntrico, abierto, de fase 2ª, para evaluar la tolerabilidad y la seguridad de PER en pacientes con DC primaria. Se incluyeron 25 pacientes que recibieron 2 mg/día de PER, con incrementos de 2 mg semanales durante 6 semanas, hasta un máximo de 12 mg/día; la fase de mantenimiento fue de 4 semanas y finalizó en la semana 10. Los criterios de valoración primarios incluyeron la tolerabilidad, definida como la capacidad de permanecer con PER durante el periodo de mantenimiento, en cualquier nivel de dosis; y la seguridad, determinada a partir de los EA recopilados en cada visita. Los criterios de valoración exploratorios secundarios incluyeron la Escala de Calificación de Tortícolis Espasmódica Occidental de Toronto (TWSTRS), la calidad de vida (perfil de impacto de la distonía cervical [CIDP]-58) y la escala de impresión clínica global (CGI). En cuanto a los resultados, ocho sujetos abandonaron el estudio: 4 por EA, 3 por otros motivos y uno se perdió durante el seguimiento. Un sujeto toleró 12 mg/día, ocho sujetos (30,8 %) toleraron 2 mg, mientras que el 19,2 % toleraron 4 mg/día y el 15,4 % toleraron 6 mg u 8 mg/día. Todos los sujetos experimentaron EA; los más comunes fueron mareos, desequilibrio e irritabilidad. Los puntos finales exploratorios de TWSTRS mostraron algunas puntuaciones de dolor mejoradas y en el CIDP-58 se mejoró el sueño. Los autores concluyen que la tolerabilidad a PER fue variable en sujetos con DC, y se tomarán en consideración dosis más bajas para futuros estudios en esta población23.
- Chang et al. publicaron el caso clínico de una mujer de 61 años con SDRC tipo I en la parte inferior de la pierna y el pie derecho, de 7 años de evolución, tras sufrir una fractura del pie derecho, con reducción abierta y cirugía de fijación interna. La paciente había recibido previamente sin éxito tratamiento con la combinación de pregabalina (300 mg/día), tramadol/paracetamol (225 mg/1950 mg al día) y nortriptilina (10 mg/día). Además, la prednisolona en dosis altas (60 mg/día) también resultó ineficaz. Posteriormente, se administró PER (4 mg, 2 mg dos veces). La respuesta al tratamiento fue muy favorable, de forma que el día siguiente al tratamiento con PER, el dolor desapareció por completo. Además, en el día 7 y al cabo de un mes de seguimiento, no se informó de dolor en la parte inferior de la pierna y el pie derechos. Por otro lado, no se reportaron EA tras la administración de PER24.
Discusión
Los receptores AMPA median en una transmisión excitadora rápida y desempeñan un papel fundamental para la plasticidad sináptica en la médula espinal (figura 2)25,26. La activación de los receptores AMPA desencadena una afluencia intracelular de cationes que causa la despolarización de la membrana, lo cual a su vez provoca la activación de los receptores NMDA y una mayor afluencia de calcio en el espacio intracelular. Los niveles elevados de calcio intracelular activan las vías de transducción de señales responsables de la hiperexcitabilidad de las neuronas postsinápticas, por lo que es posible que la activación de los receptores AMPA sea fundamental en el inicio de los cambios fisiopatológicos que provocan la aparición del dolor27.
Se ha descrito que la regulación al alza de los receptores AMPA en las neuronas del asta posterior causa una sensibilización central durante un periodo prolongado. Además, el dolor inflamatorio periférico induce la regulación al alza de los receptores AMPA permeables al calcio tanto en las sinapsis como en las membranas extrasinápticas de las interneuronas del asta posterior28.
Por otro lado, se ha informado de que el bloqueo de los receptores AMPA altera la sensibilidad al dolor en estudios con animales y se considera que es una posible diana terapéutica para controlar el dolor29-32. Hasta la fecha, se han desarrollado varios antagonistas de los receptores AMPA y sus efectos positivos para reducir el dolor se han informado en varios estudios en animales29-32. Sin embargo, hasta donde sabemos, solo 4 estudios anteriores evaluaron los efectos reductores del dolor de los antagonistas de los receptores AMPA en humanos33-36.
En 1998, Sang et al.34 realizaron un estudio preliminar para evaluar el efecto del antagonista del receptor AMPA, LY293558. Inyectaron capsaicina por vía intradérmica para provocar hiperalgesia en 15 voluntarios sanos, compararon el efecto de la infusión intravenosa de LY293558 con el del placebo y siguieron el efecto durante 1 hora. Encontraron una intensidad del dolor y un malestar significativamente reducidos después de la infusión de LY293558. Sin embargo, la mayoría de los voluntarios reportaron EA de visión borrosa o sedación.
En 2004, Sang et al.35 evaluaron el efecto de LY293558 sobre las migrañas. La tasa de respuesta fue del 69 % tras la administración intravenosa de LY293558. Fue más alta que la del tratamiento con placebo (25 %), pero más baja que la del tratamiento con sumatriptán (86 %). En este estudio, 2 de 13 pacientes informaron EA, incluidos síntomas visuales y sedación.
En 2009, Gormsen et al.33 trataron a 13 pacientes con DN crónico debido a una lesión nerviosa periférica usando el antagonista del receptor de AMPA intravenoso, NS1209, el cual no demostró un efecto mayor estadísticamente significativo sobre el placebo en medidas del dolor espontáneo. Sin embargo, NS1209 fue superior al placebo en el alivio del dolor evocado, incluida la alodinia mecánica y por frío. De los 13 pacientes, 8 presentaron EA, como cefalea, mareos, somnolencia, sensación anormal, fatiga, boca seca y náuseas.
En 2012, Wallace et al.36 reclutaron a 18 sujetos y realizaron un estudio cruzado. Inyectaron capsaicina vía intradérmica en la región volar del antebrazo para provocar hiperalgesia. Los sujetos incluidos recibieron 150 mg o 90 mg del antagonista del receptor AMPA, NGX426, o placebo por vía oral. Los autores encontraron que el dolor se redujo significativamente después de la aplicación de NGX426, y 150 mg de NGX426 fueron más efectivos que 90 mg de NGX426. La administración de 150 mg de NGX426 produjo somnolencia en 3 sujetos, mareos en 1 sujeto y aturdimiento en 1 sujeto.
Todos estos estudios previos se realizaron con fármacos que no se lanzaron como productos en el mercado. Aunque estos fármacos demostraron buenos efectos en la reducción del dolor, se observaron varios EA en muchos sujetos.
PER es un antagonista selectivo y no competitivo de los receptores AMPA que se utiliza como fármaco antiepiléptico en la práctica clínica16. Para evaluar los efectos de reducción del dolor del PER y sus mecanismos relacionados se realizaron varios estudios en animales19-22 y se obtuvieron buenos resultados. Sin embargo, no hemos encontrado estudios en humanos con PER en modelos de DN o dolor crónico, a excepción del estudio de fase 2a en pacientes DC23 y el caso clínico presentado en SDRC tipo 124.
Esta revisión presenta varias limitaciones. En primer lugar, se trata de una revisión descriptiva, no exhaustiva, con baja calidad metodológica y, por tanto, expuesta a un elevado riesgo de sesgo a favor de PER. En segundo lugar, el núcleo de la revisión descansa sobre modelos preclínicos realizados en animales. Lo deseable serían ensayos clínicos realizados en modelos de DN (como son la neuropatía diabética, neuropatía inducida por quimioterapia, neuralgia postherpética o radiculopatía crónica). Esto, unido a lo anterior, no hace más que agrandar el riesgo de sesgo. No obstante, los estudios preclínicos estaban bien diseñados (en cuanto a modelos de lesión y respuestas observadas en animales de experimentación) y demostraron beneficios sobre la utilidad de PER en diferentes modelos experimentales de DN.
Figura 2 – Estructura de los receptores AMPA (adaptada de cita 26).
Conclusiones
La evidencia disponible hasta la fecha respalda que el bloqueo de los receptores AMPA altera la sensibilidad al dolor en estudios con animales y se considera una posible diana terapéutica para controlar el dolor. PER, antagonista selectivo y no competitivo de los receptores AMPA, ha demostrado en modelos preclínicos sus beneficios en el tratamiento del DN, así como acción antiinflamatoria. Por ello, debería estudiarse más exhaustivamente el mecanismo de PER para comprender también la relación entre los receptores AMPA y el sistema canabinérgico y se podría tomar en consideración su posible uso en el tratamiento del DN. Sin embargo, se necesitan ensayos clínicos y mayor número de series de casos publicados en modelos de DN para dilucidar los beneficios de PER en estos pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW, et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology. 2008; 70(18): 1630-5.
- Torrance N, Smith BH, Bennett MI, Lee AJ. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain. 2006; 7(4): 281-9.
- van Hecke O, Austin SK, Khan RA, Smith BH, Torrance N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 2014; 155(4): 654-62.
- Cherif F, Zouari HG, Cherif W, Hadded M, Cheour M, Damak R. Depression prevalence in neuropathic pain and its impact on the quality of life. Pain Res Manag. 2020; 2020: 7408508.
- Finnerup NB, Haroutounian S, Kamerman P, Baron R, Bennett DLH, Bouhassira D, et al. Neuropathic pain: an updated grading system for research and clinical practice. Pain. 2016; 157(8): 1599-606.
- Alcántara Montero A, Ibor Vidal PJ, Alonso Verdugo A, Trillo Calvo E. Actualización en el tratamiento farmacológico del dolor neuropático. Semergen. 2019; 45(8): 535-45.
- Binder A, Baron R. The pharmacological therapy of chronic neuropathic pain. Dtsch Arztebl Int. 2016; 113(37): 616-25.
- Chaparro LE, Wiffen PJ, Moore RA, Gilron I. Combination pharmacotherapy for the treatment of neuropathic pain in adults. Cochrane Database Syst Rev. 2012; 7: CD008943.
- Smith BH, Torrance N, Ferguson JA, Bennett MI, Serpell MG, Dunn KM. Towards a definition of refractory neuropathic pain for epidemiological research. An international Delphi survey of experts. BMC Neurol. 2012; 12: 29.
- Ciaramitaro P, Cruccu G, de Tommaso M, Devigili G, Fornasari D, Geppetti P, et al. A Delphi consensus statement of the Neuropathic Pain Special Interest Group of the Italian Neurological Society on pharmacoresistant neuropathic pain. Neurol Sci. 2019; 40(7): 1425-31.
- Serrano Afonso AA, Navarro Siguero A, Paramés Mosquera E, Ochoa Mazarro D, Gálvez Mateos R, Pérez Hernández C. Hábitos de prescripción para el abordaje del dolor neuropático en España: resultados de la encuesta del grupo de trabajo de dolor neuropático de la Sociedad Española del Dolor. Rev Soc Esp Dolor. 2021; 28(3): 137-47.
- Alcántara Montero A, Sánchez Carnerero CI. Lacosamida y dolor neuropático, una revisión. Rev Neurol. 2016; 62: 223-9.
- Alcántara Montero A, Sánchez Carnerero CI. Acetato de eslicarbazepina en dolor neuropático, cefaleas y neuralgias craneales: Evidencia y experiencia. Neurologia. 2019; 34(6): 386-95.
- Caicoya AG. Búsqueda de innovación: antagonistas selectivos del receptor AMPA. Neurología. 2016; 31(Suppl 1): 9-13.
- Sánchez Álvarez JC. ¿Qué aporta perampanel al tratamiento de la epilepsia? Neurología. 2016; 31(SupPl 1): 21-7
- Perampanel MedP EU-FT [Internet] [consultado 8 enero 2022]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/12776003/FT_12776003.html
- Serrano Castro PJ, Aguilar Castillo MJ. Perfil farmacológico de perampanel. Neurología. 2016; 31(Suppl 1): 14-20.
- Khan A, Khan S, Kim YS. Insight into pain modulation: Nociceptors sensitization and therapeutic targets. Curr Drug Targets. 2019; 20(7): 775-88.
- Khangura RK, Bali A, Kaur G, Singh N, Jaggi AS. Neuropathic pain attenuating effects of perampanel in an experimental model of chronic constriction injury in rats. Biomed Pharmacother. 2017; 94: 557-63.
- Hara K, Haranishi Y, Terada T. Intrathecally administered perampanel alleviates neuropathic and inflammatory pain in rats. Eur J Pharmacol. 2020; 872: 172949.
- De Caro C, Cristiano C, Avagliano C, Cuozzo M, La Rana G, Aviello G, et al. Analgesic and anti-inflammatory effects of perampanel in acute and chronic pain models in mice: Interaction with the cannabinergic system. Front Pharmacol. 2021; 11: 620221.
- Tringali G, Currò D, Navarra P. Perampanel inhibits calcitonin gene-related peptide release from rat brainstem in vitro. J Headache Pain. 2018; 19(1): 107.
- Fox SH, Swan M, Jinnah HA, de Freitas MET, de Oliveira LM, Al-Shorafat D, et al. An open-label phase 2a study to evaluate the safety and tolerability of perampanel in cervical dystonia. Mov Disord Clin Pract. 2021; 8(5): 743-9.
- Chang MC, Park D. Effectiveness of perampanel in managing chronic pain caused by the complex regional pain syndrome: A case report. Medicine (Baltimore). 2021; 100(48): e27791.
- Rogawski MA. Revisiting AMPA receptors as an antiepileptic drug target. Epilepsy Curr. 2011; 11(2): 56-63.
- Rogawski MA. AMPA receptors as a molecular target in epilepsy therapy. Acta Neurol Scand Suppl. 2013; 197: 9-18.
- Douyard J, Shen L, Huganir RL, Rubio ME. Differential neuronal and glial expression of GluR1 AMPA receptor subunit and the scaffolding proteins SAP97 and 4.1N during rat cerebellar development. J Comp Neurol. 2007; 502(1): 141-56.
- Gwak YS, Kang J, Leem JW, Hulsebosch CE. Spinal AMPA receptor inhibition attenuates mechanical allodynia and neuronal hyperexcitability following spinal cord injury in rats. J Neurosci Res. 2007; 85(11): 2352-9.
- Blackburn-Munro G, Bomholt SF, Erichsen HK. Behavioural effects of the novel AMPA/GluR5 selective receptor antagonist NS1209 after systemic administration in animal models of experimental pain. Neuropharmacology. 2004; 47(3): 351-62.
- Kong LL, Yu LC. Involvement of mu- and delta-opioid receptors in the antinociceptive effects induced by AMPA receptor antagonist in the spinal cord of rats. Neurosci Lett. 2006; 402(1-2): 180-3.
- Lee HJ, Pogatzki-Zahn EM, Brennan TJ. The effect of the AMPA/kainate receptor antagonist LY293558 in a rat model of postoperative pain. J Pain. 2006; 7(10): 768-77.
- Nishiyama T, Gyermek L, Lee C, Kawasaki-Yatsugi S, Yamaguchi T. The spinal antinociceptive effects of a novel competitive AMPA receptor antagonist, YM872, on thermal or formalin-induced pain in rats. Anesth Analg. 1999; 89(1): 143-7.
- Gormsen L, Finnerup NB, Almqvist PM, Jensen TS. The efficacy of the AMPA receptor antagonist NS1209 and lidocaine in nerve injury pain: a randomized, double-blind, placebo-controlled, three-way crossover study. Anesth Analg. 2009; 108(4): 1311-9.
- Sang CN, Hostetter MP, Gracely RH, Chappell AS, Schoepp DD, Lee G, et al. AMPA/kainate antagonist LY293558 reduces capsaicin-evoked hyperalgesia but not pain in normal skin in humans. Anesthesiology. 1998; 89(5): 1060-7.
- Sang CN, Ramadan NM, Wallihan RG, Chappell AS, Freitag FG, Smith TR, et al. LY293558, a novel AMPA/GluR5 antagonist, is efficacious and well-tolerated in acute migraine. Cephalalgia. 2004; 24(7): 596-602.
- Wallace MS, Lam V, Schettler J. NGX426, an oral AMPA-kainate antagonist, is effective in human capsaicin-induced pain and hiperalgesia. Pain Med. 2012; 13(12): 1601-10.