Carta al Editor
Información del artículo
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero).
Antonio Alcántara Monteroa,*, Sandra Raquel Pacheco de Vasconcelosb, Patricia Minerva Hernández Alvaradoc
aCentro de Salud Trujillo. Consultorios de Herguijuela-Conquista de la Sierra (Cáceres). bComplejo Hospitalario Universitario de Cáceres. Hospital San Pedro de Alcántara. Cáceres. cCentro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres (Cáceres).
Desde que en 1968 McNeal describiese la división de la glándula prostática en 3 zonas (figura 1), se han realizado diversos estudios y no ha sido posible identificar claras diferencias histológicas y funcionales entre ellas. A pesar de ello, la división de la próstata según este patrón está ampliamente difundida por su utilidad clínica.
Según McNeal1, la próstata se divide en una zona central, que rodea los conductos eyaculadores, una zona transicional, que rodea la uretra, y una zona periférica. La importancia clínica de esta división radica en que se ha observado que aproximadamente el 70-75 % de los carcinomas prostáticos asientan en la zona periférica, mientras que la hiperplasia benigna de próstata (HBP) ocurre principalmente debido a la hipertrofia de las glándulas de la zona transicional. Así mismo, la zona central parece ser resistente a la aparición de estas patologías2.
Por tanto, la HBP es un fenómeno histopatológico caracterizado por una hiperplasia nodular no difusa del tejido glandular epitelial-estromal y muscular prostático que afecta a las zonas de transición y periuretral. A menudo, la hiperplasia tiene múltiples nódulos, que se unen para formar adenomas1.
Con frecuencia, el adenoma produce un crecimiento de la glándula que puede favorecer un grado variable de obstrucción benigna de la salida vesical y la aparición de síntomas del tracto urinario inferior (STUI)3,4. Se ha constatado que la HBP histológica produce obstrucción por compresión uretral o distorsión de la salida de la vejiga4. La obstrucción vesical no es la causa de la HBP: es una consecuencia del adenoma3.
En la clínica, la HBP hace referencia al crecimiento benigno de la próstata, asociado a una obstrucción a la salida de la orina que se manifiesta clínicamente con STUI de tipo mixto (25-50 % de los casos de HBP histológica)3. La obstrucción se correlaciona mejor con el riesgo de complicaciones que con la expresión de STUI3. Por otra parte, las manifestaciones clínicas dependen en mayor medida de la localización del adenoma que de su tamaño. El adenoma del cuello vesical, situado en la zona periuretral que forma el lóbulo medio, distorsiona la salida de la vejiga y causa una obstrucción grave, incluso si es de pequeño tamaño. Los adenomas localizados en la zona de transición periuretral, que forma los lóbulos laterales, necesitan alcanzar un aumento de tamaño notablemente mayor antes de causar compresión de la uretra prostática y obstrucción4.
Existen diferentes factores etiológicos asociados al crecimiento y la evolución de la HBP histológica. Los factores más relacionados son la edad, los hormonales, los metabólicos, los genéticos, la inflamación y los estilos de vida5.
La edad per se es el principal factor de riesgo. La prevalencia de HBP aumenta con la edad: está presente en el 8-10 % de varones de 31 a 40 años, en el 40-50 % de los de 50 a 60 años y en más del 80 % a partir de los 80 años5.
El tamaño de la glándula es hormonodependiente5. La testosterona se convierte en dihidrotestosterona por las 5α-reductasa del tejido estromal, induce la síntesis de los factores de crecimiento y favorece la proliferación celular5.
Las enfermedades cardiovasculares y el síndrome metabólico aumentan el volumen prostático e incrementan la prevalencia de HBP5. Además, la arteriosclerosis pélvica, que aumenta con la edad, ocasiona isquemia pelviana que favorece la fibrosis e hiperplasia de las estructuras pélvicas5.
El desarrollo de la HBP histológica favorece el aumento de volumen y el riesgo de obstrucción. La progresión de la HBP está asociada a la edad más avanzada, a un aumento del volumen prostático (> 30-40 ml), a un valor del PSA de al menos 1,5 ng/ml, a una puntuación internacional de los síntomas prostáticos (IPSS) más alta (moderada a grave), a un flujo máximo (Qmax) más bajo (< 10 ml/s) y a un aumento del volumen residual postmiccional6,7. Estos parámetros deben tenerse en cuenta a la hora de decidir el abordaje terapéutico más adecuado y para realizar el seguimiento clínico.
No obstante, esta progresión no se produce en todos los pacientes; cuando se produce no lo hace a la misma velocidad en todos ellos8-11. Clínicamente, la progresión se caracteriza principalmente por un empeoramiento de los STUI (IPSS ≥ 4 puntos), especialmente de los síntomas de llenado (urgencia, nicturia), y también por debilidad del flujo urinario12. El empeoramiento de los síntomas supone el 79,5 % de los signos de progresión general (14-20 % en 4,5 años)8,13.
Las complicaciones son los episodios de progresión menos frecuentes. Se estima aproximadamente en un 2-3 % la incidencia acumulada de retención aguda de orina (RAO) a los 4,5 años (14,8 % de los episodios de progresión general) y en 5-6 % la necesidad de tratamiento invasivo relacionada con la HPB8,11,13-15. La historia natural de los STUI/HBP se describe en la figura 2.
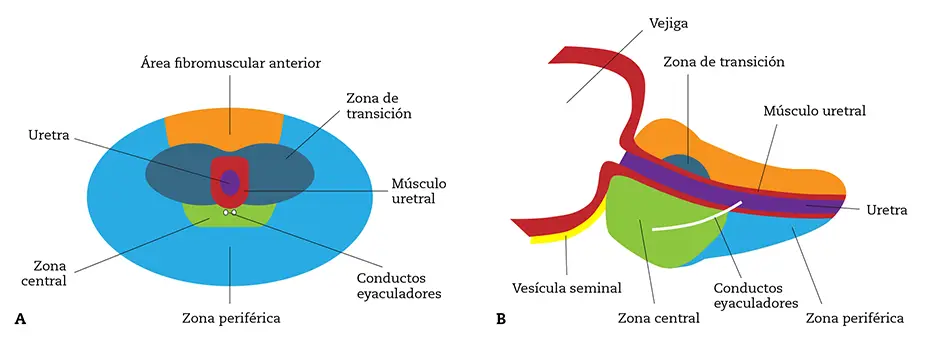
Figura 1 – Secciones transversal (A) y sagital (B) de la próstata, que muestran las diferentes zonas descritas por McNeal (adaptada de las citas 1 y 2).

Figura 1 – Historia natural de los STUI/HBP. Implicaciones en el abordaje terapéutico (adaptada de las citas 6, 14 y 15).
Bibliografía
- Gaeta JF, Asirwatham JE, Miller G, Murphy GP. Histologic grading of primary prostatic cancer: a new approach to an old problema. J Urol. 1980; 123: 689-93.
- Böcking A, Kiehn J, Heinzel-Wach M. Combined histologic grading of prostatic carcinoma. Cancer. 1982; 50: 288-94.
- Foo KT. What is a disease? What is the disease clinical benign prostatic hyperplasia (BPH)? World J Urol. 2019; 37: 1293-6.
- Foo KT. Pathophysiology of clinical benign prostatic hyperplasia. Asian J Urol. 2017; 4: 152-7.
- Lee CL, Kuo HC. Pathophysiology of benign prostate enlargement and lower urinary tract symptoms: Current concepts. Ci Ji Yi Xue Za Zhi. 2017; 29: 79-83.
- Esteban M, Alcántara A, Bernal MR, Blasco P, Flores H, Gutiérrez MI, et al. Criterios de derivación y manejo integral del paciente con STUI. Hiperplasia benigna de próstata en varón (HBP). Madrid: Sanidad y Ediciones; 2018. Disponible en: https://statics-correofarmaceutico.uecdn.es/cms/sites/11/2018/12/criterios_paciente_STUI. pdf
- Brenes FJ, Brotons F, Cozar JM, Fernández-Pro A, Martín JA, Martínez-Berganza ML, et al. Criterios de derivación en HBP para AP, 5.G. 4ª ed. Madrid: J.F. Maguire; 2019.
- Fitzpatrick JM. The natural history of benign prostatic hyperplasia. BJU Int. 2006; 97 Suppl 2: 3-22.
- Anderson JB, Roehrborn CG, Schalken JA, Emberton M. The progression of benign prostatic hyperplasia: examining the evidence and determining the risk. Eur Urol. 2001; 39: 390-9.
- Arrighi HM, Metter EJ, Guess HA, Fozzard JL. Natural history of benign prostatic hyperplasia and risk of prostatectomy. The Baltimore Longitudinal Study of Aging. Urology. 1991; 38(1 Suppl): 4-8.
- Roehrborn CG. BPH progression: concept and key learning from MTOPS, ALTESS, COMBAT, and ALF-ONE. BJU Int. 2008; 101 Suppl 3: 17-21.
- Fukuta F, Masumori N, Mori M, Tsukamoto T. Natural history of lower urinary tract symptoms in Japanese men from a 15-year longitudinal community-based study. BJU Int. 2012; 110: 1023-9.
- Bosch JL, Bangma CH, Groeneveld FP, Bohnen AM. The long-term relationship between a real change in prostate volume and a significant change in lower urinary tract symptom severity in population-based men: the Krimpen study. Eur Urol. 2008; 53: 819-27.
- McConnell JD, Roehrborn CG, Bautista OM, Andriole GL Jr, Dixon CM, Kusek JW, et al. The long term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med. 2003; 349: 2387-98.
- Roehrborn CG, Siami P, Barkin J, Damião R, Major-Walker K, Nandy I, et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study. Eur Urol. 2010; 57: 123-31.


