Carta al Editor
Información del artículo
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero)
Antonio Alcántara Monteroa,*, Sandra Raquel Pacheco de Vasconcelosb, Patricia Minerva Hernández Alvaradoc, Mario Tovar Matsuki Martín de Pradoc
aCentro de Salud Trujillo. Consultorios de Herguijuela-Conquista de la Sierra (Cáceres). bComplejo Hospitalario Universitario de Cáceres.Hospital San Pedro de Alcántara. Cáceres. cCentro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres (Cáceres)
La historia natural de los síntomas del tracto urinario inferior (STUI) relacionados con la hiperplasia benigna de próstata (HBP) se caracteriza por un deterioro progresivo en muchos pacientes1. Los datos obtenidos a partir de estudios longitudinales y de los brazos placebo de los ensayos clínicos muestran que, si no son tratados, muchos de los pacientes con obstrucción prostática benigna (OPB)/STUI desarrollan deterioro progresivo de los síntomas, así como de la tasa de flujo urinario. Más del 30 % de los varones experimentará progresión clínica en el curso de 5 años, caracterizada principalmente por empeoramiento de los síntomas2. El riesgo de retención urinaria y de necesidad de intervención quirúrgica aumenta con el tiempo3.
Actualmente se sabe que los mejores candidatos a experimentar empeoramiento de la enfermedad son los pacientes de mayor edad, con niveles elevados de antígeno prostático específico (PSA), alta puntuación en el índice de síntomas AUA (AUA-SI) y en el cuestionario Benign Prostatic Hyperplasia Impact Index (BII), menor tasa de flujo urinario (Qmáx) y elevado residuo post-miccional (RPM). A estos pacientes se les debe prestar mayor atención en la práctica clínica2,3.
Con el fin de prevenir esta progresión clínica conviene retroceder un paso atrás y prevenir la progresión fisiopatológica. En este sentido, ¿qué sabemos acerca de la progresión fisiopatológica de la HBP?
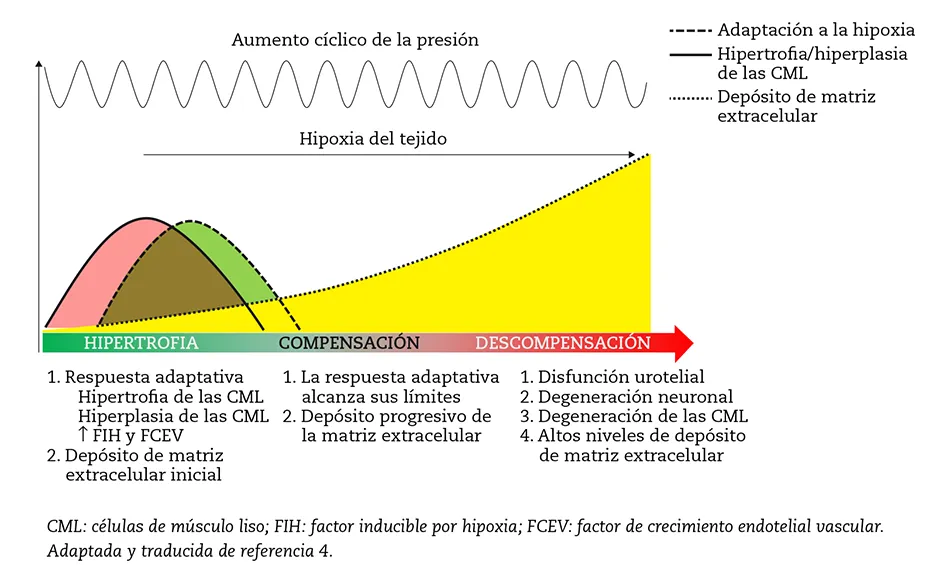
En el tracto urinario inferior normal la HBP induce el remodelado de la pared vesical que lleva a la hipertrofia del músculo detrusor y a obstrucción del flujo urinario. Cada vez que ocurre el vaciado de la vejiga durante la fase de micción aumenta la presión en el interior de la vejiga. Cuando se inicia la OPB, la presión intravesical durante la fase de vaciado aumenta y el proceso se vuelve crónico. Como consecuencia de ello se produce una respuesta adaptativa del detrusor, acompañada de hipertrofia y aumento de la densidad vascular y del flujo sanguíneo en función del aumento de la masa vesical. Durante esta fase el paciente sigue asintomático y el vaciado de la vejiga ocurre de manera eficiente. Después de esta fase compensatoria, la respuesta adaptativa alcanza sus límites máximos y la falta de oxígeno empieza a afectar al tracto urinario inferior. Con el tiempo ocurre acumulación de colágeno y la condición clínica evoluciona hasta alcanzar características fibróticas: vejiga menos contráctil y menos funcional. Finalmente se llega a la fase de descompensación y al daño irreversible de la vejiga (figura 1)4,5.
Se desconoce claramente cuál es el punto de no retorno a partir del cual se produce la irreversibilidad de los daños. Sin embargo, resulta obvio que mientras más tiempo se espere entre el inicio de la obstrucción y la desobstrucción, la posibilidad de recuperación mediante cualquier tratamiento será menor.
El fallo del detrusor está asociado a ciertas características ultraestructurales específicas: variación en el tamaño y la forma de las células musculares, colagenosis (fibrosis) y fascículos alterados. Si se observan estos hallazgos en un mismo paciente es posible predecir con una elevada exactitud que tendrá problemas de vaciado tras ser sometido a una resección transuretral de la próstata (RTUP)6.
La OPB no tratada trae también consecuencias funcionales que consisten principalmente en una disminución progresiva de la contractilidad de la vejiga. Como se sabe, en los pacientes con OPB ocurre progresivamente una reducción en el Qmáx y un aumento en el RPM, acompañado de una reducción en la función del detrusor7.
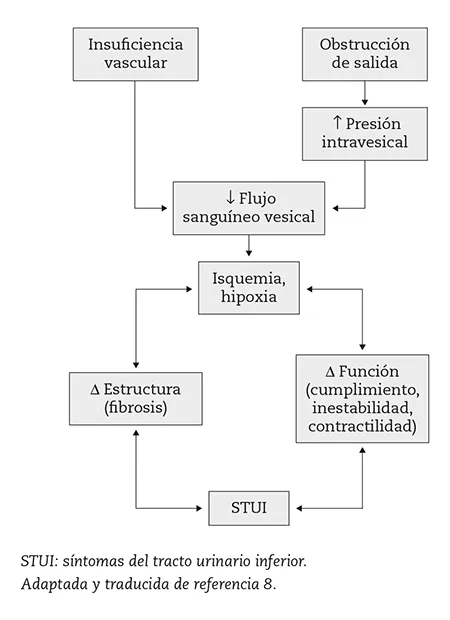
El envejecimiento y la insuficiencia vascular contribuyen de forma importante al remodelado de la pared vesical. Los procesos de envejecimiento incluyen al tracto urinario inferior; por tanto, si ocurre obstrucción causante del daño, la aterosclerosis pélvica debida al envejecimiento contribuirá con el envejecimiento de la vejiga (figura 2)8.
Figura 1 – Remodelación de la vejiga inducida por su obstrucción.
Figura 2 – Interrelación entre el flujo sanguíneo de la vejiga, isquemia y cambios en la función del detrusor.
Llegados a este punto nos podemos preguntar si el tratamiento médico o farmacológico puede retrasar el deterioro de la vejiga en varones con OPB. Es importante recordar que los factores clave para el deterioro de la vejiga son dos: aumento de la presión e hipoxia del tejido4; por ello se puede replantear dicha cuestión de otro modo: ¿puede el tratamiento médico mejorar la presión intravesical y la hipoxia del tejido en varones con OPB?
Como se sabe existen tres subtipos de receptores alfa-1 adrenérgicos: alfa-1A, presentes predominantemente en las células de músculo liso del tracto urinario inferior; alfa-1D, expresados principalmente en la vejiga, la médula espinal y los conductos nasales; y receptores alfa-1B, presentes en los vasos sanguíneos. Estudios con alfa-1-bloqueantes e inhibidores de la 5-alfa-reductasa (5-ARI) indican que estos agentes pueden mejorar la obstrucción, lo cual desde el punto de vista urodinámico quiere decir que reducen la presión intravesical durante el vaciado9. Además, los alfa-1-bloqueantes tienen la capacidad de mejorar el aporte sanguíneo en el tracto urinario inferior10,11.
Si estos tratamientos pueden mejorar la presión intravesical y la hipoxia en el tejido en varones con OPB, ¿pueden mejorar también el grosor de la pared vesical? A este respecto existen datos que indican que el tratamiento durante 6 meses con alfuzosina reduce el grosor de la pared vesical. Por tanto, existe la posibilidad de que, al menos en etapas tempranas, se reviertan los efectos negativos de la obstrucción de la vejiga al reducir el grosor de la pared vesical12. Resultados similares se han obtenido en estudios con tamsulosina13.
Estos datos indican, por tanto, que los tratamientos disponibles actualmente para la HBP poseen el potencial de retrasar la remodelación progresiva de la pared vesical. Pero, ¿cómo emplear estos fármacos en la práctica clínica?
En primer lugar, es necesario que el paciente se encuentre en el momento final de la fase adaptativa, en el que comienzan los síntomas. La consulta médica del paciente refiriendo que presenta STUI debe dar lugar a que se inicie el tratamiento, ya que éste permitirá mejorar su calidad de vida y retrasar la progresión clínica de la enfermedad. Dicho de otro modo, no se debe esperar a que haya obstrucción para comenzar con el tratamiento farmacológico.
Por otro lado, las guías actuales de la Asociación Europea de Urología (EAU) para el abordaje de los STUI no neurogénicos recomiendan que14:
- Se ofrezcan alfa-1-bloqueantes a varones con STUI de moderados a graves.
- Se utilicen 5-ARI en varones con STUI de moderados a graves y mayor riesgo de progresión de la enfermedad (por ejemplo, volumen de próstata >40 ml).
- Se ofrezca tratamiento combinado con un alfa-1-bloqueante y un 5-ARI a varones con STUI de moderados a graves y mayor riesgo de progresión de la enfermedad (por ejemplo, volumen de próstata >40 ml).
Sin embargo, si seguimos esta estrategia se abre un “periodo de ventana terapéutica” para el uso de alfa-1-bloqueantes y 5-ARI muy tardío para antagonizar la fisiopatología de la HBP. Por tanto, posiblemente este no sea el mejor periodo de ventana terapéutica. Se ha visto que la respuesta al tratamiento farmacológico es significativamente menor en pacientes con engrosamiento de la pared vesical por encima de 5 mm, por lo que un retraso en su inicio puede comprometer su eficacia15.
Además, existen estudios que demuestran la utilidad del uso cada vez mayor de la terapia farmacológica como tratamiento de primera línea para la HBP, lo cual ha dado lugar a una disminución importante en las RTUP16. Así, las intervenciones quirúrgicas en estos pacientes se han convertido en el último recurso. Según la última guía de la EAU para el abordaje de los STUI no neurogénicos, son indicaciones absolutas de intervención quirúrgica: la retención urinaria recurrente o refractaria, la incontinencia por rebosamiento, las infecciones recurrentes del tracto urinario, la litiasis vesical o los divertículos, la hematuria macroscópica resistente al tratamiento y la dilatación del tracto urinario superior por OPB; es una indicación relativa para los pacientes que no han obtenido un alivio adecuado de los STUI o RPM utilizando tratamientos conservadores o médicos14.
En conclusión, la OPB es una condición progresiva que lleva a una insuficiencia irreversible de la vejiga. El tratamiento farmacológico disponible para OPB/STUI tiene el potencial de prevenir o retrasar la insuficiencia vesical. En particular, los alfa-1-bloqueantes tienen la capacidad de disminuir la presión intravesical mediante la disminución de la obstrucción y mejorar el flujo sanguíneo en el tracto urinario inferior de los varones con OPB. El actual abordaje de la OPB y de los STUI debe enfocarse principalmente en los síntomas. Las indicaciones y los tiempos para el tratamiento farmacológico y quirúrgico deben ser revisadas para impactar más profundamente en la fisiopatología de la OPB y de los STUI, y así garantizar mejores resultados a largo plazo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Emberton M, Andriole GL, de la Rosette J, Djavan B, Hoefner K, Vela Navarrete R, et al. Benign prostatic hyperplasia: a progressive disease of aging men. Urology. 2003; 61: 267-73.
- Alcántara Montero A. Comentario editorial a: «Documento de consenso Pautas de actuación y seguimiento del varón con Síntomas del Tracto Urinario Inferior secundarios a Hiperplasia Prostática Benigna». Actas Urol Esp. 2017; 41: 562-3.
- Fitzpatrick JM. The natural history of benign prostatic hyperplasia. BJU Int. 2006; 97 Suppl 2: 3-6.
- Fusco F, Creta M, De Nunzio C, Iacovelli V, Mangiapia F, Li Marzi V, et al. Progressive bladder remodeling due to bladder outlet obstruction: a systematic review of morphological and molecular evidences in humans. BMC Urol. 2018; 18: 15.
- Alcántara Montero A, Müller-Arteaga C. Modelo propuesto en la remodelación de la vejiga inducida por la obstrucción a la salida de la vejiga en humanos: implicaciones en la práctica clínica. Arch Esp Urol. 2019; 72: 983-4.
- Blatt AH, Brammah S, Tse V, Chan L. Transurethral prostate resection in patients with hypocontractile detrusor–what is the predictive value of ultrastructural detrusor changes? J Urol. 2012; 188: 2294-9.
- Thomas AW, Cannon A, Bartlett E, Ellis-Jones J, Abrams P. The natural history of lower urinary tract dysfunction in men: minimum 10-year urodynamic follow-up of untreated detrusor underactivity. BJU Int. 2005; 96: 1295-300.
- Siroky MB. The aging bladder. Rev Urol. 2004; 6 Suppl 1: S3-7.
- Fusco F, Creta M, De Nunzio C, Gacci M, Li Marzi V, Finazzi Agrò E. Alpha-1 adrenergic antagonists, 5-alpha reductase inhibitors, phosphodiesterase type 5 inhibitors, and phytotherapic compounds in men with lower urinary tract symptoms suggestive of benign prostatic obstruction: A systematic review and meta-analysis of urodynamic studies. Neurourol Urodyn. 2018; 37: 1865-74.
- Pinggera GM, Mitterberger M, Pallwein L, Schuster A, Herwig R, Frauscher F, et al. Alpha-Blockers improve chronic ischaemia of the lower urinary tract in patients with lower urinary tract symptoms. BJU Int. 2008; 101:319-24.
- Goi Y, Tomiyama Y, Yokoyama A, Tatemichi S, Maruyama K, Kobayashi M, et al. Effect of silodosin, a selective α(1A)-adrenoceptor antagonist, on voiding behavior and bladder blood flow in a rat model of bladder outlet obstruction. Eur J Pharmacol. 2015; 764: 489-96.
- Karakose A, Aydogdu O, Atesci YZ. The relationship between bladder wall thickness and lower urinary tract symptoms: Does bladder wall thickness change after alpha-blocker therapy with alfuzosin? Can Urol Assoc J. 2014; 8: E26-9.
- Egilmez T, Pourbagher MA, Guvel S, Kilinc F, Turunc T, Ozkardes H. Effects of selective alpha-1-adrenergic receptor blockers on bladder weight. Urol Int. 2006; 76: 42-50.
- Gravas S, Cornu JN, Gacci M, Gratzke C, Herrmann TRW, Mamoulakis C, et al. EAU Guidelines on Management of non-neurogenic male lower urinary tract symptoms (LUTS), incl. benign prostatic obstruction (BPO). European Association of Urology (EAU); 2021 [consultado 25 Octubre 2021]. Disponible en: http://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/
- Salah Azab S, Elsheikh MG. The impact of the bladder wall thickness on the outcome of the medical treatment using alpha-blocker of BPH patients with LUTS. Aging Male. 2015; 18: 89-92.
- Izard J, Nickel JC. Impact of medical therapy on transurethral resection of the prostate: two decades of change. BJU Int. 2011; 108: 89-93.