Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 2 de diciembre de 2020
Aceptado el 19 de octubre de 2021
On-line el 16 de noviembre de 2021
Palabras clave:
Farmacoterapia
Hiperactividad del detrusor
Incontinencia urinaria
Medicina personalizada
Vejiga hiperactiva
*Autor para correspondencia
Correo electrónico:
a.alcantara.montero@hotmail.com
(A. Alcántara Montero).
Keywords:
Pharmacotherapy
Detrusor overactivity
Urinary incontinence
Personalized medicine
Overactive bladder
Antonio Alcántara Monteroa,*, Sandra Raquel Pacheco de Vasconcelosb, Fernando Peñato Tarifaa, Mario Tovar Matsuki Martín de Pradob
aCentro de Salud Manuel Encinas. Consultorio de Malpartida de Cáceres, Cáceres. bComplejo Hospitalario Universitario de Cáceres. Cáceres.
Resumen
La experiencia en los últimos años ha demostrado que el síndrome metabólico, los trastornos afectivos, la deficiencia de hormonas sexuales, la microbiota urinaria, los trastornos funcionales gastrointestinales y una disfunción subclínica del sistema nervioso autónomo pueden estar asociados a la vejiga hiperactiva (VH); y que esta puede tener su propia fisiopatología específica en todos estos marcos. Este enfoque de diferentes fenotipos de VH se puede traducir en una mejor toma de decisiones de tratamiento y resultados, a pesar de que los datos son demasiado escasos actualmente, y proporcionar una razón sólida para el empleo de terapias de combinación para aumentar la posibilidad de éxito terapéutico.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Update in physiopathology of hyperactive bladder: on the road towards a change of diagnostic and therapeutic paradigm (II)
Abstract
The evidence over the past few years has shown that metabolic syndrome, affective disorders, sex hormone deficiency, urinary microbiota, gastrointestinal functional disorders, and subclinical autonomic nervous system dysfunction may all be associated with OAB, and that it could have its own specific pathophysiology within all these frameworks. This approach to different OAB phenotypes could translate into better treatment decisions and outcomes, despite the fact that data is currently too scarce, and provide a solid reason for the use of combination therapies to increase the chance of success therapeutic.
© 2021 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Fisiopatología de la vejiga hiperactiva
Fenotipado según cofactores fisiopatológicos
Síndrome metabólico
En muchos estudios se ha demostrado un vínculo entre el síndrome metabólico y la vejiga hiperactiva (VH), especialmente con la obesidad1. Si bien inicialmente se pensó que esta asociación se debía a la hiperplasia benigna prostática o a la inflamación crónica de la próstata1, cada vez hay más experiencia acerca de que la VH se produce por igual en hombres y mujeres con síndrome metabólico1.
La VH puede tener su propia fisiopatología en pacientes con síndrome metabólico, a partir del aumento de la carga mecánica que estimula los aferentes sensoriales del trígono y el cuello de la vejiga, del estrés oxidativo, de la inflamación sistémica y de la resistencia a la insulina, que promueven la isquemia pélvica crónica y la disfunción urotelial1.
Estudios recientes han demostrado que la mayoría de las opciones de tratamiento establecidas actualmente para la VH (antimuscarínicos, neuromodulación sacra –SNM– y toxina botulínica) son menos efectivas en pacientes con síndrome metabólico o menos efectivas que en otras poblaciones de pacientes2,3. Por el contrario, se ha encontrado que el mirabegrón, un agonista de los receptores β3-adrenérgicos, diseñado inicialmente como un medicamento contra la obesidad4, es igualmente efectivo en pacientes obesos y no obesos con VH y resulta muy adecuado para esta población de pacientes5, aunque puede ser necesario un ajuste de la dosis6. En el primer ensayo controlado aleatorizado que evaluó el papel de los inhibidores de la fosfodiesterasa en pacientes de sexo femenino, se informó de que el tadalafilo a dosis bajas diarias es un tratamiento eficaz y bien tolerado para la VH7. Teniendo en cuenta el papel fisiopatológico de las vías del estrés inflamatorio y oxidativo en pacientes con síndrome metabólico y VH, los inhibidores de la fosfodiesterasa pueden convertirse en una opción terapéutica notable en dichos pacientes, como lo ha confirmado un número creciente de estudios en modelos animales y ensayos clínicos preliminares8. Sin embargo, según la literatura disponible, los tratamientos dirigidos a la obesidad, como los programas de pérdida de peso y la cirugía bariátrica, pueden considerarse como las opciones terapéuticas más eficaces al actuar sobre los múltiples mecanismos enumerados anteriormente, con tasas de curación de incontinencia urinaria de urgencia (IUU) tan altas como 19 % y 79 %, respectivamente9-11.
Trastornos afectivos
Si bien el impacto de la VH puede predisponer a los individuos afectados a la ansiedad y las depresiones, existen datos que sugieren que el estrés emocional y un historial de ansiedad o depresión pueden ser factores de riesgo para el desarrollo de la VH en las mujeres12. Esto no es sorprendente en vista del procesamiento central de los impulsos aferentes en la región límbica del cerebro.
Los datos recientes proporcionaron una evaluación detallada de la relación temporal entre estos síntomas y demostraron la influencia del estrés emocional y los trastornos afectivos en la historia natural de la VH12. Por tanto, puede haber una asociación bidireccional entre los trastornos afectivos y la VH, con mecanismos biológicos subyacentes comunes que dan lugar a la coexistencia de ambos trastornos. Se ha investigado el factor liberador de corticotropina (CRF por las siglas en inglés de corticotrophin-releasing factor) como un posible contribuyente fisiopatológico común a la VH y la ansiedad o depresión13. La disminución concomitante en los niveles séricos de CRF y la mejoría de la VH inducida por la depresión observada mediante el uso de un antagonista del receptor de CRF tipo 1 en un estudio reciente en un modelo animal confirma este posible mecanismo, al tiempo que destaca una posible vía terapéutica para la VH inducida por estrés social14.
Se ha postulado la depleción de serotonina como otro candidato fisiopatológico común para la ansiedad, la depresión y la VH, ya que su papel en los trastornos afectivos está bien establecido y varios estudios experimentales han demostrado que la reducción de los niveles de serotonina en el SNC estuvo acompañada por el incremento de la frecuencia urinaria y la hiperactividad del detrusor (HD)15. En un ensayo controlado aleatorizado se ha demostrado que la duloxetina mejora significativamente la frecuencia y la urgencia en pacientes con VH y puede ser un candidato valioso para el tratamiento de la VH inducida por el estrés, como se ha observado en estudios con animales16.
Las disfunciones de los canales receptores de potencial transitorio (TRP, por las siglas en inglés de transient receptor potential) también pueden desempeñar un papel clave en la coexistencia de trastornos afectivos y VH17. Recientemente se ha sugerido la sensibilización central como el último cofactor fisiopatológico común de la ansiedad, la depresión y la VH18. Entendemos como sensibilización central un aumento de la actividad sináptica en las neuronas somatosensoriales del asta posterior de la médula espinal como consecuencia de un estímulo nocivo periférico mantenido que provoca una respuesta progresiva y amplificada que, en ocasiones, no presenta correlación con la intensidad del estímulo. Muchos de los mecanismos fisiopatológicos mencionados anteriormente pueden ser comunes a la VH inducida por estrés social y los fenotipos de VH asociados a trastornos funcionales gastrointestinales o comunicación cruzada entre órganos pélvicos19. La duloxetina, los antagonistas de los TRP vaniloides (TRPV) o los antagonistas de CRF pueden dirigirse a las bases biológicas compartidas entre la ansiedad, la depresión y la VH y, por tanto, pueden convertirse en opciones de tratamiento para la VH inducida por el estrés emocional. La SNM es el tratamiento más ampliamente estudiado y evaluado adecuadamente en nuestro arsenal terapéutico actual en esta población20.
Deficiencia de hormonas sexuales
El impacto de la deficiencia de hormonas sexuales en el tracto urinario inferior en pacientes de sexo femenino se ha relacionado claramente con los receptores de estrógenos y progesterona demostrados en la uretra, vejiga y músculos del suelo pélvico21. Los estudios epidemiológicos han apoyado el papel de la deficiencia de hormonas sexuales en la etiopatogénesis de los síntomas del tracto urinario inferior (STUI), y hasta el 70 % de las mujeres relacionan el inicio de la incontinencia urinaria con el final del periodo menstrual (menopausia)21. Varios mecanismos pueden explicar el papel de la deprivación de estrógenos en el inicio de la urgencia urinaria, como el aumento de la contractilidad del detrusor a través de la activación de la vía de señalización de la Rho-quinasa, el aumento de la liberación de acetilcolina, los cambios en la señalización aferente urotelial o el aumento de la expresión de la conexina 4321,22. La VH en estos pacientes se asocia comúnmente a infecciones urinarias y síntomas vulvovaginales, como sequedad vaginal, picazón y dispareunia, que recientemente se definieron como un complejo de síntomas conocido como “síndrome genitourinario de la menopausia” 23. Según el último metaanálisis de la Cochrane, el uso de estrógenos vaginales puede mejorar la incontinencia urinaria, especialmente la IUU, aunque la relevancia de esta opción puede cuestionarse en mujeres sin atrofia vaginal24. En un ensayo clínico aleatorizado, Nelken y cols.25 demostraron efectos similares al usar un anillo de estradiol vaginal u oxibutinina oral en mujeres posmenopáusicas con VH, pero con más efectos secundarios para la oxibutinina, lo que refuerza el papel de los estrógenos locales en estos pacientes. No se ha evaluado el impacto del estado menopáusico en el resultado de los tratamientos estándar de la VH, excepto en el caso de mirabegrón, en el que un reciente estudio prospectivo no demostró la influencia de los niveles de hormonas sexuales en la eficacia clínica del agonista β3 adrenérgico26.
En contraste con las mujeres, los datos sobre la deficiencia de hormonas sexuales como un factor causante de la VH en varones son escasos, pero los estudios experimentales sugieren que la testosterona puede disminuir la excitabilidad del detrusor27, mejorar la fibrosis de la pared de la vejiga28 y tener impacto en la liberación de mediadores uroteliales29, lo que puede justificar el papel de la deficiencia de andrógenos en la etiopatogénesis de la VH. Se ha demostrado que el reemplazo de testosterona mejora los STUI en pacientes varones, desafortunadamente sin un análisis detallado sobre su efecto sobre los síntomas de llenado30.
Microbiota urinaria
Tras los avances en los métodos de cultivo, datos recientes sugieren que el tracto urinario humano contiene comunidades microbianas denominadas “microbiota urinaria”, lo que desafía la tradicional creencia de que la orina suele ser estéril31. Según estudios preliminares recientes, la microbiota urinaria puede desempeñar un papel en la patogénesis de la VH, aunque los mecanismos subyacentes a la relación causativa, así como sus posibles implicaciones terapéuticas, aún no están claros31. ADN bacteriano32,33 y una mayor concentración bacteriana34 se detectan con mayor frecuencia en pacientes con IUU, con una posible disminución de la diversidad del microbioma urinario32,34,35. Algunos Lactobacillus spp. (por ejemplo, Lactobacillus crispatus) pueden ser marcadores de una vejiga femenina sana con una carga de Lactobacillus posiblemente más baja en pacientes con IUU32,34. Debido a sus cualidades productoras de ácido, Lactobacillus spp. puede proteger el tracto urinario inferior al controlar el crecimiento de bacterias más virulentas que no pueden sobrevivir en un ambiente ácido. Si bien la administración intravaginal de Lactobacillus parece ser prometedora en la prevención de las infecciones del tracto urinario inferior (ITU) recurrentes, ningún estudio hasta la fecha ha investigado el papel de los probióticos Lactobacillus en la VH32. Varios estudios preliminares han sugerido un impacto significativo del microbioma urinario sobre los resultados de diversos tratamientos de VH, como los antimuscarínicos o la inyección intradetrusor de toxina botulínica33,34,36; así, es más probable que los respondedores tengan menos bacterias y una comunidad menos diversa en algunos de estos estudios34. Esto apoya la idea de que la VH relacionada con la microbiota urinaria puede no ser tratada de manera efectiva con las terapias habituales, aunque los datos de los tres estudios disponibles son contradictorios36. En un estudio reciente se descubrió que un microbioma urinario aberrante, con menos diversidad, se correlaciona positivamente con niveles más altos de depresión y ansiedad35, lo que sugiere que la microbiota urinaria puede tener el mismo potencial que la microbiota intestinal para comunicarse con el cerebro, lo que provoca una notable sensibilización central. Por tanto, igual que está bien establecido el eje cerebro-intestino-microbiota, también puede existir un eje cerebro-vejiga-microbiota. El hecho de que este eje pueda involucrar los mismos mecanismos de comunicación bidireccional (liberación de neurotransmisores, estimulación del sistema inmunitario…) y estar integrado como parte de un eje más global de cerebro-intestino-vejiga-microbiota a través de la sensibilización central, justifica una investigación más profunda y podría proporcionar una mejor comprensión del síndrome de VH. Además, está claro que en la práctica clínica las ITU suelen caracterizarse por síntomas significativos de llenado de la vejiga.
Trastornos funcionales gastrointestinales
La vejiga y el colon-recto tienen el mismo origen embriológico: ambos se desarrollan a partir de la cloaca y, por tanto, comparten vías neurales espinales con aferentes dicotomizados que inervan ambos órganos y convergen en una única raíz de ganglio dorsal, lo que permite mecanismos de comunicación entre la vejiga y el colon37. Estas vías neuronales comunes también pueden ser las impulsoras de la sensibilización cruzada definida como la sensibilización de los nervios aferentes de uno de los órganos pélvicos debido a una lesión aguda en el otro. Se cree que la coexistencia de trastornos funcionales urológicos y gastrointestinales reportados en numerosos estudios está respaldada, al menos en parte, por la intercomunicación de los órganos pélvicos y los mecanismos de sensibilización cruzada37,38.
Varios estudios han sugerido relaciones bidireccionales entre la VH y la incontinencia fecal o el estreñimiento37,38. Sin embargo, la afección gastrointestinal que se ha relacionado más frecuentemente con la VH es el síndrome del intestino irritable (SII)37-39, con una prevalencia de SII tan alta como 33,3 % en pacientes con VH40. Ambos trastornos están caracterizados por una mayor frecuencia de vaciamiento visceral debido a aumento de la sensación (urgencia para la VH, dolor e incomodidad para el SII).
En los últimos años ha aumentado el interés por el posible papel de la sensibilización central en la coexistencia de trastornos urológicos y gastrointestinales funcionales18. Esta sensibilización central puede ser activada por la sensibilización cruzada de los órganos pélvicos, con la activación de vías neurales periféricas, que conducen a una amplificación de la señalización en la médula espinal y el cerebro38. Sin embargo, algunos autores han sugerido recientemente que la sensibilización central puede ser una disfunción primaria que da lugar a la coexistencia de trastornos funcionales tanto gastrointestinales como urológicos junto con trastornos afectivos (es decir, ansiedad y depresión) como parte de un eje cerebro-intestino-vejiga18,19. Este posible fenotipo de VH de eje cerebro-intestino-vejiga puede ser inducido por el estrés debido a factores psicológicos (por ejemplo, un episodio traumático anterior) o factores físicos (es decir, amenaza física interna o externa). Si bien la infección es una amenaza física interna bien establecida que puede causar estrés hipotéticamente, la microbiota intestinal y vesical pueden estar involucradas como factores causales a través de la sensibilización central y periférica, lo que parece apoyar la idea de un eje cerebro-intestino-vejiga-microbiota18,19.
Se ha informado de que los tratamientos dirigidos a la vejiga o a colon-recto mejoran o empeoran los trastornos funcionales en el otro órgano37,38, lo que puede respaldar el uso de tratamientos que han demostrado ser diana tanto para la vejiga como para el intestino en este fenotipo VH, como SNM o estimulación percutánea del nervio tibial posterior (PTNS)41,42. Estudios recientes han indicado el papel potencial de la SNM y la PTNS en el tratamiento del SII en pacientes con trastornos afectivos43; los datos seleccionados también apoyan el papel de la SNM y la PTNS en el tratamiento de la VH inducida por estrés social. Según este planteamiento, la duloxetina16 también puede ser una opción terapéutica futura en el abordaje de pacientes con “eje cerebro-intestino-vejiga-VH”, por tener como objetivo también la sensibilización central. Los tratamientos dirigidos a interferir con la inflamación neurogénica subyacente a la sensibilización cruzada de los órganos pélvicos, como los antagonistas del receptor TRPV1 o los antagonistas de los receptores adrenérgicos α1, también pueden ser enfoques terapéuticos interesantes para evaluar en esta población.
Disfunción del sistema nervioso autónomo
Los nervios simpáticos, parasimpáticos y somáticos son elementos determinantes reconocidos en el funcionamiento fisiológico del tracto urinario inferior, y se ven alterados en varias afecciones neurológicas que se ha demostrado están relacionadas con la disfunción del tracto urinario inferior (parkinsonismo y esclerosis múltiple, por ejemplo)44. Blanc y cols.45 fueron los primeros autores en plantear la hipótesis de que la disfunción subclínica del sistema nervioso autónomo puede ser un factor causante de la VH “idiopática”. Varios años después, Choi y cols.46 confirmaron la hipótesis de un desequilibrio autónomo asociado a la VH. Hubeaux et al pusieron de manifiesto más información exhaustiva sobre esta disfunción del equilibrio autónomo evaluando la variabilidad de la frecuencia cardiaca durante la cistomanometría de llenado47. Comunicaron el predominio de la actividad parasimpática cuando la vejiga está vacía y la preponderancia de la actividad simpática al final del llenado en mujeres con VH, lo cual puede indicar que el llenado vesical induce una respuesta simpática global en mujeres con VH47. Cabe señalar que el mismo grupo de investigación inició otro estudio en el que se demostró que la disfunción simpática parece predominar sobre la disfunción parasimpática en pacientes con VH y que los pacientes con VH y disfunción autónoma podían ser menos propensos a presentar HD en los estudios urodinámicos48. Mientras que otros estudios han demostrado alteraciones parecidas de la actividad simpática en pacientes con VH49, también se ha comunicado una relación entre la VH y una mayor activación parasimpática50. Curiosamente, en un estudio reciente se comunicó que los antimuscarínicos pueden reducir la disfunción parasimpática al tiempo que mejoran los síntomas de la VH en estos pacientes50. En cambio, un reciente informe indica que la disfunción simpática en pacientes con VH puede predecir una escasa respuesta a los antimuscarínicos y plantea la posibilidad de que los agonistas β3 tengan cierto papel a la hora de restituir la activación de las vías simpáticas eferentes cuya disfunción genera la inhibición del músculo detrusor51. Las diversas herramientas de pruebas autónomas quizá puedan ayudar a personalizar el tratamiento de primera línea en pacientes con VH.
Cómo identificar los fenotipos de vejiga hiperactiva
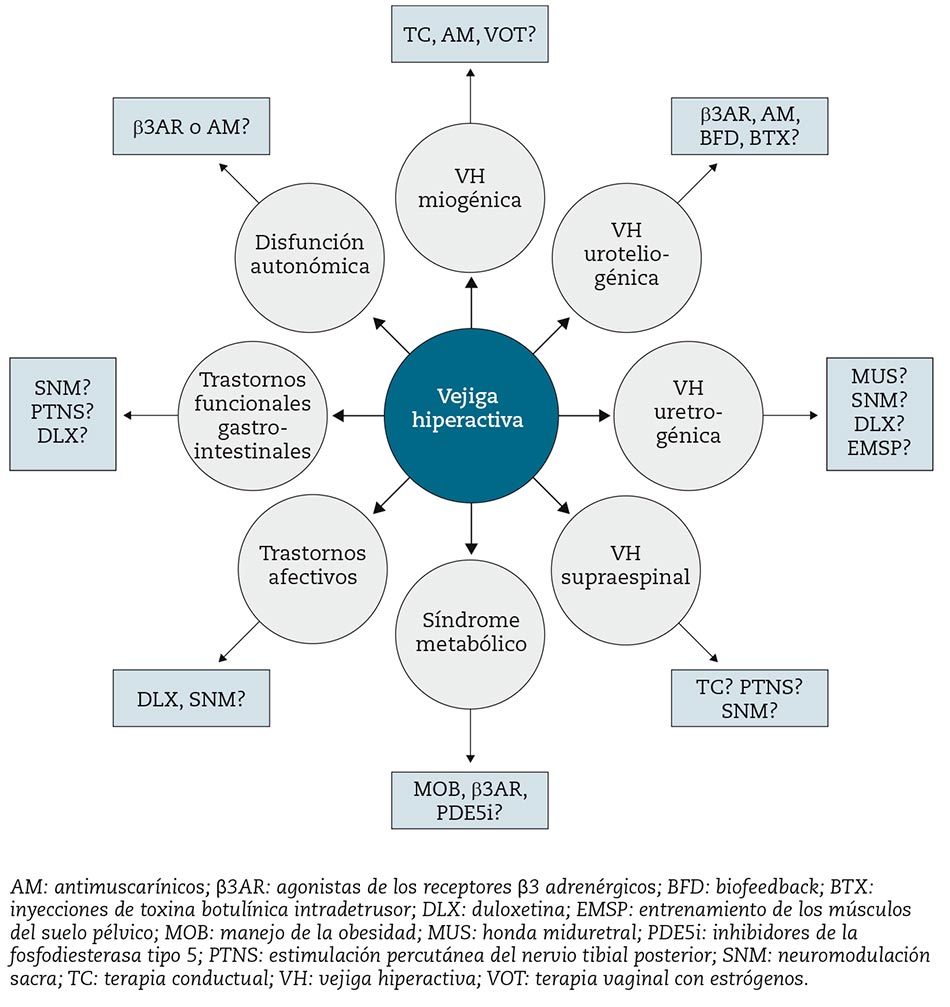
En la actualidad los diversos subtipos de VH se identifican generalmente mediante una gestión ex juvantibus, en la que el fracaso de los tratamientos de primera línea acota la búsqueda de los mecanismos o etiologías reales y el tratamiento adecuado. Los enfoques hipotéticos para diferenciar los distintos patrones de VH se perfilan a continuación y apoyan un enfoque “prisma” (Fig. 1). Esas asunciones sobre el enfoque diagnóstico para la variedad de subtipos de VH, así como sus implicaciones terapéuticas especulativas, están expuestas en la figura 2. A continuación se muestran las hipótesis sobre el enfoque diagnóstico, las cuales no pretenden sustituir las guías clínicas de práctica clínica basadas en la experiencia de la Asociación Europea de Urología, la Asociación Americana de Urología y la Consulta Internacional sobre Incontinencia52-54.
Figura 1 – Enfoque diagnóstico “prisma” de los fenotipos de la VH. Este nuevo enfoque diagnóstico se basa en buscar los fenotipos fisiopatológicos subyacentes, lo cual probablemente podría lograrse a través de un examen clínico exhaustivo (aunque todavía deben identificarse las características clínicas de algunos fenotipos), asociados con la urodinámica y otras pruebas en casos seleccionados (Adaptada cita 61).
Figura 2 – Cambio de paradigma en el manejo de la VH. Esta figura refleja cómo podría ser el futuro algoritmo de tratamiento de la VH, basado en la identificación de los mecanismos fisiopatológicos subyacentes para adaptar el tratamiento a las características de cada paciente. Lo que la figura no refleja claramente es que esos fenotipos no son mutuamente excluyentes y que probablemente se superponen, destacando el papel interesante que podría tener la terapia combinada (Adaptada cita 61).
Evaluación clínica y antecedentes médicos
Es probable que la mayor parte de la elaboración de perfiles de los pacientes con VH pueda realizarse mediante un registro de antecedentes médicos y una evaluación clínica exhaustivos. De hecho, con los antecedentes médicos de un paciente se pueden identificar específicamente varios de los cofactores fisiopatológicos mencionados anteriormente (síndrome metabólico, menopausia, trastornos afectivos y trastornos funcionales gastrointestinales). El uso de puntuaciones y cuestionarios dedicados quizá ayude en la detección y la cuantificación de estos importantes trastornos concomitantes (la Escala de Ansiedad y Depresión Hospitalaria para los trastornos afectivos, por ejemplo). Una entrevista clínica y una evaluación física exhaustivas para identificar los signos y síntomas pertinentes ayudarán a resaltar y a cimentar los mecanismos patológicos que contribuyen a la VH. Por ejemplo, se pueden identificar los componentes específicos del síndrome metabólico (obesidad, hipertensión…) y los síntomas indicativos de andropausia (disfunción eréctil, disminución de la libido…) o menopausia (especialmente la atrofia vulvovaginal). También es importante esclarecer los aspectos específicos sobre la naturaleza de los STUI del paciente. La coexistencia de STUI de vaciado puede indicar una hipoactividad del detrusor, mientras que la urgencia de pie puede indicar que la urgencia es de origen uretral. La existencia de urgencia con o sin incontinencia (VH húmeda o VH seca, respectivamente) puede ayudar a diferenciar la HD de la urgencia causada por hipersensibilidad (y a partir de ahí, hipotéticamente, la disfunción miogénica de la uroteliogénica)55 con posibles implicaciones terapéuticas (escasa experiencia respalda el uso de la toxina botulínica en pacientes con VH seca, por ejemplo)52,53. La uroflujometría y la medición de los residuos del vaciado pueden ser de interés para ayudar a detectar la hipoactividad del detrusor.
Unas sencillas pruebas clínicas del sistema nervioso autónomo (variabilidad en la frecuencia cardiaca, respuesta de la presión sanguínea a estar de pie, por ejemplo) pueden ayudar a identificar la disfunción subclínica del sistema nervioso autónomo en pacientes con VH45-51.
Las manifestaciones clínicas de la sensibilización central también pueden detectarse durante la evaluación clínica empleando un conjunto de técnicas psicofísicas de laboratorio conocido como análisis sensorial cuantitativo51.
Urodinámica
La investigación urodinámica multicanal puede ser de utilidad a la hora de identificar el origen de la urgencia mediante la evaluación de la presencia de HD que indique causas supraespinales o del detrusor. En contraste, la hipersensibilidad vesical sin HD puede ser la característica urodinámica de la VH de origen urotelial. La HD de pie, la HD inducida por la maniobra de Valsalva o las variaciones de presión uretral durante la cistomanometría de llenado pueden indicar urgencia de origen uretral. A partir del estudio urodinámico se puede realizar un diagnóstico de hipoactividad del detrusor como factor que contribuye a los síntomas de llenado. Sin embargo, la relevancia clínica de este tipo de determinación del fenotipo urodinámico de la VH es cuestionable, ya que en varias series se ha comunicado que los diversos tratamientos de la VH tienen una eficacia parecida en pacientes con y sin HD. Teniendo en cuenta la posible falta de potencia estadística y las deficiencias en el diseño de la mayoría de estos estudios, así como la ausencia de datos relativos al impacto de características urodinámicas más complejas sobre los resultados del tratamiento, el papel de las características urodinámicas en el diagnóstico de los fenotipos de VH requiere una evaluación más extensa.
¿Son necesarias más pruebas diagnósticas en el futuro?
Hipotéticamente hablando, puede que unas pruebas más complejas sean de interés para identificar los fenotipos de VH; la medición de las concentraciones en suero y en orina de las hormonas relacionadas con el estrés, como el CRF o el cortisol, puede ser empleada en el futuro para diagnosticar la VH inducida por estrés13. Medir la testosterona sérica puede ayudar a detectar una deficiencia de andrógenos como factor que contribuye a la VH en varones ancianos21. Los marcadores de inflamación como la proteína C reactiva en suero quizá sean de interés a la hora de determinar si la inflamación está implicada en la fisiopatología de la VH1,37,56.
Los estudios de neuroimagen funcional a la larga, combinados con los estudios urodinámicos quizás puedan aportar marcadores supraespinales de los distintos subtipos de VH “cerebral”57,58.
En los últimos 10 años se han estudiado extensamente los marcadores urinarios implicados en la fisiopatología de los STUI, los cuales, en teoría, pueden apuntar hacia algunos subtipos de VH (unos mayores niveles urinarios del factor de crecimiento nervioso y el factor neurotrófico derivado del cerebro pueden indicar una disfunción “sensorial” urotelial/suburotelial o una sensibilización central, por ejemplo)18,59,60. Finalmente, la secuenciación de regiones variables de ARN ribosomal 16S y el cultivo cuantitativo expandido de orina pueden ayudar a identificar la microbiota urinaria31.
Es evidente que estas exhaustivas pruebas son de interés en investigación clínica para comprender mejor los diversos factores fisiopatológicos que contribuyen a la VH, pero es improbable que en el futuro adquieran un papel en la práctica clínica debido a cuestiones prácticas y de la relación coste-eficacia.
Conclusiones
No hay una sola forma de síndrome de VH, sino más bien varios fenotipos de VH basados en los mecanismos subyacentes y cofactores fisiopatológicos, que respaldan un cambio de paradigma en la VH hacia estrategias de tratamiento que pueden adaptarse a las características individuales del paciente (Fig. 2). La experiencia en los últimos años ha demostrado que el síndrome metabólico, los trastornos afectivos, la deficiencia de hormonas sexuales, la microbiota urinaria, los trastornos funcionales gastrointestinales y una disfunción subclínica del sistema nervioso autónomo pueden estar asociados a la VH, y que la VH puede tener su propia fisiopatología específica dentro de todos estos marcos. Consideramos que un enfoque “prisma” (Fig. 1) puede ayudar a identificar estas diversas características fisiopatológicas de VH61. Este enfoque de diferentes fenotipos de VH quizá se traduzca en una mejor toma de decisiones de tratamiento y resultados, a pesar de que actualmente los datos son demasiado escasos. Es importante destacar que estos subtipos de VH claramente no son mutuamente excluyentes y que probablemente se superponen con frecuencia. Creemos que los nuevos estudios deben evaluar los resultados de los tratamientos actuales de VH para cada subpoblación diferente de VH, lo que lleva a enfoques médicos más personalizados, particularmente a medida que avanzamos en la era de la farmacoterapia combinada.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- He Q, Wang Z, Liu G, Daneshgari F, MacLennan GT, Gupta S. Metabolic syndrome, inflammation and lower urinary tract symptoms: possible translational links. Prostate Cancer Prostatic Dis. 2016; 19: 7-13.
- Richter HE, Amundsen CL, Erickson SW, Jelovsek JE, Komesu Y, Chermansky C, et al. Characteristics associated with treatment Response and satisfaction in women undergoing onabotulinumtoxin A and sacral neuromodulation for refractory urgency urinary incontinence. J Urol. 2017; 198: 890-6.
- Lua LL, Pathak P, Dandolu V. Comparing anticholinergic persistence and adherence profiles in overactive bladder patients based on gender, obesity, and major anticholinergic agents. Neurourol Urodyn. 2017; 36: 2123-31.
- Hainer V. Beta3-adrenoreceptor agonist mirabegron – a potential antiobesity drug? Expert Opin Pharmacother. 2016; 17: 2125-7.
- Krhut J, Martan A, Zachoval R, Hanuš T, Švabík K, Zvara P. Impact of body mass index on treatment efficacy of mirabegron for overactive bladder in females. Eur J Obstet Gynecol Reprod Biol. 2016; 196: 64-8.
- Mossa A, Velasquez Flores M, Nguyen H, Cammisotto PG, Campeau L. Beta-3 adrenoceptor signaling pathways in urothelial and smooth muscle cells in the presence of succinate. J Pharmacol Exp Ther. 2018; 367: 252-9.
- Chen H, Wang F, Yu Z, Zhang Y, Liu C, Dai S, et al. Efficacy of daily low-dose tadalafil for treating overactive bladder: results of a randomized, double-blind, placebo-controlled trial. Urology. 2017; 100: 59-64.
- Ding H, Li N, He X, Liu B, Dong L, Liu Y. Treatment of obesity-associated overactive bladder by the phosphodiesterase type-4 inhibitor roflumilast. Int Urol Nephrol. 2017; 49: 1723-30.
- Subak LL, Wing R, West DS, Franklin F, Vittinghoff E, Creasman JM, et al. Weight loss to treat urinary incontinence in overweight and obese women. N Engl J Med. 2009; 360: 481-90.
- Ait Said K, Leroux Y, Menahem B, Doerfler A, Alves A, Tillou X. Effect of bariatric surgery on urinary and fecal incontinence: prospective analysis with 1-year follow-up. Surg Obes Relat Dis. 2017; 13: 305-12.
- Luke S, Addison B, Broughton K, Masters J, Stubbs R, Kennedy-Smith A.Effects of bariatric surgery on untreated lower urinary tract symptoms: a prospective multicentre cohort study. BJU Int. 2015; 115: 466-72.
- Vrijens D, Drossaerts J, van Koeveringe G, Van Kerrebroeck P, van Os J, Leue C. Affective symptoms and the overactive bladder – a systematic review. J Psychosom Res. 2015; 78: 95-108.
- Klausner AP, Steers WD. Corticotropin releasing factor: a mediator of emotional influences on bladder function. J Urol. 2004; 172: 2570-3.
- Wróbel A, Doboszewska U, Rechberger E, Wlaź P, Rechberger T. SN003, a CRF1 receptor antagonist, attenuates depressive-like behavior and detrusor overactivity symptoms induced by 13-cis-retinoic acid in rats. Eur J Pharmacol. 2017; 812: 216-24.
- Chiba H, Mitsui T, Kitta T, Ohmura Y, Moriya K, Kanno Y, et al. The role of serotonergic mechanism in the rat prefrontal cortex for controlling the micturition reflex: An in vivo microdialysis study. Neurourol Urodyn. 2016; 35: 902-7.
- Wróbel A, Rechberger E, Rechberger T. The influence of duloxetine on detrusor overactivity in rats with depression induced by 13-cis-retinoic acid. Int Urogynecol J. 2018; 29: 987-95.
- Kaneko Y, Szallasi A. Transient receptor potential (TRP) channels: a clinical perspective. Br J Pharmacol. 2014; 171: 2474-507.
- Reynolds WS, Dmochowski R, Wein A, Bruehl S. Does central sensitization help explain idiopathic overactive bladder? Nat Rev Urol. 2016; 13: 481-91.
- Leue C, Kruimel J, Vrijens D, Masclee A, van Os J, van Koeveringe G. Functional urological disorders: a sensitized defence response in the bladder-gut-brain axis. Nat Rev Urol. 2017; 14: 153-63.
- Killinger KA, Fergus J, Edwards L, Boura JA, Bartley J, Gupta P, et al. Coexisting depressive symptoms do not limit the benefits of chronic neuromodulation: A study of over 200 patients. Neurourol Urodyn. 2018; 37: 815-22.
- Hanna-Mitchell AT, Robinson D, Cardozo L, Everaert K, Petkov GV.Do we need to know more about the effects of hormones on lower urinary tract dysfunction? ICI-RS 2014. Neurourol Urodyn. 2016; 35: 299-303.
- Lee KC. Changes of muscarinic receptors and connexin-43 expression as a mechanism of overactive bladder in ovariectomized rats. World J Urol. 2015; 33: 1875-9.
- Portman DJ, Gass ML Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. J Sex Med. 2014; 11: 2865-72.
- Cody JD, Jacobs ML, Richardson K, Moehrer B, Hextall A.Oestrogen therapy for urinary incontinence in post-menopausal women. Cochrane Database Syst Rev. 2012; 10: CD001405.
- Nelken RS, Ozel BZ, Leegant AR, Felix JC, Mishell DR Jr.Randomized trial of estradiol vaginal ring versus oral oxybutynin for the treatment of overactive bladder. Menopause. 2011; 18: 962-6.
- Kallner HK, Elmér C, Andersson KE, Altman D. Hormonal influence on the effect of mirabegron treatment for overactive bladder. Menopause. 2016; 23: 1303-6.
- Hristov KL, Parajuli SP, Provence A, Petkov GV.Testosterone decreases urinary bladder smooth muscle excitability via novel signaling mechanism involving direct activation of the BK channels. Am J Physiol Renal Physiol. 2016; 311: F1253-9.
- de Barros CA, Lorenzetti F, Ortiz V, Dambros M.Testosterone supplementation’s effects on age-related bladder remodeling – experimental study in rats. Aging Male. 2013; 16: 102-7.
- Bravo G, Massa H, Rose’Meyer R, Chess-Williams R, McDermott C, Sellers DJ.Effect of short-term androgen deficiency on bladder contractility and urothelial mediator release. Naunyn Schmiedebergs Arch Pharmacol. 2017; 390: 547-56.
- Haider KS, Haider A, Doros G, Traish A. Long-term testosterone therapy improves urinary and sexual function, and quality of life in men with hypogonadism: results from a propensity matched subgroup of a controlled registry study. J Urol. 2018; 199: 257-65.
- Aragón IM, Herrera-Imbroda B, Queipo-Ortuño MI, Castillo E, Del Moral JS, Gómez-Millán J, et al. The urinary tract microbiome in health and disease. Eur Urol Focus. 2018; 4: 128-38.
- Pearce MM, Hilt EE, Rosenfeld AB, Zilliox MJ, Thomas-White K, Fok C, et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. MBio. 2014; 5: e01283-14.
- Brubaker L, Nager CW, Richter HE, Visco A, Nygaard I, Barber MD, et al. Urinary bacteria in adult women with urgency urinary incontinence. Int Urogynecol J. 2014; 25: 1179-84.
- Thomas-White KJ, Hilt EE, Fok C, Pearce MM, Mueller ER, Kliethermes S, et al. Incontinence medication response relates to the female urinary microbiota. Int Urogynecol J. 2016; 27: 723-33.
- Wu P, Chen Y, Zhao J, Zhang G, Chen J, Wang J, et al. Urinary microbiome and psychological factors in women with overactive bladder. Front Cell Infect Microbiol. 2017; 7: 488.
- Pearce MM, Zilliox MJ, Rosenfeld AB, Thomas-White KJ, Richter HE, Nager CW, et al. The female urinary microbiome in urgency urinary incontinence. Am J Obstet Gynecol. 2015; 213: 347.e1-11.
- Malykhina AP, Wyndaele JJ, Andersson KE, De Wachter S, Dmochowski RR. Do the urinary bladder and large bowel interact, in sickness or in health? ICI-RS 2011. Neurourol Urodyn. 2012; 31: 352-8.
- Kaplan SA, Dmochowski R, Cash BD, Kopp ZS, Berriman SJ, Khullar V. Systematic review of the relationship between bladder and bowel function: implications for patient management. Int J Clin Pract. 2013; 67: 205-16.
- Persson R, Wensaas KA, Hanevik K, Eide GE, Langeland N, Rortveit G. The relationship between irritable bowel syndrome, functional dyspepsia, chronic fatigue and overactive bladder syndrome: a controlled study 6 years after acute gastrointestinal infection. BMC Gastroenterol. 2015; 15: 66.
- Matsumoto S, Hashizume K, Wada N, Hori J, Tamaki G, Kita M, et al. Relationship between overactive bladder and irritable bowel syndrome: a large-scale internet survey in Japan using the overactive bladder symptom score and Rome III criteria. BJU Int. 2013; 111: 647-52.
- Caremel R, Damon H, Ruffion A, Chartier-Kastler E, Gourcerol G, Michot F, et al. Can sacral neuromodulation improve minor incontinence symptoms in doubly incontinent patients successfully treated for major incontinence symptoms? Urology. 2012; 79: 80-5.
- Booth J, Hagen S, McClurg D, Norton C, MacInnes C, Collins B, et al. A feasibility study of transcutaneous posterior tibial nerve stimulation for bladder and bowel dysfunction in elderly adults in residential care. J Am Med Dir Assoc. 2013; 14: 270-4.
- Lewis-Fernández R, Lam P, Lucak S, Galfalvy H, Jackson E, Fried J, et al. An open-label pilot study of duloxetine in patients with irritable bowel syndrome and comorbid major depressive disorder. J Clin Psychopharmacol. 2016; 36: 710-5.
- McLeod JG, Tuck RR. Disorders of the autonomic nervous system: Part 1. Pathophysiology and clinical features. Ann Neurol. 1987; 21: 419-30.
- Blanc F, Pichot V, Roche F, Barthelemy JC, Tostain J. Activity of the autonomous nervous system measured based on the variability of heart rate in female urinary incontinence. Prog Urol. 2001; 11: 492-7.
- Choi JB, Kim YB, Kim BT, Kim YS. Analysis of heart rate variability in female patients with overactive bladder. Urology. 2005; 65: 1109-12.
- Hubeaux K, Deffieux X, Ismael SS, Raibaut P, Amarenco G. Autonomic nervous system activity during bladder filling assessed by heart rate variability analysis in women with idiopathic overactive bladder syndrome or stress urinary incontinence. J Urol. 2007; 178: 2483-7.
- Hubeaux K, Deffieux X, Raibaut P, Le Breton F, Jousse M, Amarenco G. Evidence for autonomic nervous system dysfunction in females with idiopathic overactive bladder syndrome. Neurourol Urodyn. 2011; 30: 1467-72.
- Ben-Dror I, Weissman A, Leurer MK, Eldor-Itskovitz J, Lowenstein L. Alterations of heart rate variability in women with overactive bladder syndrome. Int Urogynecol J. 2012; 23: 1081-6.
- Aydogmus Y, Uzun S, Gundogan FC, Ulas UH, Ebiloglu T, Goktas MT. Is overactive bladder a nervous or bladder disorder? Autonomic imaging in patients with overactive bladder via dynamic pupillometry. World J Urol. 2017; 35: 467-72.
- Ates E, Ipekci T, Akin Y, Kizilay F, Kukul E, Guntekin E. Impact of sympathetic dysfunction in the etiology of overactive bladder in women: A preliminary study. Neurourol Urodyn. 2016; 35: 26-8.
- Burkhard FC, Bosch JLHR, Cruz F, Lemack GE, Nambiar AK, Thiruchelvam N, et al. EAU Guidelines on Urinary Incontinence in Adults. European Association of Urology (EAU). 2019 [consultado 20 Julio 2019]. Disponible en: https: //uroweb.org/guideline/urinary-incontinence/
- Gormley EA, Lightner DJ, Burgio KL, Chai TC, Clemens JQ, Culkin DJ, et al. Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline. J Urol. 2012; 188(6 Suppl): 2455-63.
- Abrams P, Cardozo L, Wagg A, Wein A. 6th International Consultation on Incontinence. Recommendations of the International Scientific Commitee: evaluation and treatment of urinary incontinence, pelvic organ prolapse and faecal incontinence. Neurourol Urodyn. 2018; 37(7): 2271-2.
- Giarenis I, Musonda P, Mastoroudes H, Robinson D, Cardozo L. Can we predict detrusor overactivity in women with lower urinary tract symptoms? The King’s Detrusor Overactivity Score (KiDOS). Eur J Obstet Gynecol Reprod Biol. 2016; 205: 127-32.
- Hsiao SM, Lin HH, Kuo HC. The role of serum C-reactive protein in women with lower urinary tract symptoms. Int Urogynecol J. 2012; 23: 935-40.
- Weissbart SJ, Bhavsar R, Rao H, Wein AJ, Detre JA, Arya LA, et al. Specific changes in brain activity during urgency in women with overactive bladder after successful sacral neuromodulation: a functional magnetic resonance imaging study. J Urol. 2018; 200: 382-8.
- Nardos R, Karstens L, Carpenter S, Aykes K, Krisky C, Stevens C, et al. Abnormal functional connectivity in women with urgency urinary incontinence: Can we predict disease presence and severity in individual women using Rs-fcMRI. Neurourol Urodyn. 2016; 35: 564-73.
- Peyronnet B, Bendavid C, Manunta A, Damphousse M, Cheensse C, Brochard C, et al. The role of urinary markers in the assessment and follow-up of lower urinary tract disorders: a literature review. Prog Urol. 2015; 25: 188-99.
- Birder LA, Ruggieri M, Takeda M, van Koeveringe G, Veltkamp S, Korstanje C, et al. How does the urothelium affect bladder function in health and disease? ICI-RS 2011. Neurourol Urodyn. 2012; 31: 293-9.
- Peyronnet B, Mironska E, Chapple C, Cardozo L, Oelke M, Dmochowski R, et al. A comprehensive review of overactive bladder pathophysiology: on the way to tailored treatment. Eur Urol. 2019; 75: 988-1000.