Artículo de Revisión
Información del artículo
Historia del artículo:
Recibido el 19 de mayo de 2020
Aceptado el 10 de septiembre de 2020
On-line el 23 de diciembre de 2020
Palabras clave:
Probióticos
Prebióticos
Simbióticos
Microbiota
*Autor para correspondencia
Correo electrónico:
jcucalona@semg.es
(J.M. Cucalón Arenal).
Keywords:
Probiotics
Prebiotics
Symbiotics
Microbiota
José Manuel Cucalón Arenal*, María Guadalupe Blay Cortés
Grupo de Trabajo de Endocrinología, Metabolismo y Nutrición de la SEMG
Resumen
Las posibilidades clínico-terapéuticas de este tipo de alternativas biológicas están suponiendo un interés excepcional en la clase médica asistencial. Las diferentes patologías que responden a esta alternativa terapéutica son cada día mayores. No solo la patología digestiva es subsidiaria de esta terapia, sino patologías relacionadas con el ámbito inmunitario, alérgico, degenerativo, etc, tienen el campo abierto a la investigación. Son numerosas las posibilidades terapéuticas y las diferentes entidades nosológicas que se benefician de esta terapia, yendo las primeras desde la administración de lactobacilos hasta el trasplante fecal. El posicionamiento de las diferentes Sociedades Científicas, así como la publicación de Guías de práctica clínica nos conducen hacia la mejor forma de afrontar patología y abordaje terapéutico con estas terapias biológicas. El médico de familia debe estar actualizado en este nuevo enfoque terapéutico.
© 2020 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Update on probiotics, prebiotics and symbiotics for the family physician (II)
Abstract
The clinical-therapeutic possibilities of this type of biological alternatives are leading to an exception interest in the health care medical class. The different conditions that respond to this therapeutic alternative are increasing greater every day. It is not only the digestive diseases that are subsidiary of this therapy. Conditions related with the immune, allergic, degenerative, etc. setting also have the field open to research. The therapeutic possibilities and the different nosological entities that benefit from this therapy are numerous, these going from the administration of lactobacilli to fecal transplantation. The positioning of the different Scientific Societies, as well as the publication of the clinical practice guidelines, are leading us towards the best way of coping with the condition and the therapeutic approach with these biologic therapies. The family physician must be up to date regarding this new therapeutic approach.
© 2020 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Indicaciones y aplicaciones clínicas de los probióticos
Los médicos de familia nos fiamos de las fuentes tradicionales de conocimiento, como revistas oficiales y artículos publicados en revistas de prestigio contrastado, que nos permiten disminuir la incertidumbre, así como ofrecernos Guías de Práctica Clínica en función de la experiencia científica obtenida a través de estudios de investigación serios y evaluados (por ejemplo, GPC de prebióticos y prebióticos de la WGO). Es precisamente la demostración de esta experiencia la que nos permite aplicar con seguridad los métodos de diagnóstico y tratamiento en nuestra asistencia médica diaria.
En este tema en concreto, se mezcla la experiencia y la moda. Puede generarse incredulidad acerca del manejo de los probióticos y simbióticos para tratar algunas afecciones clínicas y que ello provoque más incertidumbre que experiencia. En cuanto a fuentes primarias existen ya, desde hace años, revistas de primer nivel específicas como International Journal of Probiotics and Prebiotics (2006), Probiotics and Antimicrobial Proteins (2009), Beneficial Microbes (2010), Gut Microbes (2010), Journal of Probiotics and Health (2013) y otras muchas. Además, los principales medios de comunicación de las más reconocidas especialidades publican artículos sobre probióticos y prebióticos. Así, Gastroenterology, Gut, Journal of Nutrition, American Journal of Clinical Nutrition, Pediatrics, Microbiology, Atención Primaria, Family Practice y otras muchas han tratado este tema tan actual. Por tanto, hay publicaciones, hay estudios bien construidos y hay experiencia con sus correspondientes grados de recomendación22.
Hoy en día se está dando más importancia a la modulación de la microbiota mediante el empleo de probióticos para tratar determinadas enfermedades, principalmente gastrointestinales. Ejemplo de ello son los diferentes tipos de diarreas (por antibióticos, víricas, de la comunidad, del viajero, intolerancia a la lactosa…), trastornos funcionales (cólico del lactante, síndrome del intestino irritable…) o procesos inflamatorios como la colitis ulcerosa u otras. Pero, además, se utilizan en patologías vulvovaginales, mastitis y enfermedades alérgicas como la dermatitis atópica o en algunas enfermedades infecciosas. Están abriéndose campos de estudio en relación con la nutrición y los problemas derivados como obesidad, así como enfermedades neurológicas (autismo, depresión, ansiedad…), enfermedad periodontal e incluso en algunos tipos de cáncer. Pronto se oirá hablar de su papel en la enfermedad cardiovascular, la arteriosclerosis, la diabetes o el síndrome metabólico22.
Así pues, y dadas las experiencias publicadas, nos preguntamos, en qué entidades clínicas podemos utilizar con seguridad y eficacia los probióticos, prebióticos y simbióticos. Ofrecemos un repaso de las principales indicaciones y aplicaciones clínicas que nos parecen más relacionadas con nuestra especialidad y dejamos para el futuro otras aplicaciones aún en estudio y sin resultados concluyentes que nos proporcionen seguridad en su empleo. La velocidad en la aparición de experiencia queda reflejada en la multiplicación de citas en Pubmed en los últimos años. Por ejemplo, si realizamos en estos momentos una búsqueda bibliográfica en Pubmed, aparecen más de 2.400 ensayos clínicos sobre probióticos en diferentes patologías.
Aplicaciones en patología digestiva
Diarrea asociada a antibióticos
Los antibióticos son unos de los grupos farmacológicos que con más frecuencia producen diarrea como efecto secundario. Su incidencia es muy variable y depende del espectro antibiótico, farmacocinética, vía de administración, posología, duración del tratamiento y factores predisponentes del huésped. Prácticamente, todos los antibióticos se han relacionado con el desarrollo de diarrea; los más habitualmente asociados son clindamicina, penicilinas y cefalosporinas23. La combinación amoxicilina-ácido clavulánico, generalmente la más prescrita, es la que causa este trastorno con más frecuencia.
En el Estudio Prodeggio 201924 evaluaron el efecto preventivo de un simbiótico multiespecie con 7 cepas probióticas más prebióticos en la reducción de la incidencia de la diarrea asociada a antibióticos, en este caso amoxicilina más clavulánico, indicados en odontología. Participaron 147 pacientes, de entre 18 y 65 años, que fueron asignados aleatoriamente al grupo simbiótico (n= 74) y al grupo placebo (n= 73). La diarrea se describió como la presencia de tres o más deposiciones al día de heces sueltas o líquidas (deposiciones de tipo 5-7 en la Escala de Bristol), como se define en la OMS, y se precisó que en un episodio de diarrea acontecen uno o más días con diarrea. Se evidenció una reducción significativa en la incidencia de la diarrea en los pacientes que recibieron el simbiótico en comparación con los que recibieron el placebo (p< 0,0001), lo que permitió reducir a la mitad el número de pacientes que experimenta diarrea a lo largo del tratamiento antibiótico (7 días). La reducción de la incidencia de diarrea se observó desde las primeras 24 horas. El efecto positivo del simbiótico fue especialmente evidente en la consistencia de las heces: los pacientes que recibieron el simbiótico presentaron una reducción significativa en el número de heces sueltas o líquidas en comparación con los que recibieron el placebo.
Diarrea de origen vírico
Las gastroenteritis de origen vírico son las más frecuentes en los países industrializados. Los norovirus fueron los primeros virus que se visualizaron en las heces en 1972. El año siguiente se identificaron los rotavirus y a partir de entonces otros virus se han ido asociando a infecciones gastrointestinales, entre los que se encuentran los astrovirus, los adenovirus entéricos…25.
Estas gastroenteritis víricas son algunas de las enfermedades más comunes en todos los grupos de edad, y una causa importante de morbilidad. Por otro lado, las gastroenteritis por rotavirus, en el caso de la población infantil, son uno de los motivos más importantes de atención o ingreso hospitalario, con un elevado coste sanitario y social20. En Europa es la patología más frecuente en el niño sano: se estima una incidencia anual de 0,5 a 2 episodios en los niños menores de tres años26.
En los últimos años los probióticos han surgido como un nuevo elemento en la prevención y tratamiento de la diarrea infecciosa. La revisión de los estudios realizados en los últimos años para establecer el efecto de los probióticos en el tratamiento de la diarrea aguda infecciosa muestra un beneficio clínico moderado de algunos probióticos en el tratamiento de la diarrea aguda acuosa, principalmente por rotavirus y en lactantes y niños pequeños. Este efecto depende de la cepa: el Lactobacillus rhamnosus GG es una de las cepas más estudiadas (para dosis superiores a 1010 UFC)26.
En el estudio de García Menor (Global Pediatric Health 2016)27 se evaluaron los beneficios adicionales de la administración de un simbiótico multiespecie en el tratamiento clínico de la diarrea aguda de supuesto origen vírico en niños de entre 6 meses y 12 años.
Se trataba de un estudio multicéntrico, aleatorizado y controlado, con una muestra de 101 niños. Fueron evaluados 85 de ellos tras ser distribuidos aleatoriamente en un grupo control (42 pacientes) y en el grupo del simbiótico (43 pacientes). También evaluaron la adhesión al tratamiento, la presencia de eventos adversos y registraron la hora de la primera deposición normal. Este estudio permitió demostrar que los niños que recibieron el simbiótico mostraron una evolución más favorable de la diarrea que los del grupo control. En tan solo 5 días, el 95% de los niños que recibieron el simbiótico se habían recuperado de la diarrea, frente al 78% del grupo control. Además, en el subgrupo de niños de hasta 2 años, la duración de la diarrea fue de dos días menos frente al control.
La administración del simbiótico en niños con diarrea vírica acelera la recuperación y disminuye el tiempo medio de la duración de la diarrea.
Diarrea asociada a Clostridium difficile (DACD)
El Clostridium difficile es la causa más frecuente de colitis asociada a antibióticos en pacientes internados. Puede ocasionar una amplia gama de manifestaciones, desde portador asintomático a diarrea intensa o incluso colitis pseudomembranosa que a veces evoluciona con graves complicaciones. La fuente de C. difficile puede ser endógena o ambiental. Los pacientes infectados o colonizados constituyen un importante reservorio. Se estima que aproximadamente el 3-11 % de la población adulta es portadora sana de C. difficile. Entre la población hospitalaria están colonizados alrededor del 20 % de los pacientes que han recibido antibióticos; de los ancianos que residen en instituciones geriátricas lo están entre un 2 y un 8 %23.
En la publicación de Asensio28 se estimó que anualmente se producen 7.601 episodios de diarrea asociada a C. difficile (DACD) en España, con un gasto anual para el SNS de 32.157.093 Ä. El coste por episodio de DACD: 3.901 Ä se corresponde con la infección inicial, 4.875 Ä a la primera recurrencia y 5.916 Ä a la segunda recurrencia. El coste total de las recurrencias es de 10.426.750 Ä anuales. El 95,6 % del gasto se debe a la prolongación de la duración de la estancia hospitalaria, el 0,5 % a tratamientos antibióticos, el 2,8 % a intervenciones quirúrgicas y el 1,1 % a las medidas de control de la infección. Según este estudio, el gasto asociado a la DACD se debe fundamentalmente a la prolongación de los ingresos hospitalarios y tiene un gran impacto económico sobre el SNS28.
Consideramos este apartado de especial relevancia, puesto que la diarrea ocasional produce un malestar importante al individuo que la padece. Por ello deben tenerse en cuenta estrategias coste-efectivas, como son los probióticos, encaminadas a mejorar esta sintomatología. Como dato curioso, existen actualmente más de 350 estudios clínicos publicados en Pubmed sobre probióticos y diarrea.
Estreñimiento
Es un problema frecuente en la edad pediátrica. Su prevalencia estimada varía entre el 0,3 % y el 8 % de la población infantil. Es además un motivo de consulta frecuente: puede representar el 3-5 % de las visitas al pediatra y hasta un 25 % de los niños enviados a la consulta de gastroenterología pediátrica29.
Sadeghzadeh (Int Journal of Pediatrics. 2014)30 evaluaron la efectividad de un simbiótico en el estreñimiento infantil. Es un estudio aleatorio, doble ciego, controlado por placebo y desarrollado en una muestra de 102 niños de 4 a 12 años que presentan estreñimiento funcional. Se dividieron en 3 grupos, de manera que el grupo A recibió 1,5 ml/kg/día de parafina líquida oral más placebo; el grupo B recibió un sobre de simbiótico por día más placebo; y el grupo C, 1,5 ml/kg/día de parafina líquida oral más un sobre de simbiótico por día. A todos ellos se les realizó una evaluación según los criterios de Roma III durante 4 semanas. En cada grupo, antes y después del tratamiento, se determinó la frecuencia de las evacuaciones, la consistencia de las heces, el número de episodios de incontinencia fecal, el dolor abdominal, la defecación dolorosa por semana, el éxito del tratamiento y los efectos secundarios. La frecuencia de las deposiciones por semana aumentó en todos los grupos y fue mayor en el grupo C, el grupo con el simbiótico multiespecie, en comparación con el A y B. La consistencia de las heces aumentó y el número de episodios de incontinencia fecal, dolor abdominal y defecación dolorosa por semana disminuyó en todos los grupos de manera similar y sin ninguna diferencia estadística entre ellos.
Helicobacter pylori
La infección por Helicobacter pylori afecta a alrededor del 50 % de la población mundial y desempeña un papel fundamental en el desarrollo de diversas enfermedades digestivas, como la gastritis crónica, la úlcera péptica y el cáncer gástrico31.
H. pylori es una de las causas más frecuentes de infección bacteriana crónica. Afecta a la población mundial y a todas las edades. En países desarrollados la infección es excepcional en el primer año de vida, baja en la infancia y aumenta posteriormente con la edad. En países en desarrollo la prevalencia es alta al final del primer año de vida y puede afectar a la mayor parte de la población al final de la adolescencia. En nuestro medio, la tasa de prevalencia de H. pylori en niños sanos es de alrededor del 22 %, similar a la de otros países de nuestro entorno geográfico32.
El estudio de Khodadad (Iran J. Pediatr. 2013)33 evaluó si asociar un simbiótico multiespecie a un tratamiento contra H. pylori estándar (dos antibióticos junto con omeprazol) podía minimizar la prevalencia de efectos secundarios gastrointestinales y mejorar la tasa de erradicación. Era un estudio aleatorio doble ciego controlado por placebo en el que participaron 66 niños H. pylori positivos. Fueron tratados con un protocolo de tratamiento (omeprazol + amoxicilina + furazolidon). Todos los pacientes se sometieron a una esofagogastroduodendoscopia y la infección por H. pylori fue diagnosticada por un test de ureasa. El estado del H. pylori se evaluó después de 4 a 8 semanas de la finalización del tratamiento con prueba de antígenos de H. pylori en las heces. La administración del simbiótico multiespecie asociado a los tratamientos antibióticos erradicadores redujo por 4 la probabilidad de la aparición de diarrea y aumentó la erradicación en 20,40 % respecto a solo la triple terapia. Este estudio demuestra que los probióticos tienen un efecto positivo en la erradicación de la infección por H. pylori y recoge la recomendación de terapia adyuvante con probióticos para reducir la frecuencia de los efectos secundarios inducidos por los antibióticos durante el tratamiento con ellos.
Síndrome del intestino irritable
En los últimos años han tenido lugar importantes contribuciones al conocimiento etiopatogénico, con las que se demuestra que algunos pacientes con síndrome del intestino irritable (SII) presentan una alteración de la microbiota y cambios en la mucosa intestinal34.
Estudios iniciales sobre la microbiota intestinal en pacientes con SII muestran una disminución en la proporción de Bifidobacterium y Lactobacillus y un incremento de Enterobacter34.
Los resultados del metaanálisis de Didari35 muestran un beneficioso efecto de los probióticos en el SII comparado con placebo. Se realiza un análisis de la evaluación del dolor, en el que se refleja que los probióticos reducen significativamente el dolor intenso tras ocho y diez semanas de administración. En general, los probióticos pueden tener un papel terapéutico beneficioso en los pacientes con SII35.
Recientes estudios han probado Lactobacillus rhamnosus cepa Gorbach-Goldin (LGG) en el SII en niños y adultos y sus resultados confirman la actividad del LGG en la sintomatología del SII tanto en niños como adultos36.
Dispepsia funcional
Igarashi y cols. presentaron un estudio cuyo objetivo fue analizar la microbiota del fluido gástrico entre pacientes con dispepsia funcional (DF) y pacientes sanos como controles para evaluar el efecto de probióticos en la microbiota37.
La muestra del estudio estaba constituida por 24 pacientes japoneses con dispepsia funcional, que cumplían con la definición de la clasificación Roma III, y 21 pacientes sanos pertenecientes al grupo control. A todos los pacientes con DF se les pidió que consumieran 118 g de yogur (con una concentración de 109 UFC de LG21) todos los días durante un tratamiento de 12 semanas. Los pacientes fueron informados de que el objetivo final del estudio era examinar la influencia del yogur en la microbiota del fluido gástrico37. Los resultados del estudio permitieron observar que los pacientes con DF presentaban alterada la microbiota del líquido gástrico en comparación con los voluntarios control sanos. El resultado de este estudio refleja que los probióticos parecen efectivos en el tratamiento de la dispepsia funcional a través de la normalización de la microbiota gástrica37.
Sobrecrecimiento bacteriano
En el estudio de Zhong y cols. se recoge un metaanálisis y un examen sistemático de la experiencia actual acerca de la eficacia de los probióticos en la prevención o el tratamiento del crecimiento excesivo de las bacterias del intestino delgado38.
La eficacia de la prevención se evaluó por la incidencia de sobrecrecimiento bacteriano en el intestino delgado en el grupo de los probióticos y la eficacia del tratamiento en función de la tasa de descontaminación del sobrecrecimiento bacteriano, la reducción de la concentración de H2 y la mejora de la sintomatología38. Los resultados reflejaron que la suplementación de probióticos puede descontaminar eficazmente el sobrecrecimiento bacteriano del intestino delgado, disminuir la concentración de H2 y aliviar el dolor abdominal38.
No debemos olvidar otras patologías en el recién nacido, en el lactante (en las fórmulas lácteas infantiles), en la edad pediátrica y en el adulto, que han sido objeto de investigaciones con probióticos. En ellas ya hay experiencia acerca de su uso, algo que no podemos tratar con más amplitud por no hacer un tratado sobre este tema. Basten como ejemplo las siguientes patologías: síndrome del Intestino corto, enfermedad celiaca, malabsorción de lactosa, trastornos funcionales digestivos, enfermedad inflamatoria intestinal, hígado graso no alcohólico, fibrosis quística, trasplante hepático, pancreatitis… Incluimos alguna referencia para ampliar información sobre estos temas39-42.
Aplicaciones en ginecología
Infecciones vulvovaginales
Son motivo frecuente de consultas en varias especialidades (atención primaria, Urgencias…) y suponen hasta el 25 % de las consultas en ginecología. Gran parte de la población femenina sufrirá a lo largo de su vida una infección vulvovaginal IVV (hasta un 75 %) y muchas con carácter recurrente (40 %).
En Europa la más prevalente es, sin duda, la vaginitis candidiásica, segunda en frecuencia en Estados Unidos tras la vaginosis. El tratamiento clásico de la vaginitis candidiásica se basa en imidazólicos o pirididona; en la vaginosis se utiliza fundamentalmente metronidazol o clindamicina.
Como se ha mencionado en el apartado de microbiota vaginal, el papel de los lactobacilos es fundamental para mantener el equilibrio homeostático en la vagina y regular el sobrecrecimiento de otros microorganismos. Ya vimos los mecanismos regulatorios de los lactobacilos en este microsistema, entre los que destaca la producción de agua oxigenada, ácidos orgánicos y bacteriocinas, que regulan el pH y la colonización y bloquean las adhesinas del patógeno.
Por tanto, el mantenimiento de una microbiota rica en lactobacilos protege y mantiene estable el nicho ecológico vaginal. Se utilizan probióticos con el fin de mantener dicho status. Son útiles en el tratamiento de la vaginitis y vaginosis y en sus recurrencias. Se utilizan cepas de Lactobacillus fundamentalmente rhamnosus, reuteri, acidofilus, fermentum, gasseri, plantarum, casei, mezclados o no con otras especies, como Streptococus thermophilus u otras asociaciones43-45.
Se incluyen los principales estudios y cepas en la tabla 1, así como los resultados obtenidos en los ensayos en la tabla 2.
Como se pone de manifiesto en la tabla anterior, el Lactobacillus rhamnosus y el Lactobacillus reuteri son parte de los probióticos que presentan una mayor experiencia científica en el tratamiento de patologías genitourinarias.
Mastitis lactacional
Es una entidad casi siempre de origen infeccioso, que provoca gran malestar en la madre (influye en la comunicación madre-hijo, además del dolor y síntomas que provoca) y que suele producirse en las primeras 10-12 semanas. Se da en un destacado porcentaje de madres (hasta el 30 %). Destaca el papel etiológico del Staphylococcus aureus (más de 70 %), seguido del S. epidermidis y de corynebacterias. La antibioterapia utilizada provoca disbiosis en la microbiota de la mama, por lo que están indicados los tratamientos adyuvantes con simbióticos o probióticos.
El papel destacado de los lactobacilos es conocido también en este punto, por lo que se aconseja su utilización en esta patología. Se utilizan cepas como L. coryniformis, L. fermentum, L. gasseri y L. salivarius, con gran eficacia y total seguridad. Se han publicado varios ensayos clínicos que avalan dicha utilidad46-48.
Otros usos y futuras posibles utilidades
Eje intestino-cerebro (ansiedad-depresión)
Se ha descrito el importante papel que desempeña la microbiota intestinal en la comunicación bidireccional entre intestino y cerebro; la comunidad científica está cada vez más convencida de que nuestro intestino tiene un importante papel en nuestra salud mental49.
En 2016 se publicó un metaanálisis que resume la experiencia en la relación entre probióticos y depresión, ya que los resultados recogieron que el uso de probióticos redujo el riesgo de depresión en sujetos sanos, así como la sintomatología depresiva en sujetos deprimidos, pero solamente en el grupo de edad de menos de 60 años49.
Dermatitis atópica
En la publicación de Farid y cols. se recoge el estudio de los efectos clínicos e inmunológicos de un simbiótico, mezcla de siete cepas de bacterias más un prebiótico, en un total de 40 pacientes (bebes y niños con una edad media de 23 meses) con dermatitis atópica. Fue un estudio aleatorio, doble ciego y controlado con placebo, con una duración de 8 semanas en el que se pudo observar que la mezcla de siete cepas de bacterias podía mejorar clínicamente la gravedad de la misma en niños pequeños50.
Se están produciendo avances en otras enfermedades dermatológicas, pero aún faltan estudios concluyentes. Acné, rosácea, eccema e infecciones fúngicas son motivo de ensayos y tendremos que esperar a sus conclusiones. Asimismo, hay estudios no concluyentes sobre el papel protector de los probióticos en la acción de la insolación sobre la piel.
Aplicaciones en el envejecimiento
Muchos son los artículos publicados en relación con el proceso de envejecer y la utilidad de los probióticos en el mismo. Está clara la denominada inmunosenescencia y la pérdida de microbiota bacteriana en la población mayor51. Se intenta mejorar el sistema inmune y disminuir la escasez de microorganismos beneficiosos en edades avanzadas, lo que puede determinar la forma de envejecer y la progresión del deterioro general del organismo.
Los escasos probióticos utilizados para tal fin demuestran la capacidad de mejora del sistema inmunitario y, por ende, la disminución de los procesos inflamatorios. De hecho, se han probado en animales de laboratorio, en los que se mejora la capacidad de fagocitosis de los macrófagos, la actividad antitumoral de las células natural killer, la quimiotaxis, la linfoproliferación… Su acción radica en la capacidad antioxidante y antiinflamatoria de los probióticos. Hay que esperar a nuevas investigaciones en este campo para ver resultados de eficacia52.
Enfermedad inmunitaria, infecciones e inmunización
Diversos estudios han investigado la acción de los probióticos sobre enfermedades infecciosas de vías altas y bajas en población pediátrica, con resultados contradictorios en unos casos y poco concluyentes en otros. Se ha estudiado en gripe (WiKi y cols., 2014), otitis media (Liu y cols., 2013), infecciones respiratorias y fórmulas lácteas (Maldonado y cols., 2014).
Se está estudiando la inmunización y sensibilización a las vacunas fundamentalmente orales (polio, rotavirus, cólera) con resultados aún pobres, pero que van en la dirección de que la asociación de vacunas a probióticos puede potenciar la respuesta inmune postvacunal sin efectos adversos (Soh 2010, Kukkonen 2006, Licciardi 2013, Jespersen 2015…). La utilización de bacterias acidolácticas recombinantes como vectores de nuevas vacunas orales es un campo prometedor en el futuro53.
Enfermedad cardiovascular y metabólica
Basado en la acción antioxidante y antiinflamatoria de los probióticos, así como en su capacidad de sintetizar determinadas proteínas y péptidos bioactivos con actividad antihipertensiva (casoquinina o lactoquinina) o inhibiendo la enzima convertidora de la angiotensina, se han estudiado diversas aplicaciones en el campo del riesgo cardiovascular. Estas acciones de algunos lactobacilos se han visto incrementadas cuando se han utilizado multicepas mejor que una sola cepa; su efecto antihipertensivo supuso una reducción mayor en el primer caso. Asimismo, parece despertar interés la acción de los ácidos grasos de cadena corta (SCFA), que actúan disminuyendo la tensión arterial. Las dietas ricas en fibra, que aumentan estos SCFA, reducen la presión arterial.
La dislipemia también es un campo de interés científico en su relación con la microbiota y los probióticos. La microbiota intestinal desempeña un papel destacado en la absorción de grasa en el intestino. Con Lactobacillus plantarum se ha demostrado que se incrementa la diversidad bacteriana del colon y aumentan los niveles de SCFA relacionados con la dislipemia, bien disminuyendo su síntesis o bien convirtiendo el colesterol en coprostanol a través de la enzima hidrolasa de las sales biliares.
Por último, también ha sido investigada la relación de los probióticos y la diabetes mellitus. Parece que regulan la actividad del sistema inmune con la consiguiente disminución de la destrucción de célula beta-pancreática, la mejora de la sensibilidad a la insulina y la reducción de la producción de glucagón.
La relación entre la microbiota, la alimentación y la enfermedad ha quedado bien establecida. Hay que estudiar los mecanismos íntimos entre ellas y habrá que esperar a que los ensayos clínicos vayan aportando mayor experiencia54,55.
Enfermedades alérgicas y neumológicas
Hemos visto su papel en la dermatitis atópica y su acción moduladora de la inmunidad. Se han estudiado diversas enfermedades de tipo alérgico para definir la acción probiótica en dichas alteraciones.
Así, están siendo valoradas en la rinitis alérgica y en las intolerancias alérgicas a determinados alimentos en edad pediátrica (alergia a la proteína de vaca…). La síntesis de sustancias bioinmunomoduladoras ejercen un papel destacado y son generadas por la microbiota intestinal fundamentalmente. Estas sustancias actúan sobre las células inmunitarias y regulan mecanismos de expresión génica, epigenéticos. Los resultados también han sido aquí mixtos.
El metaanálisis de Guvenc en 2016 aportó mejora en los síntomas de la rinitis alérgica estacional. La especie mejor valorada fue Lactobacillus paracasei. En asma alérgica no se han observado efectos positivos de momento. El efecto de la microbiota intestinal en relación con las alergias alimentarias está siendo muy estudiado, pero no se pueden ofrecer datos concretos hasta el momento, aunque sí se ha visto que existe cierta disbiosis en estos pacientes (aumento de firmicutes y bacterioidetes). Dietas ricas en lactobacilos y bifidobacterias desde muy temprana edad están consiguiendo mejoras en estas alteraciones56,57.
Aplicación en urología
Conocidos los mecanismos por los que la microbiota urotelial se protege de las infecciones del tracto urinario (ITU), es fácil suponer que los prebióticos ejercen una acción positiva sobre la barrera que suponen a otros gérmenes patógenos.
Se han probado en los estudios realizados varias cepas intentando buscar la que ofrezca mejores resultados. Lactobacillus rhamnosus de la subespecie GR-1 presenta mejor acción protectora que el Lactobacillus reuteri RC-14 y el Lactobacillus rhamnosus GG, especies con buenos resultados. La asociación de Lactobacillus rhamnosus GR-1 con Lactobacillus reuteri RC-14 ha sido estudiada, no solo en tratamiento adyuvante a antibioterapia de la ITU, sino también en la prevención de colonización para recurrencias de ITU con buenos resultados (Beerepoor y cols. 2012; Lee y cols. 2016). Estas cepas muestran una eficacia similar a los antibióticos de uso empírico en estas ITU, sin los efectos secundarios de estos. Recordemos que los lactobacilos forman co-agregados y biopelículas que destruyen los uropatógenos. Estudios realizados con L. crispatus en ITU recurrentes demostraron disminución de estas frente a placebo.
Metaanálisis realizados con diversas cepas de lactobacilos ofrecen buenos resultados para unas y negativos para otras; las eficaces disminuyen las recurrencias de una manera estadísticamente significativa.
Asimismo, se ha ensayado la comparativa de cepas de E. coli 83972 frente a ciprofloxacino en las bacteriurias asintomáticas. El primero es mucho más eficaz en la eliminación de los uropatógenos (Klebsiella, Proteus, E. coli, Enterococcus) y genera mayor alivio sintomático58.
También en urolitiasis se ha ensayado la administración de probióticos. La microbiota urotelial es menos tendente a la litiasis, de manera que se ha observado una relación inversa entre Oxalobacter formigenes en el intestino y el desarrollo de cálculos de oxalato cálcico. En humanos la administración de O. formigenes cepa HC1 redujo la excreción de oxalato y la tasa de oxalato/creatinina en orina. Este probiótico aún no está aprobado para su utilización en el mercado. Se están ensayando con otras opciones58,59.
Por último, en el cáncer vesical se están ensayando varias cepas. De hecho, uno de los tratamientos básicos son la resección transuretral y la inmunoterapia con instilación de Bacilo de Calmette-Guerin (vacuna atenuada de Micobacterium tuberculosis) con resultados regulares. Se ha ensayado en roedores con cepas de Lactobacillus casei y se ha comprobado que reducen el crecimiento de los tumores vesicales y de las metástasis pulmonares. Igualmente, en modelos murinos se han conseguido avances importantes. Habrá que esperar a tener mayor experiencia59,59.
Aplicaciones en oncología
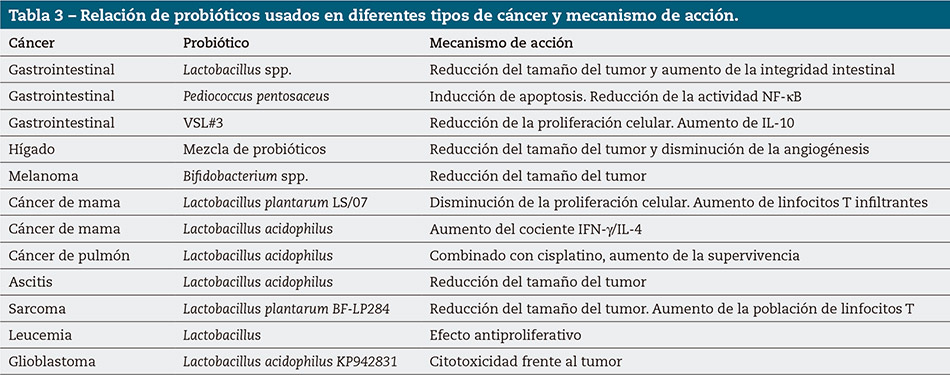
Los prebióticos pueden usarse como terapia adyuvante tanto en tumores gastrointestinales como extradigestivos. Los mecanismos que se plantean son los referidos a los cambios inmunitarios, así como sobre el propio tumor. En la tabla 3 se adjunta información sobre este aspecto. Aún queda mucho camino por recorrer, pero la investigación avanza rápido.
Trasplante fecal
Por ser un asunto de máxima actualidad y con un gran aporte investigador tras él, añadimos este campo tan prometedor en la utilización de los probióticos en medicina.
El principio básico sobre el que se sustenta es el beneficio para la salud que la microbiota intestinal ejerce sobre el ser humano. Ya era utilizado en la China del s. IV, donde se preparaba una suspensión oral para el tratamiento de la diarrea grave y el envenenamiento alimentario. En la segunda guerra mundial los beduinos usaban las heces de camello para tratar la disentería bacteriana y fue confirmado por los soldados alemanes destinados en África. En este último siglo, en 2013, se han publicado algunos ensayos aleatorizados y controlados frente a vancomicina por un grupo holandés (Van Nood), que describió tasas de curación en la diarrea por Clostridium recidivante del 94 % frente al 23 % con antibiótico; también el grupo del italiano Cammarota ha informado de resultados similares60.
El trasplante fecal (TF) es la transferencia de material microbiano fecal de un donante sano (previamente procesada y preparada) a un receptor que presenta una condición clínica relacionada con la disbiosis, con la finalidad de restaurar el equilibrio microbiano intestinal normal.
El TF es el método más eficaz para tratar la infección recidivante por Clostridium difficile y supone una terapia emergente para el tratamiento de otras condiciones clínicas, algunas ya expuestas más arriba, asociadas con la disbiosis intestinal. Últimos estudios están aplicando esta terapia en la enfermedad inflamatoria intestinal, la colitis ulcerosa y la enfermedad de Crohn con resultados discretos (Moayyedi y cols., y Rossen y cols.).
Cochrane realizó una revisión en 2018 sobre el uso en la colitis ulcerosa. Concluye que puede aumentar la proporción de participantes que logran la remisión clínica, aunque con estudios escasos y calidad de la evidencia baja61. Parece más claro que los pacientes que responden bien sufren un cambio en su microbiota para parecerse a la del donante.
Estudios actuales indican como clave del éxito la composición de la microbiota del donante. Se necesitan estudios que tipifiquen bien a los donantes, las preparaciones, la dosificación y la vía de administración.
Es necesaria la implementación de un protocolo de cribado adecuado a los donantes que evite la transmisión de material indeseable, así como ensayos clínicos para determinar el verdadero papel del mismo en la práctica clínica.
Recomendaciones de las Sociedades Científicas
Las Sociedades Científicas adjudican diferentes grados de recomendación y nivel de evidencia a partir de la calidad de los ensayos clínicos realizados con los diferentes probióticos existentes en el mercado.
Algunas de las más importantes sociedades contemplan, según nivel de evidencia, las recomendaciones destacadas a continuación:
- ESPGHAN (Sociedad Europea de Gastroenterología y Hepatología pediátrica): recoge la recomendación del uso de L. rhamnosus GG para prevenir la diarrea asociada a antibióticos, así como para el tratamiento de niños con gastroenteritis aguda como complemento de la terapia de rehidratación62.
- Workshop Yale/Harvard: indican el uso de L. rhamnosus GG en la prevención de la diarrea asociada a antibióticos (nivel de evidencia A)42.
- WGO (Organización Mundial de Gastroenterología): recoge indicaciones sobre el uso de probióticos para adultos y niños basadas en la experiencia con probióticos, prebióticos y simbióticos en gastroenterología (Tabla 4)41. Lactobacillus rhamnosus GG es la cepa probiótica más ampliamente estudiada y presenta más de 14 publicaciones que avalan sus beneficios41.
Conclusión
La experiencia científica disponible y las guías de las principales Sociedades Científicas indican que los probióticos aportan un beneficio más allá de la diarrea ocasional o la gastroenteritis de origen vírica o asociada a antibióticos.
Actualmente existen diferentes formas farmacéuticas de probióticos que garantizan la viabilidad y liberación de las cepas probióticas, además de permitir al consumidor una sencilla utilización del probiótico y conseguir así un mayor cumplimiento terapéutico.
Una de las características más importantes que define a un probiótico es formar parte de la microbiota residente humana, lo que garantiza, en gran medida, la seguridad de este grupo de microorganismos.
El uso de probióticos otorga un beneficio clínico en el tratamiento de diferentes patologías (diarrea asociada a antibióticos, diarrea de origen vírico, infección por H. pylori…) y logra acelerar la recuperación y aliviar la sintomatología de los pacientes. Este beneficio se traduce en una menor demanda de asistencia sanitaria, menor gasto farmacéutico, una disminución del absentismo laboral y, en definitiva, un menor coste para el Sistema Nacional de Salud (SNS).
Asimismo, pese a que los probióticos no están financiados por el SNS, al tratarse de tratamientos cortos, en la mayoría de los casos, suponen un coste asumible por el paciente.
Por todo ello, los probióticos deberían entrar a formar parte de manera más frecuente del arsenal terapéutico con el que los médicos de atención primaria disponen, al menos como coadyuvante a la hora de tratar diferentes patologías gastrointestinales y genitourinarias, entre otras.
A la vista de la revisión que hemos realizado, consideramos importante resaltar una serie de puntos a modo de resumen y práctica de uso. Partiendo de los conceptos esenciales basados en la bibliografía utilizada, como puede ser que el efecto sea dosis-dependiente, es decir, que a mayor carga probiótica mayor eficacia, y del hecho de que productos multiespecie y multicepa presenten un efecto sinérgico o sumatorio que aumenta su eficacia, lo cierto es que cada prebiótico, probiótico o simbiótico debe ser estudiado de manera individual:
- El empleo de cepas o asociaciones específicas de ellas, la cantidad de las mismas y la tecnología farmacéutica que garantiza la viabilidad de los microorganismos en el tejido diana al que deben llegar, debe presentar ensayos clínicos de calidad realizados en población humana y aplicando metodología científica adecuada para demostrar el beneficio de uso y la seguridad.
- Los ensayos realizados con el producto terminado deben realizarse en patologías específicas y sobre grupos de edad concretos (niños, adultos, ancianos); no pueden ser extrapolados de unos a otros.
- Los resultados los estudios y ensayos clínicos realizados con el producto determinarán el grado de recomendación y el nivel de evidencia.
- La carga probiótica administrada de la cepa seleccionada es uno de los determinantes del efecto beneficioso. Para alcanzarla es necesario que la forma farmacéutica, las características organolépticas (sabor, olor…) y la dosis del producto comercializado garanticen cubrir dicha carga probiótica y poder conseguir el efecto beneficioso.
Creemos que esta visión de conjunto de los probióticos y prebióticos (simbióticos) ayudará a los médicos de familia a tener una información más completa, lo que redundará en un mejor conocimiento de lo que es posible proponer como terapia al paciente ante diversas situaciones clínicas, así como poder informar mejor a los pacientes que están tomando estos productos. La limitada extensión de estos artículos, aun siendo amplia, no permite ser más explícito en muchas de las cuestiones que se plantean. La velocidad a la que aparecen publicaciones sobre este tema hace impensable ser más ambicioso. Esperamos ver cumplidas las expectativas puestas en esta actualización.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- International Scientific Association for Probiotics and Prebiotics (ISAPP, http://www.isapp.net/; 2002) y, en el ámbito nacional, la Sociedad Española de Probióticos y Prebióticos (SEPyP; http://www.sepyp.es/es/home; 2011).
- Schrezenmeir J, de Vrese M. Probiotics, prebiotics, and synbiotics – approaching a definition. Am J Clin Nutr. 2001; 73(2 Suppl): 361S-4S.
- Desarrollo histórico de la Microbiología. [Consultado abril 2020] Disponible en: https://www.ugr.es/~eianez/Microbiologia/01historia.htm
- Rodríguez Gómez JM. Historia de los Probióticos. En: Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. 2017. Disponible en: www.microbiotayprobioticos.com
- Agencia española de seguridad alimentaria y nutrición. 2020. [Consultado abril 2020] Disponible en: http://www.aecosan.msssi.gob.es/AECOSAN/web/seguridad_alimentaria/subdetalle/probioticos.htm
- Rodriguez JM. Probióticos: del laboratorio al consumidor. Nutr Hosp. 2015; 31(Suppl1): S33-47.
- Declaraciones consensuadas del Workshop “Probióticos y salud. Evidencia científica”. Madrid, 18 de Diciembre 2009. Disponible en: https://semipyp.es/pdf/pub/consenso_probioticos.pdf
- Rodríguez JM, Álvarez Calatayud G. Probióticos: Conceptos Generales. Legislación. En: Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. 2017. Disponible en: www.microbiotayprobioticos.com
- Guarner F, Khan AG, Garisch J, Aliakim R, Gangl A, Thomson A, et al. World Gastroenterology Organisation Global Guidelines: probiotics and prebiotics October 2011. J Clin Gastroenterol. 2012; 46: 468-81.
- Ng SC, Hart AL, Kamm MA, Stagg AJ, Knight SC. Mechanisms of action of probiotics: recents advances. Inflamm Bowel Dis. 2009; 15: 300-10.
- Timmerman HM, Koning CJM, Mulder L, Rombouts FM, Beynen AC. Monostrain, multistrain and multispecies probiotics-A comparison of functionality and efficacy. Int J Food Microbiol. 2004; 96: 219-33.
- Agency for Healthcare Research and Quality U.S. Department of Health and Human Services. Safety of probiotics to reduce risk and prevent or treat disease. Evid Rep Technol Assess. 2011; 200: 1-645.
- Tolín Hernani M, Álvarez Calatayud G. Seguridad en el empleo de los probióticos. En: Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. 2017. Disponible en: www.microbiotayprobioticos.com
- Food and Agricultural Organization of the United Nations and World Health Organization. Joint FAO/WHO working group report on drafting guidelines for the evaluation of probiotics in food. FAO 2002.
- Clemente Gimeno A. Prebióticos: Características generales y propiedades. En: Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. 2017. Disponible en: www.microbiotayprobioticos.com
- Corzo N, Alonso JL, Azpiroz F, Calvo MA, Cirici M, Leis R, et al. Consenso científico sobre prebióticos. Octubre 2014. Disponible en: https://semipyp.es/pdf/pub/consenso_prebioticos.pdf
- Scientific Concepts of Functional Foods in Europe Consensus Document. Br J Nutr. 1999; 81: S1-27.
- Bengmark S, Ortiz de Urbina JJ. Alimento funcionales. Simbióticos: Una nueva estrategia en el tratamiento de pacientes críticos. Nutr. Hosp. 2005; 20: 147-56.
- Markowiak P, Slizewska K. Effects of probiotics, prebiotics, and symbiotics on human health. Nutrients. 2017; 9: 1021.
- Gnoth MJ, Kunz C, Kinne-Saffran E, Rudloff S. Human milk oligosaccharides are minimally digested in vitro. J Nutr. 2000; 130: 3014-20.
- De Felippe JJ, Da Rocha e Silva JM, Marciel FM, Soares A de M, Mendes NF. Infection prevention in patients with severe multiple trauma with the immunomodulator 1-3 polyglucose (glucan). Surg Gynecol Obstet. 1993, 177: 383-8.
- Guarner Aguilar F, Álvarez Calatayud G, Pérez Moreno J. Web El prebiótico.com. Evidencia y práctica clínica de los probióticos para el profesional de la Salud. En: Curso sobre evidencia científica y GPC para el empleo de probióticos, prebióticos y simbióticos [Consultado abril 2020]. Disponible en: https://www.elprobiotico.com
- Portillo M. Diarrea asociada a antibióticos. FMC. 2001; 8: 663-71.
- Romeo A. Efficacy of a 7-strain symbiotic mixture in combination with oral antibiotic treatment in preventing antibiotic-associated diarrhea (AAD). PRODEGGIO Study. Presented in the World Congress of Gastroenterology, Istanbul 21-24 Sept 2019.
- Alemany Vilches L, Moraga Llop F, García Jiménez S. Epidemiología de las infecciones por rotavirus. Hospitalizaciones, casos comunitarios e infección nosocomial. 6ª Monografía de la Sociedad Española de Epidemiología. EMISA; 2007.
- Román E, Barrio J, López MJ. Diarrea aguda. En: SEGHNP-AEP, editores. Protocolos diagnóstico-terapéuticos de Gastroenterología, Hepatología y Nutrición Pediátrica. Madrid: Ergon; 2010. p. 11-20. Disponible en: https://www.aeped.es/sites/default/files/documentos/diarrea_ag. pdf
- García Menor E, et al. Evaluación clínica del simbiótico Prodefen en niños de 6 meses a 2 años con diarrea aguda de probable etiología viral. JPGN. 2016; 62 (Suppl 1).
- Asensio A, Bouza E, Grau S, Rubio Rodríguez D, Rubio Terrés C. Coste de la diarrea asociada a Clostrium difficile en España. Rev Esp Salud Pública. 2013; 87: 25-33.
- Sánchez F, Gilbert JJ, Bedate P, Espín B. Estreñimiento y encopresis. En: SEGHNP-AEP, editores. Protocolos diagnóstico-terapéuticos de Gastroenterología, Hepatología y Nutrición Pediátrica. Madrid: Ergon; 2010. p. 53-66. Disponible en: https://www.aeped.es/sites/default/files/documentos/estre_encopresis. pdf
- Sadeghzadeh M, Rabieefar A, Khoshnevisasl P, Mousavinasab N, Eftekhari K. The effect of probiotics on childhood constipation: A randomized controlled double blind clinical trial. Int J Pediatr. 2014; 2014: 937212 .
- Gisbert JP, Molina Infante J, Amador J, Bermejo F, Bujanda L, Calvet X, et al. IV Conferencia Española de Consenso sobre el tratamiento de la infección por Helicobacter pylori. Gastroenterol Hepatol. 2016; 39: 697-721.
- Martínez MJ, Perdomo M. Infección por Helicobacter pylori en niños. En: SEGHNP-AEP, editores. Protocolos diagnóstico-terapéuticos de Gastroenterología, Hepatología y Nutrición Pediátrica. Madrid: Ergon; 2010. p. 93-8. Diponible en: https://www.aeped.es/sites/default/files/documentos/h_pylori. pdf
- Khodadad A, Farahmand F, Najafi M, Shoaran M. Probiotics for the treatment of pediatric Helicobacter pylori infection: A randomized double blind clinical trial. Iran J Pediatr. 2013; 23: 79-84.
- Passos C, Morales-Filho J. Intestinal microbiota in digestive diseases. Arq Gastroenterol. 2017; 54: 255-62.
- Didari T, Mozaffari S, Nikfar S, Abdollahi M. Effectiveness of probiotics in IBS. World J Gastroenterol. 2015; 21: 3072-84.
- Capurso L. Thirty years of Lactobacillus rhamnosus GG. A review. J Clin Gastroenterol. 2019; 53(Suppl 1): 1-41.
- Igarashi M, Nakae H, Matsuoka T, Takahashi S, Hisada T, Tomita J, et al. Alteration in the gastric microbiota and its restoration by probiotics in patients with functional dyspepsia. BMJ Open Gastro. 2017; 4: e000144.
- Zhong C, Qu C, Wang B, Liang S, Zeng B. Probiotics for preventing and treating small intestinal bacterial overgrowth. A meta-analysis and systematic review of current evidence. J Clin Gastroenterol. 2017; 51: 300-11.
- Díaz JJ, Alvarez-Calatayud G. Probióticos. En: SEGHNP, editor. Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica. Madrid: Ergon; 2016. p. 831-44.
- Espín B, Díaz JJ. Diarrea y trastornos funcionales digestivos en Pediatría. En: Álvarez-Calatayud G, Marcos A, Margollés A, editores. Probióticos, prebióticos y salud: Evidencia científica. Madrid: Ergon; 2016. p. 207-12.
- Guarner F, Sanders ME, Kaufmann P, de Paula JA, Fedorak R, Garisch J, et al. World Gastroenterology Organisation Global Guidelines: probiotics and prebiotics February 2017. Disponible en: www.worldgastroenterology.org/probiotics-prebiotics.html
- Floch MH, Walker WA, Sanders ME, Nieuwdorp M Kim AS, Brenner DA, et al. Recommendations for probiotic use-2015. Update Proceedings and Consensus Opinion. J Clin Gastroenterol. 2015; 49 (Suppl 1): 69-73.
- Beltrán Vaquero D, Guerra Guirao JA. Aplicaciones clínicas de los probióticos en Ginecología. Curso Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. Madrid: Ergon; 2019. Disponible en: www.microbiotayprobióticos.com
- Castro A, González M, Tarín JJ, Cano A. Role of probiotics in Obstetrics and Gynecology. Nutr Hosp. 2015; 31 (Suppl 1): 26-30.
- Griffin C. Probiotics in obstetrics and gynaecology. Aust N Z J Obstet Gynaecol. 2015; 55: 201-9.
- Beltrán Vaquero DA, Crespo Garzón AE, Rodríguez Bravo TC, Garcia Iglesias Á. Infectious mastitis: a new solution for an old problem. Nutr Hosp. 2015; 31(Suppl 1): 89-95.
- Bergmann H, Rodríguez JM, Salminen S, Szajewska H. Probiotics in human milk and probiotic supplementation in infant nutrition: a workshop report. Br J Nutr. 2014; 112: 1119-28.
- Fernández L, Arroyo R, Espinosa I, Marín M, Jiménez E, Rodríguez JM. Probiotics for human lactational mastitis. Benef Microbes. 2014; 5: 169-83.
- Martínez Ml. Nutrición y Psiquiatría: Una actualización práctica. Actas Esp Psiquiat. 2017; 45 (Suppl1).8-15.
- Farid R, Ahanchian H, Jabbari F, Moghiman T. Effect of a new symbiotic mixture on atopic dermatitis in children: a randomized-controlled trial. Iran J Pediatr. 2011; 21: 225-30.
- De la Fuente M. Los probióticos en el envejecimiento. Efectos sobre el sistema inmunológico. En: SEGG, editor. Guía de Buena Práctica Clínica en Geriatría: Papel de la microbiota y empleo de probióticos en adultos y mayores. Madrid; 2017. p. 59-70.
- Martínez de Toda I, Mate I, Vida C, Cruces J, De la Fuente M. Immune function parameters as markers of biological age and predictors of longevity. Aging. 2016; 8: 3110-9.
- Santos Sebastián M, Pérez Méndez C. Prebióticos en la prevención y el tratamiento de las enfermedades infecciosas. Vacunas. En: Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. 2017. Disponible en: www.microbiotayprobioticos.com
- DiRienzo DB. Effect of probiotics on biomarkers of cardiovascular disease: implications for heart-healthy diets. Nutr Rev. 2014; 72: 18-29.
- Ettinger G, MacDonald K, Reid G, Burton JP. The influence of the human microbiome and probiotics on cardiovascular health. Gut Microbes. 2014; 5: 719-28.
- Fiocci A, Pawankar R, Cuello-Garc.a C, Ahn K, Al-Hammadi S, Agarwal A, et al. World Allergy Organization-McMaster university guidelines for allergic disease prevention (GLAD-P): Probiotics. World Allergy Organ J. 2015; 8: 4.
- Huang YJ, Marsland BJ, Bunyavanic, O’Mahony L, Leung DYM, Muraro A, et al. The microbiome in allergic disease: Current understanding and future opportunities-2017 PRACTALL document of the American Academy of Allergy, Asthma & Immunology and the European Academy of Allergy and Clinical Immunology. J Allergy Clin Immunol. 2017; 139: 1099-110.
- Whiteside SA, Razvi H, Dave S, Reid G, Burton JP. The microbiome of the urinary tract—a role beyond infection. Nat Rev Urol. 2015; 12: 81-90.
- Reid G, Bruce AW. Probiotics to prevent urinary tract infections: the rationale and evidence. World J Urol. 2006; 24: 28-32.
- Guardiola Capón J, Arajol González C. Trasplante fecal. En: Actualización en Microbiota Autóctona, Probióticos y Prebióticos. 2ª ed. 2017. Disponible en: ww.microbiotayprobioticos.com
- Imdad A, Nicholson MR, Tanner-Smith EE, Zackular JP, Gomez-Duarte OG, Beaulieu DB, et al. Fecal transplantation for treatment of inflammatory bowel disease. Cochrane Database Syst Rev. 2018; (11): CD012774.
- Szajewska H, Guarino A, Hojsak I, Indrio F, Kolacek S, Shamir R, et al; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. Use of probiotics for management of acute gastroenteritis: a position paper by the ESPGHAN Working Group for Probiotics and Prebiotics. J Pediatr Gastroenterol Nutr. 2014; 58: 531-9.